Épidémiologie des accidents vasculaires cérébraux en France
// Epidemiology of stroke in France
Résumé
Introduction –
Près de 10 ans après le premier Plan national « accidents vasculaires cérébraux (AVC) 2010-2014 », cette étude fait le point sur l’épidémiologie des AVC identifiés par le Système national des données de santé (SNDS), leur prise en charge et leur devenir.
Méthodes –
Les patients âgés de plus de 18 ans hospitalisés pour un AVC en 2022 ont été identifiés à partir des données médico-administratives et les analyses stratifiées sur le type d’AVC. La prévalence de l’AVC au 1er janvier 2023 a été définie par le nombre de personnes vivantes à cette date avec un antécédent d’hospitalisation pour AVC ou une affection longue durée pour cette pathologie (2012-2022). Les taux d’incidence et de prévalence pour 100 000 habitants ont été calculés en utilisant les données de population des statistiques nationales françaises. Les patients ont été suivis jusqu’à un an après l’hospitalisation pour AVC afin de relever entre autres le statut vital, les taux d’admission en soins médicaux et de réadaptation (SMR), de consultation post-AVC chez un neurologue, et de traitements médicamenteux.
Résultats –
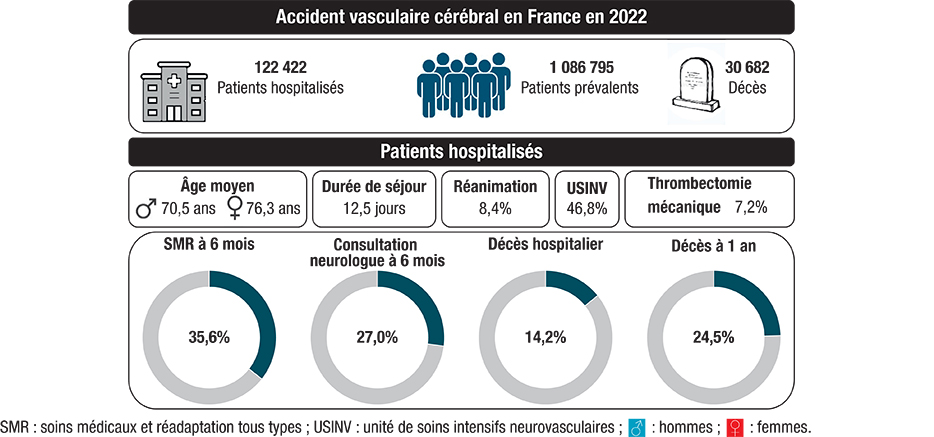
En 2022, 122 422 adultes ont été hospitalisés au moins une fois pour un AVC, et la prévalence de l’AVC estimée à 1 086 795 cas. Les départements et régions d’outre-mer (DROM), les départements des Côtes-d’Armor, du Nord, du Pas-de-Calais, de Seine-Saint-Denis, plusieurs départements du Sud-Ouest, ainsi que les personnes résidant dans les communes les plus défavorisées de métropole présentaient des taux beaucoup plus élevés par rapport au taux national. Une admission en unité de soins intensifs neurovasculaires était retrouvée chez 46,8% des patients, avec des variations importantes selon le département, l’âge et le sexe. Parmi les survivants à 6 mois, le suivi mettait en évidence un taux d’admission en SMR de 34,3% pour les AVC ischémiques et 41,7% pour les hémorragiques, et seuls 28,8% et 18,8% des AVC ischémiques et hémorragiques respectivement avaient eu une consultation chez un neurologue, et 19,5% des AVC ischémiques ont été vus par un cardiologue dans les 6 mois. La létalité à un an était de 20,8% des patients hospitalisés pour un AVC ischémique et 37,9% de ceux hospitalisés pour un AVC hémorragique.
Conclusion –
Des variations importantes de la survenue et de la prise en charge des AVC ont été observées dans l’espace et aussi dans le temps depuis le plan AVC 2010-2014 en France. Une très faible partie des patients bénéficient aujourd’hui d’une thrombectomie mécanique pour les AVC ischémiques. Ces résultats montrent la nécessité d’une prévention plus efficace de l’AVC dans certains territoires et populations, de la régularité des campagnes d’information sur les signes et symptômes de l’AVC et de la conduite à tenir le cas échéant, et d’améliorer l’offre et l’accessibilité des patients aux unités neurovasculaires (UNV) et de leur suivi.
Abstract
Background –
It has been nearly 10 years since the first national stroke plan in France. The aim of this article is to examine the epidemiology of strokes, how they are managed and patient outcomes.
Methods –
Adults hospitalized for stroke in 2022 were identified in the national database. Stroke prevalence at 1 January 2023 was defined as the number of people alive at that date with a history of hospitalization for stroke or a chronic long-term disease status due to stroke (2012–2022). Patients were monitored up for up to 1 year after hospitalization for a stroke.
Results –
In 2022, 122,422 adults were hospitalized due to stroke, and there were an estimated 1,086,795 cases. Important geographical and socioeconomic disparities were observed. Admission to a stroke intensive care unit was found in 46.8% of patients, with significant variations by department of residence, age and gender. Only 7.2% of ischaemic strokes resulted in mechanical thrombectomy. Among survivors at 6 months, admission to a rehabilitation unit was found for 34.3% for patients with ischaemic strokes and 41.7% of those with haemorrhagic strokes, while 28.8% and 18.8%, respectively, had a consultation with a neurologist, and 19.5% and 10.9% were seen by a cardiologist within 6 months. Mortality rates after 1 year were 20.8% and 37.9% among patients hospitalized due to ischaemic and haemorrhagic strokes, respectively.
Conclusion –
The considerable numbers and rates of stroke – and disparities by age, sex and area – highlight the need for more effective stroke prevention, regular information campaigns on the symptoms of stroke and improved availability and accessibility of stroke units.
Introduction
L’accident vasculaire cérébral (AVC) est défini cliniquement par la survenue brutale d’un déficit neurologique lié à une lésion focale vasculaire cérébrale. Plusieurs types d’AVC sont caractérisés par des mécanismes physiopathologiques sous-jacents très différents, malgré des symptômes souvent similaires : les AVC ischémiques, dus à l’obstruction d’un vaisseau cérébral d’origines diverses (athérosclérose, cardiopathie, maladies des petits vaisseaux, autres vasculopathies, troubles de la coagulation, perturbations hématologiques, etc.), et les AVC hémorragiques hors causes traumatiques, identifiés par la présence de saignements dans le parenchyme pour les hémorragies intracérébrales (HIC), et dans l’espace entre la pie-mère et la membrane arachnoïde pour les hémorragies sous-arachnoïdiennes (HSA). De la même façon, plusieurs mécanismes peuvent être à l’origine d’une HIC, principalement la rupture d’un petit vaisseau associée à une hypertension, mais aussi une microangiopathie, une angiopathie amyloïde, un anévrysme congénital, une malformation artérioveineuse, et d’une HSA, le plus souvent due à une rupture d’anévrysme associée à une malformation artérioveineuse 1.
Dans le monde, on estimait à 12,2 millions le nombre de cas d’AVC incidents en 2019 et à près de 94 millions de cas leur prévalence selon les estimations du Global Burden of Disease (GBD) 2,3. Les années de vies vécues avec incapacités associées aux AVC sont très élevées dans la mesure où la majorité des patients qui survivent de leur AVC présentent des séquelles 2,3,4,5,6,7,8. Dans l’étude du GBD, les cas d’AVC étaient principalement attribuables à l’hypertension artérielle, l’obésité et le surpoids, le diabète, le tabagisme, et plus spécifiquement du LDL-cholestérol élevé pour les AVC ischémiques, et de la consommation d’alcool pour les HIC 2. D’autre part, la fibrillation atriale est désormais considérée comme la principale cause des infarctus cérébraux, touchant près d’un tiers des patients 9.
L’épidémiologie des AVC évolue rapidement en France avec, d’une part, une augmentation attendue du nombre de cas incidents et prévalents due au vieillissement de la population française et à l’amélioration de la survie des AVC ischémiques 10,11. La mortalité par AVC a diminué depuis les années 1980 12, mais elle n’avait pas évolué entre 2008 et 2013 chez les femmes âgées entre 55 et 64 ans, ainsi que chez les hommes et les femmes de plus de 85 ans 13. De plus, une augmentation de l’incidence et des hospitalisations pour AVC ischémiques a été observée chez les adultes de moins de 65 ans depuis une quinzaine d’années en France. Ce signal épidémiologique rapporté initialement par le registre dijonnais des AVC a depuis été confirmé au niveau national par les données hospitalières 13,14,15,16,17. Ces tendances très défavorables font peser un lourd fardeau sur la société compte tenu du coût important associé à l’hospitalisation pour AVC et ces séquelles, notamment chez des adultes encore actifs professionnellement 18.
L’objectif de notre travail était de dresser l’état des lieux des AVC en France plus de 10 ans après la mise en œuvre des mesures du plan national d’actions « Accidents vasculaires cérébraux 2010-2014 » par les ministères de la Santé et des Sports, du Travail, de la Solidarité et de la Fonction publique, et de l’Enseignement supérieur et de la Recherche 19.
Méthode
Cette étude a été réalisée à partir du Système national des données de santé (SNDS) regroupant les données médicales et administratives des séjours hospitaliers aussi bien dans les hôpitaux publics que privés 20. La méthodologie détaillée (description de la base de données et des indicateurs épidémiologiques) est à retrouver dans le supplément de ce numéro (1).
Identification des patients hospitalisés pour accident vasculaire cérébral
À partir du Programme de médicalisation des systèmes d’information, volet médecine chirurgie obstétrique (PMSI-MCO), une hospitalisation pour AVC a été identifiée par un code de la Classification internationale des maladies – 10e révision (CIM-10) : I60 (HSA), I61 (HIC), I62 (autres hémorragies intracrâniennes non traumatiques), I63 (AVC ischémique) ou I64 (AVC non précisé comme étant hémorragique ou un AVC ischémique) apparaissait en diagnostic principal (DP) ou relié (DR) du séjour ou d’une unité médicale (UM) dans laquelle le patient est passé lors de son séjour, ou par la présence d’un acte de thrombectomie mécanique lors d’un séjour hospitalier (code Classification commune des actes médicaux – CCAM EAJF341). Les AVC ont été classés comme ischémiques si le patient avait eu un acte de thrombectomie mécanique, ou présentait un code I63 ou I64 (ce dernier code faisant souvent référence à des AVC ischémiques d’origine non précisée), et comme hémorragiques en présence des codes I60 à I62. Les HIC repérées à l’aide du code I61 ont été isolées pour certaines analyses en sous-groupes. Les hospitalisations de jour (sans nuitée) ne se terminant pas par un décès, et celles associées à des séances ont été exclues. Les patients âgés de moins de 18 ans ont été exclus de l’étude. Pour chaque patient nous avons retenu la première hospitalisation pour AVC de l’année comme étant l’hospitalisation index.
Les caractéristiques des séjours et des patients ont été recherchées telles que décrites dans la méthodologie détaillée (1). Quelques informations supplémentaires spécifiques aux AVC ont été relevées. Les patients admis en unité neurovasculaire (UNV), dont les unités de soins intensifs neurovasculaires (USINV), en neurochirurgie, et en réanimation ont été identifiés. Des symptômes caractéristiques des AVC ont été recherchés lors de l’hospitalisation index telles que la présence d’une hémiplégie ou d’une paralysie autre (code CIM-10 G81-G83), de troubles de la conscience (R40 incluant le coma), et de troubles du langage (R47, incluant aphasie, dysphasie, etc.).
Un antécédent de trouble du rythme, en particulier de fibrillation atriale ou flutter (I48), ou de la conduction (I44-associé à un risque accru de fibrillation atriale), a été recherché dans les séjours hospitaliers des cinq années précédant ou pendant l’hospitalisation index par un diagnostic principal, associé ou relié, ou une ALD. De la même façon la présence d’un cancer et d’une démence ont été recherchés.
Suivi
L’ensemble des patients hospitalisés pour un AVC a été suivi jusqu’à un an après la fin de l’épisode de soin et les informations suivantes ont été enregistrées : le statut vital à 30 jours, à six mois et à un an, l’admission dans un service de soins médicaux et de réadaptation (SMR) dans les six mois, et plus spécifiquement dans une unité de SMR neurologique ou locomoteur, consultation avec un neurologue et un cardiologue dans les six mois (en ville ou à l’hôpital), présence d’actes de kinésithérapeutes/orthophonistes/orthoptistes dans les six mois, les ré-hospitalisations en MCO dans les six mois suivant la sortie, et la présence, à un an, d’un traitement antihypertenseur, hypolipémiant, antiplaquettaire, anticoagulant oral, antiarythmique, antidiabétique. Le traitement était considéré si a minima trois délivrances à des dates différentes étaient enregistrées, ou deux si l’une était en grand conditionnement (90 comprimés).
Indicateurs
Pour l’année 2022, le nombre de patients hospitalisés pour AVC et âgés de plus de 18 ans a été comptabilisé comme décrit ci-dessus. Le nombre de cas prévalents d’AVC adultes et vivants au 1er janvier 2023 a été calculé en prenant tous les patients hospitalisés pour AVC en 2022, mais également tous ceux avec un diagnostic hospitalier d’AVC (principal, relié ou associé) entre 2012 et 2022, et en ajoutant les personnes avec une affection longue durée (ALD) pour AVC sur cette période (voir supplément (1)).
Les taux de patients hospitalisés pour 100 000 habitants correspondants et la prévalence en pourcentage ont été calculés en divisant le nombre de cas par la population française recensée en 2022 dans les statistiques de l’Institut national de la statistique, et des études économiques (Insee). Les taux de mortalité ont été calculés pour 100 000 décès à partir des causes médicales de décès récupérées indépendamment des patients hospitalisés et produites par le Centre d’épidémiologie sur les causes de décès (CépiDc, voir supplément (1)). Les taux d’incidence, de prévalence et de mortalité ont été standardisés sur la structure d’âge de la population européenne de 2010 à des fins de comparaison. Les proportions de patients admis en SMR tous types confondus, admis en SMR neuro-locomoteur, bénéficiant d’une visite chez le neurologue, ré-hospitalisés, et la part des patients avec un traitement d’intérêt à un an ont été données en pourcentage parmi les patients vivants à six mois et un an respectivement.
Résultats
Patients hospitalisés
En 2022, on dénombrait 122 422 adultes hospitalisés pour un AVC en France, dont 78% pour un AVC ischémique (n=95 489) (tableau 1). Parmi les 22,4% de patients avec un AVC hémorragique, 59,8% (13,4% du total des AVC) présentaient une HIC, 20,9% (5,2% du total) une HSA, et 19,3% (4,8% du total) une hémorragie autre ou non précisée (données non présentées). Le taux pour 100 000 habitants correspondant était de 255,8 chez les hommes et 205,1 chez les femmes, et augmentait fortement avec l’âge allant de 25,8 pour 100 000 chez les 18-44 ans à 1 363,7 pour 100 000 après 85 ans (tableau 1). Les femmes représentaient 46,8% des cas (n=57 354). L’âge moyen au moment de l’hospitalisation s’élevait à 73,2 ans, et demeurait plus élevé chez les femmes (76,3 ans) que chez les hommes (70,5 ans) (tableau 1). La moitié des patients avaient plus de 75 ans au moment de l’AVC. La proportion de patients âgés de moins de 65 ans s’élevait à 25,4%. La différence de taux entre les hommes et les femmes variait fortement avec l’âge (tableau 1), atteignant un sex-ratio supérieur à 2 parmi les patients de 45-64 ans.
 Agrandir l'image
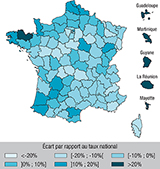
Agrandir l'imageDe fortes disparités départementales des taux de patients hospitalisés standardisés sur l’âge étaient observées, sans gradient géographique clair (figure 1). Les départements et régions d’outre-mer (DROM) présentaient des taux beaucoup plus élevés (jusqu’à 322,1/100 000 à La Réunion et 386,9/100 000 à Mayotte) par rapport au taux national. En métropole, les taux variaient entre 159,9/100 000 en Haute-Corse à 241,7/100 000 dans les Côtes-d’Armor, soit un rapport de 1,5 entre les départements extrêmes de métropole, et allant jusqu’à 2,4 si l’on considère la métropole et les DROM. Les départements du Nord (232,5/100 000), du Pas-de-Calais (232,1/100 000), de Seine-Saint-Denis (220,2/100 000), et plusieurs départements du Sud-Ouest tels que le Lot-et-Garonne (229,2/100 000) et les Landes (217,6/ 100 000) présentaient également des taux standardisés relativement élevés par rapport au taux national (197,4/100 000 après exclusion des cas d’AVC avec une donnée manquante pour le département de résidence).
 Agrandir l'image
Agrandir l'imagePrévalence
La prévalence de l’AVC en 2022 était estimée à 2,0% de la population adulte, soit 1 086 795 cas prévalents, et atteignait 12,0% parmi les personnes âgées de plus de 85 ans (tableau 1).
Mortalité par accident vasculaire cérébral
Au total, 30 682 décès associés à un AVC ont été comptabilisés correspondant à un taux de 50,6/100 000 habitants. L’âge moyen au décès était de 79 ans chez les hommes et 85,5 ans chez les femmes. La majorité des décès survenait à l’hôpital (64,0%), 21,1% survenaient en établissements d’hébergement pour personnes âgées dépendantes (Ehpad) et maison de retraite, et 14,0% à domicile.
Caractéristiques des patients hospitalisés
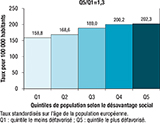
Étaient retrouvées une proportion plus importante de patients appartenant au quintile de population résidant dans les communes les plus défavorisées (22,0% appartenant au Q5, le quintile le plus défavorisé vs 17,3% appartenant au Q1), correspondant à un rapport de taux de patients hospitalisés de 1,3 entre le Q5 et Q1 (figure 2), et une part élevée de patients bénéficiaires de l’allocation adulte handicapé (AAH) (8,4%) (tableau 2). Parmi les personnes de moins de 60 ans, 18,6% étaient des bénéficiaires de la complémentaire santé solidaire (C2S), avec une proportion supérieure chez les femmes (20,0%) par rapport aux hommes (17,7%). L’âge moyen des bénéficiaires de l’AAH était de 50,4 ans (non présenté).
 Agrandir l'image
Agrandir l'image Agrandir l'image
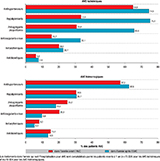
Agrandir l'imageOn dénombrait 8,1% des patients avec un antécédent d’hospitalisation pour AVC dans les 5 ans précédents, avec une proportion plus importante parmi les HIC (9,5%) par rapport aux AVC ischémiques (7,9%) (tableau 2). Au total, 35,3% des AVC avaient un trouble de la conduction ou du rythme cardiaque, et en particulier une fibrillation atriale (26,0%), et 16,8% avaient un cancer actif ou un antécédent de cancer. La part de fibrillation atriale s’élevait à 27,4% parmi les AVC ischémiques contre 21,2% parmi les AVC hémorragiques. De plus, 15,7% des patients avec un AVC ischémique et 20,3% de ceux avec un AVC hémorragique étaient traités par anticoagulants oraux dans l’année précédant l’AVC (figure 3). Enfin, dans l’année précédant l’hospitalisation index pour AVC, 64,9% des patients avec un AVC ischémique et 57,2% de ceux avec un AVC hémorragique étaient traités par antihypertenseurs, et 33,4% et 30,5% par hypolipémiants respectivement.
 Agrandir l'image
Agrandir l'imageLa part de paralysies (hémiplégie ou autre) s’élevait à 52,6% des AVC ischémiques et 37,3% des AVC hémorragiques (tableau 2). De plus, la proportion de patients avec un trouble majeur de la conscience pouvant aller jusqu’au coma atteignait 38,8% des patients.
Caractéristiques du séjour
L’hospitalisation index pour AVC était caractérisée par une durée moyenne de séjour de 12,5 jours, avec une médiane de 8 jours (tableau 2). Une admission en USINV était retrouvée chez 46,8% des patients (53,1% pour les AVC ischémiques et 25,1% pour les AVC hémorragiques). Le taux d’admission en USINV variait selon le département, allant de <30% des AVC ischémiques pour la Guyane, la Haute-Corse, le Cantal, la Nièvre, l’Indre, l’Yonne, les Hautes-Alpes, et la Mayenne à >70% dans le Pas-de-Calais, le Tarn-et-Garonne, l’Aude, et les Landes (annexe). Il variait également selon le sexe et l’âge, avec une proportion moins élevée parmi les femmes et les personnes âgées de plus de 85 ans (données non présentées).
L’admission en réanimation était plus fréquente pour les AVC hémorragiques (24,1%) que pour les AVC ischémiques (3,9%). L’hospitalisation se soldait par un décès dans 10,0% des cas d’AVC ischémiques et 28,9% des cas d’AVC hémorragiques. L’admission directement en SMR après la phase aiguë concernait respectivement 22,7% et 20,8% des patients (figure 4).
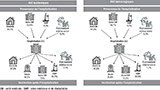 Agrandir l'image
Agrandir l'imageSuivi des patients après l’hospitalisation
À 6 mois, le suivi mettait en évidence un taux d’admission en SMR de 34,3% pour les AVC ischémiques et 41,7% pour les hémorragiques parmi les vivants, et en SMR neurologique ou locomoteur pour 19,4% et 25,6% des patients respectivement (figure 5). Seuls 28,8% des patients hospitalisés pour un AVC ischémique (28,1% parmi ceux non admis en SMR) et 18,8% de ceux pris en charge pour un AVC hémorragiques (18,0% parmi ceux non admis en SMR) avaient eu une consultation chez un neurologue. Plus de 30% des patients ont bénéficié d’un kinésithérapeute dans les 6 mois suivant la sortie (figure 5) et n’étaient plus que 15% à 1 an (non présentée).
La létalité à 30 jours était presque trois fois plus élevée parmi les AVC hémorragiques (28,1%) que parmi les AVC ischémiques (10,4%). Néanmoins, le taux de létalité augmentait plus fortement parmi ces derniers, avec un doublement à 1 an (20,8%). En comparaison, le taux de létalité à 1 an parmi les AVC hémorragiques était de 37,9% (figure 5).
 Agrandir l'image
Agrandir l'imageParmi les patients qui avaient été hospitalisés pour un AVC ischémique et vivants à 1 an, la proportion de ceux traités par antihypertenseurs a augmenté par rapport à avant l’AVC, de même pour les traitements hypolipémiants, antiplaquettaires, et anticoagulants oraux (figure 3). Pour les AVC hémorragiques, les proportions de patients traités par antiplaquettaires, anticoagulants oraux et antiarrythmiques diminuaient sensiblement après l’AVC par rapport à avant.
Discussion
Plus d’un million de personnes adultes vivaient avec un antécédent d’AVC au 1er janvier 2023 en France, et 122 422 patients ont été hospitalisés pour un AVC au cours de l’année 2022. Les DROM étaient particulièrement touchés, ainsi que les personnes résidant dans les communes les plus défavorisées de métropole. Si l’AVC est plutôt une pathologie du sujet âgé, voire très âgé, avec un quart de patients âgés de 85 ans ou plus au moment de l’AVC dans notre étude, la proportion de sujets jeunes n’est pas négligeable avec plus d’un patient sur quatre âgé de moins de 65 ans, en particulier chez les hommes (âge moyen de 70 ans). Le bilan hospitalier est lourd avec seulement 57,3% des AVC ischémiques et 37,4% des AVC hémorragiques qui rentrent à domicile après la phase aiguë. Parmi les survivants six mois après l’hospitalisation, 34% des AVC ischémiques et 42% des AVC hémorragiques ont bénéficié d’une réadaptation dans une unité de SMR. Enfin, la mortalité post-AVC demeure élevée, avec un patient hospitalisé pour AVC ischémique sur cinq et un patient hospitalisé pour AVC hémorragique sur trois qui décèdent à un an.
Les nombres de cas prévalents et incidents d’AVC n’ont jamais été aussi élevés avec 122 422 patients hospitalisés d’après nos résultats contre 110 438 en 2014 13. Comparativement à l’Allemagne par exemple, le taux d’hospitalisation pour AVC était moins élevé en France 21. D’après les données des registres européens populationnels des AVC, la France enregistre une incidence parmi les moins élevées 1. Néanmoins, la proportion importante de patients de plus de 85 ans génère de nombreuses problématiques telles que la prise en charge des comorbidités dont les troubles cognitifs pré-AVC, les complications au cours du séjour plus fréquentes, les difficultés du retour à domicile pour cette population et ses besoins spécifiques en soins de suite et admission long séjour 22. De plus, les plus âgés sont souvent exclus des essais thérapeutiques, ce qui complique l’applicabilité des thérapeutiques efficaces mises en évidence 23. Ces difficultés vont s’amplifier dans les années à venir avec le vieillissement en cours.
La prévalence de l’AVC et des séquelles associées ont été estimées à 1,2% et 0,8% respectivement dans les enquêtes en population « Handicap santé » pour la première fois en 2008 et incluant à la fois des ménages et des patients institutionnalisés 8. À cette époque, les DROM présentaient déjà les prévalences les plus élevées avec le Nord et le Sud-Ouest de la métropole. Le gradient social lié à la commune de résidence était en accord avec la littérature montrant l’impact fort des inégalités sociales dans la survenue de l’AVC 24,25, y compris en France 26,27. Néanmoins dans certains pays, ce lien n’est pas toujours clair puisque le contexte socio-économique et la couverture sociale peuvent être très intriqués avec l’origine ethno-raciale comme aux États-Unis 28. Les inégalités sociales et territoriales des AVC s’expliquent par l’inégale répartition sur le territoire des principaux facteurs de risque d’AVC et sont très associés aux inégalités sociales. En particulier, les prévalences de l’obésité, du diabète, de l’hypertension artérielle, et de la fibrillation atriale sont les plus élevées dans les Hauts-de-France, le Grand Est, et les DROM 29,30. Le taux élevé d’AVC dans les Côtes-d’Armor et dans le Sud-Ouest de la France pourrait aussi s’expliquer en partie par la prévalence plus importante des consommations élevées d’alcool dans ces territoires 31,32.
Nos résultats rappellent que l’AVC touche aussi les moins de 65 ans, avec une tendance à la hausse pour les AVC ischémiques 16,17, ce qui a de fortes répercussions sociétales en lien notamment avec la reprise des activités de la vie courante et le retour au travail : les enquêtes « Handicap santé » avaient mis en évidence que comparativement aux personnes âgées entre 19 et 59 ans sans antécédent d’AVC, les personnes du même âge rapportant un antécédent d’AVC étaient moins susceptibles entre autres de travailler (35,5% vs 72,2%), de conduire (54,3% vs 81,3%), ou d’avoir une activité sportive (26,6% vs 55,8%) 33.
La filière AVC réorganisée et développée lors du plan national AVC 2010-2014 s’est appuyée sur la constitution des UNV, dont les compétences permettent une amélioration de la prise en charge à la phase aiguë des AVC et une meilleure fluidité du parcours en aval 34. Si le nombre d’UNV actives a atteint 138 sur le territoire en 2019 et que le plan a démontré une amélioration de la prise en charge des AVC ischémiques 34,35, environ 40% des AVC ischémiques et 75% des AVC hémorragiques ne bénéficient toujours pas d’une prise en charge dans ces unités d’après nos résultats, en dépit des préconisations européennes indiquant qu’au moins 90% des patients devraient y avoir accès d’ici à 2030 36. Cela montre la nécessité de poursuivre le développement de ces unités et d’assurer leur pérennité. Parmi les patients ne relevant pas d’une réanimation ou de soins critiques de neurochirurgie, seulement 43% des AVC hémorragiques sont admis en UNV. Par ailleurs, l’admission dans ces unités était inégale selon le sexe et l’âge d’après nos résultats, alors qu’elles peuvent bénéficier à tous les patients faisant un AVC 37. De la même façon, la très grande majorité des AVC ne bénéficie pas d’une réadaptation spécialisée en unité de SMR, soulignant l’importance d’augmenter les places dans ces structures, d’améliorer le maillage territorial, et de réduire les inégalités d’accès qui persistent sur le territoire 38. Les SMR, et en particulier la réadaptation neurologique et locomotrice, constituent en effet une étape cruciale du parcours de soins des AVC permettant de réduire la mortalité, les séquelles fonctionnelles, de promouvoir l’éducation thérapeutique et une amélioration de la qualité de vie par la reprise des activités de la vie courante 38,39,40. Les consultations pluri-professionnelles post-AVC mises en place lors du plan sont aussi un maillon important pour la prévention secondaire et le lien ville-hôpital. Les améliorations de certains indicateurs de prise en charge montrent en partie l’impact favorable du plan AVC 2010-2014. Néanmoins, l’évaluation d’impact de ce plan demeure difficile 41.
Notre étude met en évidence une proportion encore trop élevée de patients non admis en UNV/SMR, pouvant être à l’origine d’un excès de mortalité et de handicap 38,42,43. Bien que la sévérité des AVC soit liée intrinsèquement à la physiopathologie sous-jacente, le délai de prise en charge est un facteur explicatif important de la létalité et des séquelles. L’amélioration du temps entre l’apparition des symptômes et l’accès à l’imagerie permettrait notamment d’augmenter le nombre de patients avec un AVC ischémique éligibles aux traitements de revascularisations endovasculaires. Moins de 8% des patients avec un AVC ischémique bénéficient aujourd’hui d’une thrombectomie mécanique d’après notre étude, et l’accès à la thrombolyse ne concernait que 10% des patients avec un AVC ischémique en 2021 d’après le dernier rapport de la Haute Autorité de santé 44. Dans ce cadre, une diffusion des messages publics sur la reconnaissance des symptômes de l’AVC et de l’urgence de contacter le 15 en cas de symptômes devrait être instaurée de manière plus régulière. Une précédente étude avait mis en évidence que la méconnaissance des symptômes d’AVC était plus élevée chez les hommes, les moins de 45 ans et les personnes de 65-74 ans, les personnes avec un niveau d’étude inférieur au Baccalauréat, ainsi que les fumeurs, ces populations devant faire l’objet de campagnes peut-être plus ciblées 45.
La prévention de l’AVC passe de façon générale par la prévention primaire des facteurs de risque d’AVC au niveau individuel et au niveau des déterminants structuraux 46, mais également par la prévention secondaire de pathologies à risque d’AVC telle que la fibrillation atriale (FA) via notamment la prise d’un traitement anticoagulant oral 47. La prévalence de la FA, estimée à 27,4% des AVC ischémiques dans notre étude, augmente dans la population du fait du vieillissement, et représente aujourd’hui un AVC ischémique sur trois d’après le Registre dijonnais des AVC et le Registre des AVC du Pays de Brest 9,48,49. Aussi, il est nécessaire d’améliorer le dépistage des cardiopathies emboligènes en population générale, puisque au moment de l’AVC cardio-embolique, environ un tiers des fibrillations atriales n’avaient pas été dépistées avant 48, mais surtout d’améliorer sa détection en post-AVC. Par ailleurs, nous observons dans notre étude que 15% des AVC ischémiques étaient traités par anticoagulant oral dans l’année précédant l’AVC. Si l’AVC n’est peut-être pas d’origine cardio-embolique pour tous ces cas, la survenue de l’AVC malgré le traitement pose problème et souligne le besoin d’améliorer l’observance via l’éducation thérapeutique du patient. La présence d’un cancer dont la prévalence était relativement importante au sein des AVC dans notre étude (17%) pourrait aussi expliquer en partie l’échec du traitement anticoagulant. Aussi, la prévention de l’AVC chez les patients atteints de cancer via une stratégie d’anticoagulation efficace devrait être optimisée 50,51. Enfin, on dénombrait 21,2% de fibrillation atriale parmi les AVC hémorragiques hospitalisés. Cette concomitance du risque hémorragique et du risque ischémique est un challenge thérapeutique qui souligne l’importance du déploiement d’essais cliniques dans ce champ.
Au-delà du traitement anticoagulant en prévention d’une récidive d’AVC cardio-embolique, les recommandations de prise en charge médicamenteuse du post-AVC dépendent bien sûr du type d’AVC survenu 52. Notre étude mettait en évidence que les trois quarts des survivants d’un AVC ischémique étaient traités par un antihypertenseur, la même proportion par un hypolipémiant un an après l’AVC, et plus de 60% par antiagrégants plaquettaires. Néanmoins, une étude avait mis en évidence l’observance non-optimale à long-terme, en particulier pour les hypolipémiants 53. Au-delà de l’observance aux traitements recommandés, plusieurs études ont mis en évidence le non-contrôle de la pression artérielle, de la glycémie ou du LDL-c malgré la prise d’un traitement après l’AVC 54.
Forces et limites
Le SNDS permet d’identifier les personnes hospitalisées pour un AVC avec une bonne valeur prédictive positive 55. Néanmoins, le type d’AVC ischémique, l’étiologie, la sévérité de l’AVC et les scores cliniques associés tels que le National Institute of Health Stroke Scale (NIHSS) ou le score de Glasgow ne sont en revanche pas précisés dans le SNDS. Ce point est pourtant important pour apprécier finement l’épidémiologie des AVC. L’évolution de la distribution de l’étiologie des AVC ischémiques a un impact sur la prise en charge associée et les séquelles. Par ailleurs, nous avons fait le choix de regrouper les AVC codés comme « indéterminés » (<5% des AVC identifiés dans notre étude) avec les AVC ischémiques dans la mesure où dans beaucoup de cas ils font référence à des AVC ischémiques d’origine indéterminée. Cependant, cela n’est pas forcément vrai chez les personnes âgées où des différences de codage peuvent persister.
D’autres limites sont inhérentes à l’utilisation d’une base de données médico-administratives, telle que l’identification du tabagisme ou de l’obésité qui est très dépendante du codage et sont sous-estimés dans la mesure où leur codage ne permet pas toujours une valorisation supérieure du séjour hospitalier. Les antécédents d’AVC sont estimés ici dans la mesure où nous n’avons pas un recul vie-entière. Concernant l’hypertension artérielle (HTA), si la délivrance d’antihypertenseur peut être retrouvée dans le SNDS, l’indication du traitement n’est pas disponible, aussi il apparaît difficile d’estimer la part réelle d’HTA parmi les patients hospitalisés pour un AVC. De la même façon, la proportion de démence est sous-estimée dans le SNDS comme discuté dans un travail réalisé sur le SNDS 56. De plus, sur certains éléments de prise en charge, le SNDS ne dispose plus d’une identification possible de la thrombolyse ou encore des temps d’admission à l’hôpital par rapport à l’apparition des symptômes qui permettraient d’estimer la proportion de patients éligibles aux traitements de revascularisation endovasculaire.
Cette étude ne traite pas des AVC de l’enfant et de l’adolescent qui représentent environ 500 cas par an 57. Il existe un réseau de prise en charge spécifique à cette population qui avait bénéficié d’une adaptation du plan AVC 2010-2014. De la même façon que la population adulte, une amélioration de la prise en charge et du suivi des enfants atteints demeure nécessaire 58.
Conclusion
Ce travail souligne l’impact très important de l’AVC au sein de la population française dans des proportions très inégales selon les territoires et le contexte socio-économique. Une très faible partie des patients bénéficie d’un traitement de revascularisation endovasculaire pour les AVC ischémiques ou de thérapeutiques efficaces pour les AVC hémorragiques aujourd’hui, expliquant une mortalité plafond un an après l’AVC malgré l’amélioration des stratégies thérapeutiques des 20 dernières années. Malheureusement, aucun traitement n’a été démontré efficace sur notre période d’étude pour diminuer la mortalité des AVC hémorragiques. Aussi les résultats appellent à une prévention plus efficace de l’AVC en population, à la régularité des campagnes d’information sur les signes et symptômes de l’AVC et de la conduite à tenir le cas échéant. Enfin, il reste une marge de progression importante avec la nécessité de renforcer l’offre de soins en lits neurovasculaires en fonction des besoins de la population, et d’améliorer l’accessibilité des patients aux soins neurovasculaires tant en phase aiguë que chronique. Ces évolutions ne pourront se faire sans la disposition de professionnels formés.
Tous ces indicateurs peuvent être retrouvés sur le site : https://odisse.santepubliquefrance.fr, consultable à partir du 17 mars 2025.
Liens d’intérêt
Amélie Gabet, Clémence Grave, Grégory Lailler, Valérie Olié, Emmanuel Touzé, France Woimant, Laurent Suissa et Philippe Tuppin
déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.
Yannick Béjot déclare des honoraires versés par les laboratoires BMS, Pfizer, Boehringer Ingelheim, Medtronic, Amgen, Servier,
NovoNordisk, et Novartis, en dehors du présent travail.
Références
Citer cet article
 Agrandir l'image
Agrandir l'image



