Épidémiologie des maladies aortiques et artérielles périphériques en France en 2022
// Epidemiology of aortic and peripheral arterial diseases in France
Résumé
Introduction –
L’ensemble des maladies artérielles périphériques représente une part importante de la morbidité et des hospitalisations chez les patients porteurs de maladies cardiovasculaires. Peu de données épidémiologiques sont disponibles en France sur ces pathologies à l’échelle nationale et infranationale. L’objectif était de décrire l’épidémiologie de l’ensemble des pathologies de l’aorte et artérielles périphériques (hors artères intracrâniennes) en France en 2022, à travers les nombres et taux de patients hospitalisés et leur prise en charge, la prévalence et la mortalité associées à ces pathologies.
Méthodes –
Cette étude a été réalisée à partir du Système national des données de santé (SNDS). Les patients adultes hospitalisés au moins une fois pour ces pathologies artérielles en 2022 et ceux décédés à la suite de ces pathologies en 2021 ont été sélectionnés sur la base des codes de la Classification internationale des maladies – 10e révision (CIM-10). La prévalence des pathologies artérielles périphériques parmi les personnes vivantes au 1er janvier 2023 a été estimée en combinant les antécédents d’hospitalisations avec ces diagnostics depuis 10 ans ainsi que leur prise en charge à 100% du ticket modérateur dans le cadre d’une affection longue durée (ALD). Les taux de prévalence et d’hospitalisation correspondants ont été calculés en divisant les nombres de cas par les données de recensement de la population adulte française produites dans les statistiques de l’Institut national de la statistique et des études économiques (Insee) de la même année.
Résultats –
En 2022, 68 702 adultes ont été hospitalisés en France pour une maladie artérielle des membres inférieurs, 15 319 pour une dissection ou un anévrisme de l’aorte, et 9 027 pour une dissection ou un anévrisme d’une artère de moyen calibre, correspondant à des taux pour 100 000 habitants respectivement de 112,6, 28,7, et 16,9. La prévalence de ces pathologies dans la population adulte s’élevait respectivement à 1,2% (n=760 047), 0,4% (n=200 000), et 0,2% (n=131 000). D’importantes disparités territoriales des taux de patients hospitalisés standardisés sur l’âge ont été observées en France métropolitaine et dans les départements et régions d’outre-mer (DROM), avec des taux plus élevés à La Réunion, ainsi que selon l’indice de désavantage social de la commune de résidence. Le taux de décès à un an variait de 11% pour les patients hospitalisés pour un anévrisme de l’aorte thoracique (AAT) ou une dissection/anévrisme d’une artère de moyen calibre, à 27% pour ceux admis à l’hôpital pour une dissection aortique. La proportion de patients hospitalisés pour une artériopathie oblitérante des membres inférieurs (AOMI) traités respectivement par antiagrégants plaquettaires ou hypolipémiants était respectivement de 86% et 75% un an après l’hospitalisation index, et était similaire à celles observées parmi les patients hospitalisés pour un anévrisme de l’aorte abdominale (AAA) (83% et 73%).
Conclusion –
Le fardeau des maladies aortiques et artérielles périphériques est considérable en France et la mortalité reste élevée pour les ruptures d’anévrismes de l’aorte et les dissections aortiques.
Abstract
Introduction –
Peripheral arterial diseases (PADs) account for much of the morbidity and hospitalizations experienced by patients with cardiovascular disease. Epidemiological data on these diseases are lacking in France. The objective of this article is to describe the epidemiology of aortic diseases (aneurysm and dissection) and PADs in France in 2022.
Methods –
This study was carried out using the French National Health Data System. Patients hospitalized with these diseases in 2022 and patients who died from these diseases in 2021 were selected. The prevalence of aortic diseases and PADs among people alive on 1 January 2023 was estimated from previous hospitalizations and registered long-term disease. Mortality and secondary treatment were examined in the year following hospitalization.
Results –
In 2022, there were 68,702 patients hospitalized in France for a lower extremity artery disease (LEAD), 9,083 for abdominal aortic aneurysm and 9,027 for dissection or aneurysm of a medium-sized artery (standardized rates: 112.6, 15.0 and 15.5 per 100,000, respectively). The standardized prevalences of these diseases were 1.23%, 0.17% and 0.22% of adults, respectively. Regional and social disparities in the age-standardized rates of hospitalized patients were observed. One-year mortality ranged from approximately 11% for patients hospitalized for thoracic aortic aneurysm or medium-sized artery dissection/aneurysm to 27.0% for aortic dissection. The proportions of patients hospitalized due to LEAD who were being treated with antiplatelet or lipid-lowering drugs 1 year after the index hospitalization were 86.6% and 75.9%, respectively.
Conclusion –
The burden of aortic diseases and PADs is considerable in France and mortality remains high for ruptured aortic aneurysm and aortic dissection.

Introduction
Les maladies artérielles périphériques sont principalement définies par l’artériopathie oblitérante des membres inférieurs (AOMI), l’occlusion d’autres artères périphériques, et les anévrismes et dissection des artères de moyen calibre. Les maladies aortiques regroupent, quant à elles, les anévrismes et dissections aortiques. Aussi bien les maladies aortiques qu’artérielles périphériques représentent une part importante de la morbidité et des hospitalisations parmi les patients atteints de maladies cardiovasculaires 1. Contrairement aux patients avec une maladie cardiaque, la mortalité ne diminue pas pour ces pathologies 2,3.
En termes physiopathologiques, l’immense majorité des maladies artérielles périphériques ainsi que les maladies aortiques sont principalement secondaires à des processus athéro-thrombotiques affectant l’intégralité du lit vasculaire, avec des processus similaires à l’atteinte des artères coronaires. La prise en charge de ces maladies d’origine athéro-thrombotique comprend une prise en charge spécifique en fonction des symptômes, des artères atteintes, de l’importance des altérations et des remodelages artériels. Des stratégies thérapeutiques communes existent avec notamment une prise en charge des facteurs de risque cardiovasculaires modifiables (diabète, dyslipidémie, tabac, hypertension artérielle – HTA), une prescription d’antiagrégants plaquettaires, des hypocholestérolémiants et des inhibiteurs du système rénine-angiotensine (IEC/ARAII), mais aussi une prise en charge non médicamenteuse associant habituellement l’activité physique et une bonne alimentation 4,5. Une sous-prescription des traitements tels que les statines et antiplaquettaires recommandés est habituellement rapportée chez ces patients, en comparaison avec les patients présentant d’autres atteintes cardiovasculaires, notamment avec atteinte coronaire 6,7,8. À côté de ces pathologies athéro-thrombotiques, il existe des pathologies non athéro-thrombotiques touchant le système artériel. La plus fréquente est la dysplasie fibromusculaire, responsable d’irrégularités de calibre, sténoses, anévrismes et/ou dissections d’artères périphériques 9. Il existe également des pathologies inflammatoires, pouvant affecter l’aorte et les artères de moyen calibre (maladie de Takayasu, artérite à cellules géantes principalement), et, plus rarement, des maladies d’origine génétique, modifiant la structure de la paroi artérielle et notamment le collagène et les fibres élastiques (syndrome de Marfan et apparentées, maladie d’Ehlers-Danlos vasculaire). Leur proportion est très faible pour l’AOMI, plus importante pour les anévrismes et dissections des artères de moyen calibre, et encore plus importante pour les anévrismes et dissections de l’aorte, surtout thoracique 5.
Enfin, les patients porteurs d’une pathologie aortique ou d’une pathologie artérielle périphérique sont fréquemment atteints de pathologies polyartérielles avec un risque coronarien et cérébro-vasculaire accru. Ils ont finalement plus de probabilité de mourir des complications de leur atteinte coronaire et/ou de leur atteinte cérébro-vasculaire que d’une évolution ou d’une complication de leur maladie artérielle périphérique (ischémie aiguë de membre, gangrène ou amputation, rupture d’anévrisme aortique) 6,7,8,10,11. L’AOMI s’ajoute comme une comorbidité majeure très handicapante, avec un fort retentissement sur la qualité de vie, engendrant une perte d’autonomie, des douleurs chroniques, réduisant ainsi l’espérance de vie des personnes atteintes.
L’objectif de cet article est de décrire l’épidémiologie des maladies aortiques (anévrismes et dissections) et artérielles périphériques en France en 2022 à travers les nombres et taux de patients hospitalisés, de personnes bénéficiaires d’un remboursement de leurs frais médicaux à 100% au titre d’une affection longue durée (ALD) pour l’une de ces pathologies, leur prise en charge, la prévalence, ainsi que la mortalité associées à ces pathologies.
Méthodes
Cette étude a été réalisée à partir du Système national des données de santé (SNDS), qui regroupe les données des séjours hospitaliers, aussi bien dans les hôpitaux publics que privés, et les données médicales et administratives en dehors de l’hôpital 12. La méthodologie détaillée (description de la base de données et des indicateurs épidémiologiques) est disponible dans le supplément de ce numéro (1). Les données sur les hospitalisations portent sur l’année 2022 ; celles sur les décès sur 2021 et les estimations de prévalence ont utilisé les données hospitalières et d’affection longue durée (ALD) de 2012-2022. La population de l’étude est l’ensemble de la population française âgée de plus de 18 ans.
Nous avons choisi pour cette étude de cibler les hospitalisations pour une AOMI, et les anévrismes et dissections de l’aorte et d’une artère de moyen calibre. Ainsi, notre étude n’inclut pas les occlusions de l’aorte ou des artères de moyen calibre. Ce choix était motivé tout d’abord par la nécessité d’avoir des groupes relativement homogènes de patients en terme d’épidémiologie et de prise en charge. Ensuite, dans la mesure où nous identifions des hospitalisations, nous avons exclu les occlusions de territoires autre que le membre inférieur qui sont souvent codés lors d’une hospitalisation pour une autre pathologie. Enfin, les codes hospitaliers que nous utilisons ne sont pas assez précis pour identifier le territoire de l’occlusion pour les artères de moyen calibre. Néanmoins, afin de donner une image complète pour les maladies aortiques et artérielles périphériques, le nombre de patients hospitalisés pour une occlusion autre que des artères du membre inférieur ont été ajoutés en annexe de cette article (annexe 1).
Identification des maladies aortiques et artérielles périphériques
À partir de la base de données des hospitalisations en Médecine, chirurgie, obstétrique et odontologie (PMSI-MCO), les patients avec au moins une hospitalisation mentionnant une maladie artérielle périphérique ou aortique en diagnostic principal ou relié de l’ensemble du séjour ou d’une unité médicale alors fréquentée en 2022 ont été recherchés à partir des codes de la Classification internationale des maladies – 10e révision (CIM-10) en distinguant les trois entités suivantes :
–AOMI (code CIM-10 : I70.2, I73.9, I74.3) ;
–anévrismes et dissection de l’aorte avec plusieurs sous-groupes identifiés tels que les dissections aortiques toutes localisations confondues (I71.0), les anévrismes rompus ou non rompus de l’aorte thoracique (AAT) (I71.1, I71.2), et de l’aorte abdominale (AAA) (I71.3, I71.4, I71.5, I71.6) ;
–anévrismes et dissections des artères de moyen calibre (I72, I77.2).
Pour chaque patient hospitalisé en 2022 et chaque sous-groupe, la première hospitalisation de l’année a été retenue comme hospitalisation index. Si plusieurs hospitalisations espacées de moins de sept jours sont retrouvées pour un même patient, nous considérons l’ensemble des hospitalisations comme un même épisode de soins, celui-ci formant l’hospitalisation index.
Plusieurs comorbidités cardiovasculaires et non cardiovasculaires ont été recherchées jusqu’à cinq ans avant l’hospitalisation index à partir de l’historique des hospitalisations et des personnes ayant bénéficié d’une prise en charge à 100% au titre d’une ALD : insuffisance cardiaque, cardiopathies ischémiques dont les syndromes coronariens aigus, valvulopathies, maladie rénale chronique, accident vasculaire cérébral, ainsi que toutes les autres pathologies incluses dans le score de comorbidités de Charlson 13. La présence d’un syndrome de Marfan ou maladie d’Ehlers–Danlos vasculaire a également été recherchée pour la caractérisation des patients hospitalisés pour une dissection ou un anévrisme aortique. Pour les patients hospitalisés pour un anévrisme ou une dissection d’une artère périphérique de moyen calibre, le diagnostic de dysplasie fibromusculaire a été recherché.
Pour l’identification des certificats de décès mentionnant une maladie aortique ou artérielle périphérique, les mêmes codes CIM-10 que ceux définis précédemment ont été utilisés. Un groupe additionnel a été constitué rassemblant les décès pour l’ensemble des dissections et anévrismes aortiques en utilisant le code I71 (données non présentées).
Les antécédents d’obésité et de tabagisme ont également été recherchés (selon la procédure d’identification dans le SNDS, voir supplément (1)), dans les cinq ans précédant ou dans les six mois suivant l’hospitalisation index pour l’une des pathologies artérielles périphériques. L’HTA a été identifiée à partir des diagnostics hospitaliers ou des délivrances de traitements antihypertenseurs, et les patients diabétiques ont été repérés par les diagnostics hospitaliers, les ALD, et les traitements antidiabétiques. Les caractéristiques sociodémographiques suivantes ont été relevées : âge, sexe, l’index de désavantage social de la commune de résidence du patient (Fdep), et chez les patients âgés de moins de 60 ans l’attribution d’une allocation adulte handicapé (AAH) et de la complémentaire sociale et solidaire (C2S). Les détails sont à retrouver dans la méthodologie générale (1).
Pour chaque patient, les actes de la Classification commune des actes médicaux (CCAM) spécifiques ont été identifiés dans les cinq ans précédant l’hospitalisation index ou pendant celle-ci, et regroupés dans les entités suivantes : traitement endovasculaire, traitement chirurgical pour tous les patients étudiés, et amputation majeure (au-dessus de la cheville) ou mineure pour les patients hospitalisés pour une AOMI. Pour chacun de ces actes, nous avons différencié s’il avait été réalisé avant l’hospitalisation index ou lors de l’hospitalisation index.
Suivi
L’ensemble des patients hospitalisés pour l’une des pathologies artérielles périphériques ou aortiques précédemment définie a été suivi jusqu’à un an après la fin de l’épisode de soins. Les informations disponibles relatives à la mortalité hospitalière, au statut vital à 30 jours après le début de l’hospitalisation, ainsi qu’à six mois et un an, ont été recherchées. Les remboursements d’antiagrégants plaquettaires, d’anticoagulants oraux (anticoagulants oraux directs (AOD), antivitamine-K (AVK)), d’hypolipémiants, d’antidiabétiques et d’antihypertenseurs ont été comptabilisés jusqu’à un an après l’hospitalisation index. Ces traitements étaient considérés s’il y avait eu, a minima, deux délivrances dans l’année à des dates différentes, ou à une seule date en cas de grand conditionnement (90 comprimés).
Analyses
Pour l’année 2022, le nombre de patients âgés de plus de 18 ans hospitalisés au moins une fois pour chacune des pathologies artérielles périphériques d’intérêt a été comptabilisé. Les nombres de cas adultes prévalents hospitalisés ou sous ALD et vivants au 1er janvier 2023 ont été estimés en considérant tous les patients hospitalisés avec un diagnostic hospitalier pour ces pathologies (que ce soit en diagnostic principal, relié ou associé) entre 2012 et 2022 et vivants au 1er janvier 2023, ainsi que toutes les personnes ayant bénéficié d’une prise en charge à 100% au titre d’une ALD pour une pathologie artérielle périphérique sur cette période (voir supplément (1)).
Les taux de patients hospitalisés pour 100 000 habitants âgés de plus de 18 ans correspondants et la prévalence en pourcentage ont été calculés en divisant le nombre de cas repérés dans la population française recensée en 2022 dans les statistiques de l’Institut national de la statistique et des études économiques (Insee). Les taux ont été standardisés sur la structure d’âge de la population européenne de 2010 à des fins de comparaison.
Résultats
Patients hospitalisés
En 2022, 68 702 patients ont été hospitalisés en France pour une AOMI, ce qui correspond à un taux d’incidence annuelle de patients hospitalisés de 128,7 pour 100 000 habitants âgés de plus de 18 ans (tableau 1). L’incidence annuelle augmentait avec l’âge et elle était presque près de deux fois et demi plus élevée chez les hommes (186,1/100 000) que chez les femmes (76,4/100 000).
Le nombre de patients hospitalisés pour une dissection ou un anévrisme de l’aorte était de 15 319 patients, soit un taux d’incidence annuelle de 28,7 pour 100 000 personnes. Parmi eux, 59,3% présentaient un AAA (n=9 083, âge moyen=73,2 ans), 23,6% un AAT (n=3 614, âge moyen=66,0 ans) et 17,8% une dissection aortique (n=2 726, âge moyen=67,1 ans). Ces pathologies étaient plus fréquentes chez les hommes que chez les femmes avec des taux d’incidence d’hospitalisation jusqu’à 7 fois plus élevés pour les AAA (4,1/100 000 chez les femmes et 31,3/100 000 chez les hommes).
 Agrandir l'image
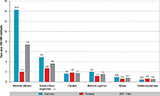
Agrandir l'imageLe nombre de patients hospitalisés pour une dissection ou un anévrisme des artères de moyen calibre était de 9 027 patients, soit un taux d’incidence de 16,9 pour 100 000 personnes-années. Ces pathologies touchaient dans la moitié des cas les membres inférieurs (49,2%), dans 10,3% des cas une carotide, dans 9,8% des cas les artères des membres supérieurs, 4,5% des cas les artères rénales et dans 3,3% des cas les artères vertébrales ou basilaires. L’incidence pour 100 000 personnes années de ces différentes localisations est donnée en annexe 1. La répartition des atteintes des artères de moyen calibre était différente selon le sexe, avec chez les hommes une majorité (59,5%) des atteintes qui survenait sur les artères des membres inférieurs, alors que chez les femmes, la répartition était plus diffuse, avec l’atteinte des artères des membres inférieurs dans 24% des cas, des artères carotides dans 19% des cas et des artères des membres supérieurs dans 14% des cas (figure 1).
 Agrandir l'image
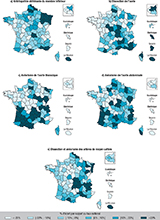
Agrandir l'imageDes disparités territoriales étaient observées pour les différentes pathologies (figure 2). Les taux standardisés d’incidence de patients hospitalisés pour une AOMI étaient les plus élevés dans le Nord et l’Est de la France métropolitaine, atteignant plus de 200 personnes pour 100 000 habitants dans la Meuse, mais également à La Réunion.
 Agrandir l'image
Agrandir l'imageLes taux standardisés d’incidence de patients hospitalisés pour dissection ou anévrisme de l’aorte étaient les plus élevés dans la moitié sud de la France métropolitaine, et particulièrement dans le Sud-Ouest pour les AAT et AAA ; et le Sud-Est pour les dissections aortiques. Les dissections aortiques étaient également fréquentes dans les départements et régions d’outre-mer (DROM), avec des taux standardisés d’incidence d’hospitalisation plus élevés que la moyenne (14,5/100 000 habitants en Guyane, 8,2/100 000 habitants en Martinique et 6,4/100 000 habitants à La Réunion ou Mayotte).
Les taux standardisés d’incidence d’hospitalisation pour dissections et anévrismes des artères de moyen calibre étaient les plus élevés dans la moitié est (nord et sud) de la France métropolitaine, ainsi qu’à La Réunion.
Des disparités d’incidence de patients hospitalisés étaient également observées selon le désavantage social de la commune de résidence, avec des taux d’incidence d’hospitalisation plus élevés dans les quintiles de population résidant dans les communes les plus défavorisées par rapport à ceux des quintiles des communes les plus favorisées. L’écart d’incidence le plus important était observé pour l’AOMI, où on retrouvait 80,1 cas pour 100 000 habitants dans le quintile le plus favorisé contre 127,9 cas pour 100 000 habitants dans le quintile le plus défavorisé (figure 3).
 Agrandir l'image
Agrandir l'imageCaractéristiques des patients hospitalisés
Parmi les personnes de moins de 60 ans hospitalisées, la part de celles bénéficiant de la complémentaire santé solidaire (C2S) était de 24,8% pour les AOMI, 12,8% pour les dissections et anévrismes aortiques et 16,5% pour les dissections et anévrismes des artères de moyen calibre.
Les patients hospitalisés pour une AOMI étaient âgés en moyenne de 72 ans et avaient un score de Charlson moyen de 2,1, score le plus élevé parmi les différentes pathologies artérielles périphériques (tableau 2). Ils présentaient une exposition importante aux facteurs de risque cardiovasculaire et de nombreuses comorbidités : 12,1% d’entre eux étaient obèses, 35,3% fumaient, 85,3% étaient hypertendus, 41,9% étaient diabétiques, 63,6% avaient une hypercholestérolémie, 19,3% avaient une maladie chronique rénale, et 40,1% avaient un antécédent de cardiopathie ischémique. Ces patients avec un antécédent de cardiopathie ischémique présentaient un profil de comorbidités similaire à celui des patients sans antécédent de cardiopathie ischémique (données non présentées). De même, les patients hospitalisés pour AAA avaient un âge moyen de 73 ans, étaient fumeurs dans 30,8% des cas, hypertendus ou ayant un traitement antihypertenseur dans 82,5% des cas, et 39,8% d’entre eux présentaient un antécédent de cardiopathie ischémique ; mais il y avait moins de personnes obèses (8,0%) et diabétiques (20,4%) et le score de Charlson moyen était plus bas (1,6) que pour l’AOMI. Les patients hospitalisés pour anévrisme ou dissection des artères périphériques étaient plus jeunes (68 ans en moyenne), et étaient fumeurs dans 25,7% des cas, obèses dans 10,8% des cas, hypertendus dans 70,8% des cas, diabétiques dans 20,1% des cas et avaient un antécédent de cardiopathie ischémique dans 26,4% des cas. Concernant les AAT, les comorbidités et facteurs de risque cardiovasculaire étaient moins fréquents que pour les AAA. Enfin, les patients atteints d’anévrisme des artères de moyen calibre avaient également une proportion élevée d’antécédents de cancer (21,1%) et de maladie rénale chronique (17,7%).
 Agrandir l'image
Agrandir l'imageCaractéristiques du séjour
La durée moyenne des épisodes de soins était de 7,1 jours pour une AOMI, 7,2 jours pour les dissections et anévrismes des artères périphériques, 7,4 jours pour les AAA, 10,6 jours pour les AAT, et 13,7 jours pour les dissections aortiques (19,9 jours pour celles qui ont été opérées et 8,3 jours pour les autres). Plus d’un patient sur 2 hospitalisés pour un AAT ou une dissection aortique étaient admis en réanimation (respectivement 58,9% et 55,4%) alors qu’ils étaient moins d’1 sur 4 pour les AAA.
Les ruptures d’anévrisme étaient plus fréquentes lors d’une hospitalisation pour AAA que pour AAT (10,9% vs 8,2%), et plus fréquentes chez les femmes que les hommes pour ces deux localisations d’anévrisme, atteignant 16,1% des patientes hospitalisées pour AAA (vs 10,2% pour les hommes) (tableau 2).
Parmi les patients hospitalisés pour AOMI, 11,5% ont eu une amputation au cours de leur hospitalisation : 7,8% une amputation mineure et 3,7% une amputation majeure. Les hommes avaient plus fréquemment une amputation mineure ou majeure que les femmes (8,8% et 3,8% vs 5,7% et 3,2%). Plus de 8% des patients avaient un antécédent d’amputation au moment de l’hospitalisation (annexe 2). Par ailleurs, 63,3% des patients avaient bénéficié d’une revascularisation endovasculaire durant leur séjour, dans des proportions similaires chez les hommes et chez les femmes.
Lors du séjour index, une chirurgie de l’aorte a été réalisée chez 39,9% des patients hospitalisés pour une dissection aortique, 55,4% de ceux hospitalisés pour un AAT, et 31,8% de ceux hospitalisés pour un AAA. Une procédure endovasculaire a été retrouvée chez 53,3% de ces derniers lors du séjour index.
La majorité des patients étaient admis depuis leur domicile et repartaient vers celui-ci après l’hospitalisation (figure 4). Les taux de décès hospitalier étaient de 2,7% pour les dissections et anévrismes des artères de moyen calibre, 3,0% pour l’AOMI et atteignait 22,0% pour les dissections aortiques. La mortalité hospitalière était de 32,1% pour les AAT rompus contre 3,1% lorsque l’AAT n’était pas rompu. De la même manière la mortalité hospitalière atteignait 41,8% des patients hospitalisés pour un AAA rompu contre 2,3% lorsque l’anévrisme n’était pas rompu (figure 5).
 Agrandir l'image
Agrandir l'image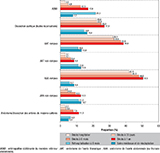 Agrandir l'image
Agrandir l'imageSuivi des patients après l’hospitalisation
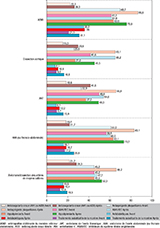
Après l’hospitalisation, la proportion de patients recevant un traitement antiagrégant plaquettaire (AAP), hypolipémiant quel qu’il soit, antihypertenseur ou un anticoagulant, augmentait par rapport aux traitements reçus avant l’hospitalisation, pour toutes les pathologies étudiées (figure 6), avec surtout une augmentation de la prise d’antiagrégants plaquettaires toutes pathologies confondues et une forte augmentation de la prescription des hypolipidémiants dans l’AOMI. Si 69,7% et 63,6% des patients hospitalisés pour une AOMI recevaient respectivement un antiagrégant plaquettaire ou un hypolipémiant avant l’hospitalisation, ils étaient 86,6% et 75,9% après. Près de 31,1% des patients hospitalisés pour une AOMI avaient des délivrances de substituts nicotiniques dans l’année suivant la sortie de l’hospitalisation.
 Agrandir l'image
Agrandir l'imageLa mortalité à 1 an des patients hospitalisés pour une dissection aortique était de 27,0%. La grande majorité de ces décès survenaient très précocement durant l’hospitalisation index (figure 5). La mortalité des patients hospitalisés pour AOMI atteignait 17,0% à 1 an. Parmi les patients hospitalisés pour un AAA ou un AAT rompu, la mortalité à 1 an s’élevait à 50,5%, et 38,6% respectivement.
Le taux de réhospitalisation à 6 mois le plus élevé était observé pour l’AOMI (21,5%). Les taux de réhospitalisation étaient similaires pour les AAT rompus (10,8%), non rompus (11,0%), et les AAA non rompus (11,2%). Seuls 5,7% des AAA rompus et 6,3% des dissections des artères de moyen calibre étaient réhospitalisés à 6 mois (figure 5).
Des observations similaires étaient faites pour les taux d’admission en soins médicaux et de réadaptation (SMR) dans les 6 mois suivant l’hospitalisation pour AAA, AAT avec des taux proches entre les AAT rompus (13,0%), non rompus (12,6%), et les AAA non rompus (12,7%). Celui-ci n’était que de 8,4% après un AAA rompus (figure 5).
Prévalence
Au 1er janvier 2023, 760 047 adultes avaient une AOMI (hospitalisation ou ALD), soit 1,42% de la population adulte française (2,02% chez les hommes et 0,88% chez les femmes). L’âge moyen était de 75,3 ans. La prévalence de l’AOMI augmentait de manière exponentielle avec l’âge et atteignait 7,65% des plus de 85 ans (tableau 1). Près de 200 000 personnes (0,35% de la population) avaient ou avaient eu dans les 10 ans précédents un anévrisme ou une dissection aortique, avec une moyenne d’âge de 74,3 ans. D’autre part, 130 695 personnes (0,24% de la population) avaient ou avaient eu un anévrisme ou une dissection des artères de moyen calibre, avec une moyenne d’âge de 67,8 ans.
Mortalité
En 2021, l’AOMI était associée à 10 594 décès (cause initiale ou associée), dont 1 902 décès pour lesquels elles étaient la cause initiale du décès (tableau 1). Cela correspondait à un taux de 19,9 décès pour 100 000 habitants (toutes causes) ou 3,6 décès pour 100 000 habitants en cause initiale. L’âge moyen au décès par AOMI était de 85,8 ans en cause initiale et 82,8 ans en cause associée. La majorité de ces décès survenait en établissement hospitalier (68,9%), 18,8% survenaient en établissements d’hébergement pour personnes âgées dépendantes (Ehpad) et maison de retraite, et 11,4% à domicile (données non présentées).
Les anévrismes et dissections aortiques ont été au total la cause initiale de 2 590 décès (4,9 décès pour 100 000 habitants), à un âge moyen de 76,9 ans (données non présentées). Parmi eux, 1 166 personnes étaient décédées du fait d’une dissection aortique, 200 du fait d’un AAT et 846 d’un AAA (tableau 1). Ces décès sont survenus dans 71,2% des cas dans un établissement hospitalier, dans 21,0% des cas à domicile et dans 4,4% des cas en Ehpad et maison de retraite.
Les anévrismes et dissections des artères de moyen calibre ont été la cause initiale de 392 décès (0,7 décès pour 100 000 habitants), et la cause initiale ou associée de 1 140 décès (2,1 pour 100 000 habitants). L’âge moyen au décès par anévrisme et dissection des artères de moyen calibre était de 73,4 ans. Ces décès sont survenus dans 65,3% des cas dans un établissement hospitalier, dans 26,3% des cas à domicile, et dans 5,9% des cas en Ehpad et maison de retraite.
Discussion
Les résultats de notre étude mettent en évidence le poids important des maladies aortiques et artérielles périphériques dans le champ de l’épidémiologie cardiovasculaire. Avec près de 69 000 patients hospitalisés annuellement et plus de 760 000 cas prévalents, l’AOMI est la pathologie la plus fréquente de ce groupe. Les personnes résidant dans les communes défavorisées étaient plus fréquemment touchées. Ces pathologies, touchant préférentiellement des hommes âgés polypathologiques, sont à l’origine de séjours hospitaliers longs (supérieurs à 6 jours) avec une mortalité à 1 an élevée de 17,0% dans notre étude, dépassant celle des cardiopathies ischémiques décrite dans un autre article de ce numéro 14. Une amputation mineure ou majeure a été réalisée chez plus de 11% des patients hospitalisés pour une AOMI et plus de 60% ont bénéficié d’une procédure de revascularisation lors du séjour index. Parmi les patients hospitalisés pour un AAA, une chirurgie ouverte a été réalisée pendant le séjour index chez un tiers d’entre eux, et un traitement endovasculaire dans plus de 50% des cas.
Les maladies aortiques et artérielles périphériques sont majoritairement asymptomatiques ou paucisymptomatiques jusqu’à un stade avancé de la pathologie. Le diagnostic est souvent réalisé tardivement, au moment de complications (rupture de l’anévrisme, claudication intermittente ou ischémie critique menaçante des membres inférieurs). Ce sous-diagnostic rend difficile l’estimation du fardeau épidémiologique de ces pathologies 15. En effet, peu d’études d’ampleur réalisent des explorations permettant le dépistage des maladies artérielles des membres inférieurs ou des anévrismes de l’aorte ou des autopsies systématiques 16,17. Pour les anévrismes rompus ou les dissections aortiques, la mortalité précoce très élevée avant même un contact médical ajoute également à la complexité d’obtenir des données d’épidémiologie exhaustive.
Dans notre étude, la prévalence de l’AOMI augmentait avec l’âge pour atteindre plus de 11% chez les hommes de plus de 85 ans. Le ratio hommes/femmes était de l’ordre de 2 comme cela a été décrit dans la cohorte Framingham 18, mais il semble exister des divergences sur ce point en fonction des études, de la méthodologie utilisée et de l’âge 19. Selon la revue générale de Morrison et Aday 19, la proportion plus importante d’hommes pourrait être partiellement due au risque athéro-thrombotique plus élevé chez ces derniers, comme cela est observé pour les maladies coronariennes. Néanmoins, la revue souligne que l’AOMI est sous-diagnostiquée et sous-traitée chez les femmes. Ainsi, les femmes atteintes d’AOMI seraient moins hospitalisées que les hommes. L’incidence des patients hospitalisés décrite dans notre étude est très supérieure à celle décrite dans l’étude de Brassard et coll. utilisant une méthodologie semblable 20. Cette incidence plus élevée pourrait s’expliquer par la prévalence deux fois plus importante du tabagisme, principal facteur de risque dans la population française par rapport à celle de l’Ontario 21. Le taux annuel de revascularisation dans l’AOMI était similaire au taux observé dans une autre étude française 22. Dans notre, étude les hospitalisations et la prévalence des artériopathies oblitérantes étaient associées aux catégories sociales défavorisées avec une proportion élevée de patients bénéficiant de la C2S, mais également au niveau de la commune de résidence avec une incidence 60% plus élevée dans le quintile des communes défavorisées par rapport aux communes favorisées. Cette relation décrite dans de nombreuses autres études est complexe et résulte de plusieurs phénomènes : une prévalence plus élevée des facteurs de risque cardiovasculaire, un dépistage à un stade plus avancé et un moindre recours aux traitements de prévention secondaire 23,24.
Chez le patient avec une AOMI, le traitement de première intention doit être médical (traitement pharmacologique, arrêt du tabac et rééducation à la marche), la revascularisation ne devant être réservée qu’aux patients restant très invalidés malgré une rééducation à la marche, restant symptomatiques, et avec un contrôle optimal des facteurs de risque cardiovasculaires, ou aux ischémies critiques menaçant le membre inférieur 5,25. Malgré ces recommandations, il est usuellement décrit dans la littérature un sous-recours aux traitements de prévention secondaire de référence (antiagrégant plaquettaire, hypolipémiant, IEC/ARAII) chez les patients atteints d’artériopathie oblitérante 15,26,27. Notre étude met en évidence des taux relativement élevés pour les antiagrégants plaquettaires, les IEC/ARAII et les hypolipémiants dans l’année précédant l’hospitalisation (respectivement 69,7%, 61,2%, et 63,6%), bien supérieurs à ceux décrit aux États-Unis dans l’enquête NHANES, certes plus ancienne, chez des patients avec un index de pression systolique inférieur ou égal à 0,9 (35,8% pour l’aspirine, 24,9% pour les IEC/ARAII, et 30,5% pour les statines), donc moins sévères que dans notre étude 28. Les proportions de patients traités par ces trois molécules étaient encore plus élevées dans l’année qui suivait l’hospitalisation. Ainsi, la proportion de patients traités par antiagrégants plaquettaires atteignait 86,6%, soit un taux supérieur à celles observées après une hospitalisation pour cardiopathie ischémique ou pour un AVC ischémique 14,29. Plus récemment, une étude a mis en évidence que 61,7% des patients ayant eu une revascularisation des artères périphériques avaient une prescription de statines 30. Dans l’étude de Bager et coll. 27, seulement 55,6% des patients traités pour une ischémie critique menaçante des membres inférieurs recevaient une statine dans l’année qui suivait l’événement. Une procédure de revascularisation a été réalisée chez plus de 60% des patients dans notre étude, ce qui est cohérent avec les données de la littérature.
La rééducation à la marche a montré, avec un bon niveau de preuve, son efficacité dans l’augmentation du périmètre de marche sans douleur chez les patients atteints d’AOMI 31,32, mais le recours à cette réadaptation reste rare, comme en témoignent nos résultats avec moins d’un patient sur 10 qui y avait recours dans les six mois suivant l’hospitalisation 15.
L’incidence rapportée des AAT est estimée autour de 5/100 000 personnes 33, donc semblable à celle retrouvée dans notre étude, avec un ratio hommes/femmes standardisé sur l’âge conforme aux taux décrits dans d’autres études 5,34,35. Contrairement aux AAA, il n’existe pas de recommandation de dépistage des AAT. Leur découverte est souvent fortuite à l’occasion d’imageries réalisées pour d’autres indications ou lors d’enquêtes familiales systématiques en cas de maladie de Marfan ou apparenté 36,37. Une chirurgie ouverte a été retrouvée pour plus de la moitié des patients hospitalisés pour un AAT, avec 45,4% (n=1 640) de remplacement de l’aorte ascendante. Seulement 12 cas de remplacement de l’aorte descendante ont été comptabilisés. La chirurgie est, en général, indiquée pour les anévrismes de diamètre supérieur ou égal à 55 mm. Les recommandations concernant la prise en charge chirurgicale ou endovasculaire varient notamment en fonction de l’anatomie, et de la cause 34,35,37.
Comme pour les autres pathologies de l’aorte dans leur phase chronique, les AAA sont souvent diagnostiqués par hasard au décours d’examens d’imagerie pour d’autres pathologies 37. Les études basées sur le dépistage systématique de population mettent en évidence une prévalence plus élevée en population, de l’ordre respectivement de 4,6% et 1,2% chez les hommes et les femmes de plus de 45 ans 38. Le ratio hommes/femmes des taux de prévalence standardisés sur l’âge décrit dans notre étude, de l’ordre de 9/1 (0,35%/0,04%) est élevé par rapport à ce qui est décrit dans la littérature. Cela pourrait venir en partie d’un diagnostic de l’anévrisme par rapport à sa taille et non par rapport à la dilatation d’au moins 50% de la taille de l’aorte, qui peut conduire à ne pas considérer certains anévrismes chez les femmes. En revanche, la mortalité hospitalière plus importante observée chez les femmes par rapport aux hommes présentant un AAA pourrait justement être expliquée par la prise en compte de la taille absolue de l’anévrisme chez les femmes au lieu de la taille relative.
L’incidence des patients hospitalisés pour AAA semble en légère augmentation cette dernière décennie en France, notamment chez les femmes si l’on compare les taux standardisés décrits ici à ceux retrouvés dans une étude utilisant une méthodologie similaire en 2013 39. Il reste difficile de savoir si cette augmentation est liée à une augmentation de l’incidence de la maladie en population, au vieillissement de la population, à une amélioration du dépistage, ou à une augmentation de la prise en charge hospitalière. Néanmoins, l’augmentation de la prévalence du tabagisme dans les générations de femmes nées après la Seconde Guerre mondiale pourrait expliquer une part importante de la hausse des AAA chez les femmes 39. Plusieurs études ont par ailleurs montré une diminution de la prévalence des AAA 40,41.
Le profil des patients hospitalisés pour un AAA diffère de celui des patients hospitalisés pour AAT. Plus âgés, ils présentent, en moyenne, plus fréquemment des facteurs de risque cardiovasculaires en cohérence avec l’origine athéroscléreuse plus fréquente pour cette localisation des anévrismes 35.
Bien que le bénéfice sur la mortalité par AAA de la mise en œuvre de programme de dépistage opportuniste reste débattu 42, la Haute Autorité de santé et les recommandations internationales 35 préconisent la mise en place d’un dépistage ciblé opportuniste unique par écho-doppler chez les personnes à risque (hommes entre 65 et 75 ans fumeurs ou ayant été fumeurs ainsi que les hommes entre 50 et 75 ans présentant des antécédents familiaux) en France, ainsi que systématiquement chez les patients avec une artériopathie périphérique.
Dans notre étude, la proportion de patients hospitalisés pour un AAA ayant eu une chirurgie ouverte (31,8%) est en baisse depuis notre dernière étude datant de 2013 (40,7%) au profit des traitements endovasculaires dont la proportion a augmenté (de 40,8% en 2013 à 58,3% dans la présente étude) 39.
Concernant la dissection aortique, les données d’incidence sont variables en fonction de l’inclusion ou non des cas décédés sans contact médical 43. L’incidence des patients hospitalisés dans notre étude est du même ordre de grandeur que les autres études n’ayant pas inclus la mortalité pré-hospitalière, entre 3,5 et 5,6 pour 100 000. Nos estimations étaient inférieures à celle du Royaume-Uni où l’incidence atteignait 6,0 pour 100 000 44. Néanmoins, dans cette étude, la mortalité extra-hospitalière était incluse et pouvait expliquer cette incidence plus élevée. La mortalité à 30 jours de notre étude (22,3%) était plus élevée que celle décrite en Corée (10,8%) ou à Taïwan (17,7%), mais nettement inférieure à celle décrite en Australie (35,5%) 45.
La proportion de patients diabétiques parmi les patients hospitalisés pour une maladie aortique est 2 à trois fois moindre que celle retrouvée parmi ceux hospitalisés pour une AOMI. Cela pourrait être lié au paradoxe du diabète décrit dans plusieurs études épidémiologiques qui mettent en évidence une relation inverse entre le diabète et les pathologies de l’aorte 45.
Les anévrismes et les dissections des artères de moyen calibre sont d’étiologies diverses. Elles restent des pathologies rares dont l’épidémiologie reste très peu décrite. Pour certains territoires, seuls quelques cas sont rapportés dans la littérature. L’incidence annuelle des dissections des artères carotides rapportée dans la littérature est de 2,5-3/100 000, supérieure à celle rapportée dans notre étude 46. De la même manière, l’incidence des dissections des artères du tronc supra-aortique décrite dans notre étude était légèrement inférieure à celle rapportée dans la littérature, de 1 à 1,5/100 000 46,47. Chez les personnes hospitalisées les plus jeunes, le sex-ratio était équilibré, probablement en raison de la prévalence plus élevée des cas liés à une dysplasie fibromusculaire, plus fréquente chez la femme que chez l’homme. En effet, la dysplasie fibromusculaire qui impacte tout particulièrement les artères rénales, carotides et vertébrales est beaucoup plus fréquente chez les femmes de 20 à 60 ans, avec un sex-ratio moyen de 8:1 48,49. Enfin, il était difficile de comparer l’incidence des atteintes des artères rénales compte tenu du peu de données existantes dans la littérature 50.
Forces et limites
La principale force de notre étude est liée au caractère national de la base de données utilisée, permettant de décrire l’épidémiologie des maladies artérielles périphériques et de l’aorte sur l’ensemble du territoire et de décrire leur prise en charge hospitalière avec précision. Néanmoins, plusieurs limites sont à signaler. Compte tenu de la nature des pathologies étudiées ici, souvent asymptomatiques et en l’absence de dépistage systématique, la part des pathologies décrite dans cet article ne représente qu’une faible part, souvent la part symptomatique, de ces pathologies. D’autre part, la mortalité extrahospitalière très élevée des anévrismes artériels lorsqu’ils sont rompus ou de la dissection aortique est très importante. Ainsi, la mortalité hospitalière et la mortalité à 1 an décrite dans cet article est très sous-estimée et ne doit être interprétée qu’au regard de la part de patients atteignant l’hôpital.
La description de l’épidémiologie des anévrismes et dissections des artères de moyen calibre était limité par la précision du codage. En effet, les diagnostics contenus dans la CIM-10 ne permettaient pas de différencier s’il s’agissait d’un anévrisme ou d’une dissection. Il n’était pas non plus possible de différencier les dissections aortiques de type A ou de type B. De la même manière, certaines localisations rares n’étaient pas codées spécifiquement et étaient regroupées dans une catégorie « Anévrisme et dissection d’autres artères précisées ». Néanmoins, les données de notre étude sur l’épidémiologie descriptive des atteintes des artères de moyen calibre constitue, à notre connaissance, les premières données produites au niveau national.
D’autres limites sont inhérentes à l’utilisation d’une base de données médico-administratives (voir supplément (1)), telle que l’identification du tabagisme ou de l’obésité qui est très dépendante du codage et sont sous-estimées, dans la mesure où leur codage ne permet pas toujours une valorisation supérieure du séjour hospitalier. En ce qui concerne l’HTA, bien que la délivrance d’antihypertenseurs puisse être retrouvée dans le SNDS, l’indication du traitement n’est pas toujours disponible, rendant difficile l’estimation précise de la prévalence réelle de l’HTA parmi les patients hospitalisés pour ces pathologies artérielles périphériques via le codage.
Conclusion
Notre étude met en évidence le poids important des maladies aortiques et artérielles périphériques dans le champ de l’épidémiologie cardiovasculaire. Avec près de 69 000 patients hospitalisés chaque année et plus de 760 000 cas prévalents, l’AOMI occupe une place prépondérante dans ce tableau. La mortalité à court terme à la suite d’une rupture d’anévrisme aortique ou une dissection aortique demeure très élevée. Étant donné la prévalence élevée des facteurs de risque cardiovasculaire dans la population française et le vieillissement de celle-ci, le fardeau de ces pathologies devrait s’accroître. Seules des stratégies agressives de prévention cardiovasculaire pourraient de manière effective limiter l’impact de ces maladies sur la population française et le système de soin.
Tous ces indicateurs peuvent être retrouvés sur le site : https://odisse.santepubliquefrance.fr, consultable à partir du 17 mars 2025.
Liens d’intérêt
Amélie Gabet, Valérie Olié, Grégory Lailler, Clémence Grave, Philippe Tuppin, et Joseph Emmerich déclarent ne pas avoir de
liens d’intérêt au regard du contenu de l’article.
Jacques Blacher déclare, en dehors de ce travail, des liens avec Astra-Zeneca, Bayer, Elkendi, Hikma, Leurquin Mediolanum,
Omron, Organon, Sanofi, Vivactis, ViiV et Vivoptim.
Beata Kantor déclare des liens avec Sanofi Aventis France et les laboratoires Servier.
Références
Citer cet article
 Agrandir l'image
Agrandir l'image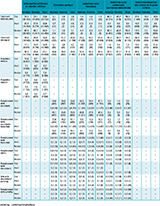 Agrandir l'image
Agrandir l'image



