Consommation d’antibiotiques et résistances bactériennes en établissement de santé. Données Spares 2019-2022
// Antimicrobial use and antimicrobial resistance in healthcare facilities: Data from the national SPARES network, 2019–2022
Résumé
La surveillance de la consommation d’antibiotiques et des résistances bactériennes constitue un élément clé des programmes d’actions de prévention des infections et de l’antibiorésistance. L’objectif de ce travail était de décrire la consommation d’antibiotiques et les résistances bactériennes (Enterobacterales produisant une bêta-lactamase à spectre étendu –EBLSE– ou une carbapénémase –EPC–, souches résistantes à la méticilline parmi les Staphylococcus aureus –SARM–) dans les établissements de santé (ES) ayant participé au réseau de surveillance national Spares chaque année sur la période 2019-2022. Les consommations d’antibiotiques à visée systémique (classe J01 de la classification Anatomical Therapeutic Chemical (ATC), rifampicine, imidazolés per os et fidaxomicine), dispensés en hospitalisation complète, ont été exprimées en nombre de doses définies journalières (DDJ système ATC-DDD, 2023) et rapportées à l’activité en nombre de journées d’hospitalisation (JH) dans 1 217 ES ayant participé chaque année. La densité d’incidence (nombre de souches/1 000 JH) a été calculée pour EBLSE, EPC et SARM dans respectivement 472, 435 et 472 ES. Les consommations d’antibiotiques étaient plus élevées en 2022 qu’en 2019 (295 et 290 DDJ/1 000 JH respectivement), notamment celles des antibiotiques à large spectre, à l’exception des fluoroquinolones. La densité d’incidence des EBLSE était restée globalement stable (0,55/1 000 JH en 2022) ; celle des EPC avait progressé, surtout entre 2021 et 2022 (0,024/1 000 JH en 2022), et celle des SARM avait diminué (0,15/1 000 JH en 2022). Ces résultats contrastés incitent à poursuivre la mobilisation, en associant encore plus étroitement les actions de surveillance, de prévention et de promotion du bon usage des antibiotiques, comme prévu dans la nouvelle mission Spares 2023-2028.
Abstract
Surveillance of antimicrobial consumption (AMC) and antimicrobial resistance (AMR) is a cornerstone of infection control and antimicrobial stewardship strategies. We aimed to describe AMC and AMR (extended-spectrum beta-lactamase producing Enterobacterales [ESBL-E], carbapenemase producing Enterobacterales [CPE] and methicillin-resistant Staphylococcus aureus [MRSA]) in the network of healthcare facilities participating in the National Antimicrobial Resistance Surveillance and Prevention Scheme (SPARES) between 2019 and 2022. Antibacterials for systemic use (J01 class of the WHO Anatomical Therapeutic Chemical classification, ATC-DDD system, 2023), rifampin, oral imidazole derivatives and fidaxomicin were surveyed using pharmacy records and expressed in number of defined daily doses (DDD) per 1,000 occupied-bed-days (OBD) for 1,217 participating hospitals. Incidence density (number of strains/1000 OBD) were calculated for ESBL-E, CPE and MRSA for 472, 435 and 472 hospitals, respectively. AMC was higher in 2022 compared to 2019 (295 and 290 DDD/1,000 OBD, respectively), especially for broad-spectrum antibiotics apart from fluoroquinolones. Incidence density did not change for ESBL-E (0.55/1,000 OBD in 2022), increased for CPE (0.024/1,000 OBD in 2022), and decreased for MRSA (0.15/1,000 OBD in 2022). These contrasting results call for enhancing strategies combining surveillance, infection control and actions to promote rational use of antibiotics, in line with the new SPARES objectives for 2023–2028.
Introduction
En 2019, 1,27 millions de décès étaient attribuables à l’antibiorésistance au niveau mondial 1. Face à ce danger, la mobilisation est internationale et a été définie dès 2015 dans le plan d’action de l’Organisation mondiale de la santé (OMS) 2. En 2023, la recommandation du Conseil de l’Union européenne visant à lutter contre la résistance aux antimicrobiens dans le cadre d’une approche « Une seule santé » 3 souligne, parmi les actions à conduire en santé humaine pour promouvoir une utilisation prudente des antimicrobiens, l’importance d’améliorer la surveillance de la résistance bactérienne et de la consommation d’antibiotiques. Pour la première fois au niveau européen, des cibles à atteindre sont fixées pour chaque pays pour des indicateurs de résistance bactérienne et de consommation d’antibiotiques. En France, la stratégie nationale 2022-2025 de prévention des infections et de l’antibiorésistance 4 avait déjà déterminé des objectifs ambitieux, afin de réduire le risque sanitaire lié aux infections en santé humaine, notamment celles liées à des bactéries résistantes aux antibiotiques. Pour atteindre ces objectifs, 42 actions sont proposées concernant la formation, la communication, le renforcement des ressources compétentes et expertes, la recherche et l’innovation, la préservation des produits et de l’environnement, ainsi qu’en matière de surveillance pour une meilleure valorisation et utilisation des données, pour éclairer les décideurs politiques et conduire des actions. Des objectifs chiffrés ont également été définis au niveau national pour certains indicateurs. Pour les établissements de santé (ES), la surveillance de la consommation des antibiotiques et des résistances bactériennes est déléguée par Santé publique France à la mission de Surveillance et de prévention de l’antibiorésistance en établissement de santé (Spares) coordonnée par le CPias Grand Est associé au CPias Nouvelle-Aquitaine 5. Les données de surveillance de Spares utilisent une méthodologie nationale standardisée qui permet aux niveaux local, régional et national :
–d’identifier les priorités d’actions, notamment en confrontant des secteurs d’activité comparables ;
–de suivre dans le temps les tendances ;
–d’estimer l’effet des actions entreprises.
La surveillance permet ainsi de suivre l’évolution des indicateurs clés de la stratégie nationale de prévention des infections et de l’antibiorésistance, 2019 étant l’année de référence pour évaluer les progrès réalisés à l’horizon 2025 4. Dans ce contexte, l’objectif de ce travail était de décrire, sur la période 2019-2022, la consommation des antibiotiques et les résistances bactériennes, notamment la résistance à la méticilline de Staphylococcus aureus (SARM), la production de bêta-lactamase à spectre étendu (EBLSE) et de carbapénémase (EPC) chez les Enterobacterales, dans les ES ayant participé au réseau de surveillance national Spares chaque année.
Méthode
Population de l’étude
Dans le cadre de la surveillance Spares, les ES volontaires ont été invités, chaque année, à recueillir de façon rétrospective les données de consommation des antibiotiques et/ou de résistances bactériennes de l’année précédente, et à les importer sur une application en ligne dédiée (ConsoRes®). Le champ de la surveillance portait sur les secteurs d’hospitalisation complète. Les secteurs d’hospitalisation de jour, les consultations et les urgences sans hospitalisation étaient exclus. La méthodologie complète est disponible sur les pages internet de la mission Spares (1).
Les données des ES ayant participé chaque année à l’un des volets de la surveillance font l’objet de ce travail. Ainsi, durant la période 2019-2022, 1 217 ES ont fourni des données pour les consommations d’antibiotiques, et 472, 435 et 472 ES pour, respectivement, la surveillance des EBLSE, EPC et SARM. Chaque ES participant devait avoir identifié au moins une souche de S. aureus ou renseigné le phénotype de résistance BLSE ou carbapénémase (positif ou négatif).
Données recueillies
L’activité, en nombre de journées d’hospitalisation (JH) complète, a été recueillie par secteur d’activité clinique : médecine, chirurgie, réanimation, pédiatrie, gynécologie-obstétrique, soins de suite et de réadaptation (SSR), soins de longue durée (SLD) et psychiatrie.
Les quantités d’antibiotiques dispensées par la pharmacie à usage intérieur pour les patients hospitalisés dans les secteurs d’activité clinique ont été recueillies pour les antibiotiques à visée systémique (classification Anatomical Therapeutic Chemical -ATC- J01 de l’OMS), les imidazolés per os, la rifampicine et la fidaxomicine. L’application en ligne permettait d’exprimer ces quantités en nombre de doses définies journalières (DDJ ou DDD en anglais, unité définie par l’OMS). La version 2023 de la classification ATC/DDD a été utilisée 6.
Les données de résistance bactérienne étaient recueillies pour toutes les souches de Staphylococcus aureus et d’Enterobacterales isolées de prélèvements à visée diagnostique et ayant fait l’objet d’un antibiogramme. Le dédoublonnage des données était réalisé automatiquement par l’application informatique en deux temps : un premier dédoublonnage permettait une analyse des résistances par type de prélèvement, un second une analyse globale tous types de prélèvements confondus.
Analyse descriptive
Les consommations d’antibiotiques ont été décrites en nombre de DDJ rapporté à l’activité pour 1 000 JH pour l’ensemble de la cohorte des 1 217 ES ayant fourni des données chaque année. En complément, la proportion de certains antibiotiques au sein de la consommation globale a été calculée pour :
–les antibiotiques à large spectre dans le contexte hospitalier selon la définition de l’European Centre for Disease prevention and Control (ECDC) qui propose un indicateur (indicateur ECDC 7) mesurant la part de céphalosporines de troisième et quatrième générations (C3G+C4G), d’association pipéracilline-tazobactam, d’aztréonam, de carbapénèmes, de fluoroquinolones, de glycopeptides, de linézolide, de tédizolide, de daptomycine et de colistine au sein de la consommation des antibiotiques de la classe ATC J01 ;
–la part représentée par chaque groupe d’antibiotiques selon la classification des antibiotiques dits « critiques » proposée par la Société de pathologie infectieuse de langue française (Spilf) en janvier 2022 pour les ES 8 : le groupe I inclut des molécules à usage courant et à utilisation préférentielle, le groupe II des molécules à usage restreint (impact plus important sur la résistance bactérienne), et le groupe III des molécules à usage réservé pour préserver leur efficacité.
Les pourcentages de résistance ont été calculés en rapportant le nombre de souches résistantes, ou présentant le phénotype, au nombre de souches pour lesquelles le caractère était mentionné. Les densités d’incidence (DI) ont été calculées en rapportant le nombre de souches à l’activité pour 1 000 JH pour EBLSE, EPC et SARM.
La significativité des différences entre deux années a été évaluée par le test des rangs signés de Wilcoxon.
Résultats
Description des établissements de santé participants
De 2019 à 2022, les 1 217 ES constituant la cohorte ayant fourni des données de consommation d’antibiotiques étaient situés dans toutes les régions françaises et tous les types d’établissements étaient représentés : centres hospitaliers de type universitaire (N=38) ou non (N=413), cliniques privées pratiquant une activité de médecine, chirurgie et/ou obstétrique (MCO, N=295), centres de lutte contre le cancer (N=16), établissements psychiatriques (N=112), établissements de SSR (N=324) et établissements de SLD (N=19). Ces ES représentaient, en 2022, plus de 63 millions de JH, dont 30% dans des secteurs de médecine, 25% en SSR, 13% en chirurgie, 13% en psychiatrie. Le nombre de JH dans ces ES avait fortement diminué en 2020 par rapport à 2019 (69 145 662 en 2019 et 63 388 731 en 2020 soit -8%) et était resté stable entre 2020 et 2022.
Les trois cohortes d’ES ayant fourni chaque année des données concernant les EBLSE, les EPC et les SARM avaient un profil de participants comparable avec plus de deux tiers de centres hospitaliers (N=167 à 182) ou MCO (N=121 à 133), et un quart environ d’établissements de SSR (N=109 à 118). Au sein de chacune de ces trois cohortes, la majorité des JH avait été réalisée dans des secteurs de médecine et de SSR (tableau 1). En 2022, les secteurs de médecine regroupaient la moitié des souches étudiées de la cohorte des EBLSE et EPC, et 38% des souches de la cohorte SARM.
 Agrandir l'image
Agrandir l'imageÉvolution des consommations d’antibiotiques entre 2019 et 2022
Au sein des 1 217 ES, après une progression entre 2019 et 2020 (+1,3%, dans un contexte de réduction d’activité clinique, sauf en réanimation, en lien avec la crise Covid-19), puis une réduction en 2021, la consommation avait de nouveau progressé de 2% en 2022 pour atteindre 296 DDJ/1 000 JH, valeur supérieure à celle observée en 2019 (290 DDJ/1 000 JH, différence non significative) (tableau 2).
 Agrandir l'image
Agrandir l'imageParmi l’ensemble des antibiotiques, la part d’antibiotiques à large spectre, estimée par le calcul de l’indicateur ECDC, avait significativement progressé entre 2019 et 2022, avec une augmentation notable en 2020. La part des antibiotiques du groupe I de la Spilf 8 avait diminué significativement, de 66,8% en 2019 à 64,9% en 2022 (tableau 2).
Les évolutions de ces indicateurs étaient liées aux variations de consommation de certains antibiotiques en particulier. En effet, la part de nombreux antibiotiques à large spectre inclus dans le calcul de l’indicateur ECDC avait significativement progressé entre 2019 et 2022, comme l’association pipéracilline-tazobactam, la daptomycine et le linézolide (figure 1). Les consommations de C3-4G et d’azithromycine avaient fortement progressé entre 2019 et 2020. Bien qu’une réduction ait été observée depuis, les valeurs 2022 étaient restées supérieures à celles de 2019. Les consommations de carbapénèmes avaient, quant à elles, progressé jusqu’en 2021.
À l’inverse, les fluoroquinolones avaient été moins consommées chaque année. La même tendance avait été observée pour l’association amoxicilline-acide clavulanique jusqu’en 2021, avant une progression significative en 2022. Ce dernier antibiotique, le plus utilisé en milieu hospitalier, fait partie des antibiotiques du groupe I de la Spilf.
 Agrandir l'image
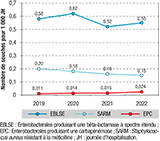
Agrandir l'imageÉvolution des résistances bactériennes entre 2019 et 2022
Évolution globale
Le pourcentage de EBLSE a diminué de 1,2 point entre 2019 et 2022 : 8,6% en 2019, 8,2% en 2020, 7,2% en 2021 et 7,4% en 2022. Il était plus important dans les secteurs de réanimation, SSR et SLD avec respectivement 9,8%, 10,5% et 17,2% en 2022. Des variations étaient observées selon les espèces : 5,4% des Escherichia coli, 19,8% des Klebsiella pneumoniae et 17,9% des bactéries du complexe Enterobacter cloacae étaient des EBLSE en 2022.
La densité d’incidence (DI) des EBLSE a diminué entre 2019 et 2021, malgré une augmentation significative entre 2019 et 2020 (figure 2, p=0,009). L’augmentation entre 2021 et 2022 n’était pas significative. Des variations étaient observées selon les espèces : seule la DI de E. coli BLSE a diminué significativement entre 2019 et 2022 (0,27 vs 0,23 souches/1 000 JH, p<0,001). Pour K. pneumoniae et le complexe E. cloacae, l’augmentation des DI n’était pas significative : 0,18 en 2019 et 0,19 en 2022 pour K. pneumoniae et 0,08 en 2019 et 0,09 en 2022 pour le complexe E. cloacae.
Le nombre de souches d’EPC a quasiment doublé entre 2019 et 2022 avec un pourcentage atteignant 0,311% en 2022. La DI des EPC a augmenté de manière significative entre 2019 et 2022 (p<0,001) et plus particulièrement entre 2021 et 2022 (p=0,002).
Le pourcentage de SARM a diminué entre 2019 et 2022 : 15,6% en 2019, 13,9% en 2020, 12,5% en 2021 et 12,1% en 2022. Cette tendance est observée de manière significative pour la DI (p<0,001).
Évolution selon les secteurs d’activité clinique
En secteur de médecine, la DI des EBLSE a diminué entre 2019 et 2022 (0,79 vs 0,72, p=0,004) contrairement au secteur SLD où elle a augmenté (0,23 vs 0,28, p=0,016).
L’analyse au niveau des espèces a montré une diminution de la DI de E. coli BLSE entre 2019 et 2022 pour les secteurs de médecine et chirurgie (respectivement p<0,001 et p=0,038). En pédiatrie, une augmentation de la DI des E. coli BLSE est observée entre 2021 et 2022 (p=0,016). En secteur de médecine, une augmentation de la DI des bactéries du complexe E. cloacae BLSE est observée entre 2019 et 2022 (p=0,034). En secteur de réanimation, les DI n’ont pas évolué de manière significative entre 2019 et 2022 (tableau 3).
 Agrandir l'image
Agrandir l'imageLa DI d’EPC a augmenté globalement et de manière significative dans les secteurs de médecine (p<0,001), réanimation (p=0,024) et SSR (p=0,010) (tableau 4).
 Agrandir l'image
Agrandir l'imageLa DI de SARM a diminué entre 2019 et 2022 de manière significative pour tous les secteurs d’activité, exceptés pour les secteurs de pédiatrie et SLD (tableau 5). En psychiatrie, les SARM étaient rarement isolés.
 Agrandir l'image
Agrandir l'imageDiscussion
La surveillance Spares a permis de suivre l’évolution des consommations d’antibiotiques et des résistances bactériennes dans un grand nombre d’ES entre 2019 et 2022. Compte tenu de la crise sanitaire Covid-19 qui a profondément modifié l’activité des ES, notamment en 2020 9, la stratégie nationale de prévention des infections et de l’antibiorésistance 2022-2025 a fixé l’année 2019 comme année de référence pour suivre l’évolution d’indicateurs clés de consommation d’antibiotiques et de résistance bactérienne.
En ce qui concerne la consommation d’antibiotiques, l’objectif global national à l’horizon 2025 est d’atteindre une réduction de 10% de la consommation globale d’antibiotiques ainsi que de la part d’antibiotiques à large spectre estimée par l’indicateur ECDC. En 2022, la valeur de ces indicateurs était plus élevée qu’en 2019 de 1,6% et de 5,1% respectivement, avec toutefois une amélioration récente pour l’indicateur ECDC en 2022, plus faible qu’en 2021. Cette évolution souligne la nécessité de prendre en compte l’ensemble des facteurs associés à la consommation des antibiotiques et à la résistance bactérienne pour identifier les actions à conduire.
L’évolution observée dans les hôpitaux français entre 2019 et 2021 rejoint celle des hôpitaux suédois 10, suisses 11 et néerlandais 12. Les consommations significativement plus élevées en 2020 (p=0,036), avec une forte progression des antibiotiques à large spectre, comme les C3-4G (p<0,001), et l’azithromycine (p<0,001), correspond à la prise en charge de patients Covid-19 traités par antibiotique pour couvrir le risque de surinfection bactérienne 10,11,12,13. Malgré la diffusion de recommandations mi-2020 en France sur la gestion des cas de Covid-19, des pratiques de prescription par excès ont pu persister lors des phases épidémiques en 2021. La réduction d’activité hospitalière en 2020, recentrée sur les patients Covid-19, en réduisant le nombre de JH, a contribué à la progression de la valeur de la consommation d’antibiotiques exprimée en nombre de DDJ/1 000 JH 14,15 et à l’annulation de la prise en charge d’autres patients, moins à risque d’être traités par antibiotiques 11,16. En 2021, la réduction de consommation antibiotique pourrait être liée à la faible fréquence d’infections respiratoires au cours des hivers suivant le début de la pandémie de Covid-19 en raison du maintien des mesures de prévention (port du masque, hygiène des mains…). Ces constats suggèrent un usage inapproprié d’antibiotiques en période d’épidémies respiratoires, dont beaucoup sont liées à des agents viraux. Les actions de bon usage des antibiotiques à l’hôpital doivent donc aussi viser cette situation, par exemple en facilitant le recours à des tests rapides d’orientation diagnostique.
Au-delà de l’impact de la pandémie de Covid-19, notamment en 2020, l’augmentation de certains antibiotiques comme l’association pipéracilline-tazobactam, les carbapénèmes, la daptomycine et le linézolide a été également rapportée dans d’autres pays comme le Danemark, la Suisse, la Suède 10,11,17. En Suède, comme en France, les consommations d’antibiotiques en ES ont été plus élevées en 2022 qu’en 2021 avec une part d’antibiotiques à large spectre plus faible qu’en 2021, mais toujours plus élevée qu’en 2019 avant la pandémie 10. À l’inverse, la réduction continue des consommations de fluoroquinolones suggère un impact des messages d’épargne de ces antibiotiques diffusés depuis plusieurs années, et renforcés encore en 2023 en raison d’effets indésirables autres que l’impact écologique 18. Enfin, la progression d’antibiotiques à visée anti-staphylocoques résistants à la méticilline illustre aussi la nécessité d’identifier des actions de prévention ciblées sur ces bactéries, qu’il s’agisse de S. aureus ou de staphylocoques à coagulase négative 19.
Concernant les résistances bactériennes, les DI des EBLSE n’avaient pas montré d’évolution significative entre 2019 et 2022, avec, cependant, une progression significative en 2020 dans le contexte d’activité hospitalière modifiée, une diminution en 2021, puis une nouvelle progression en 2022, la valeur 2022 restant plus faible que celle observée en 2019. Une diminution de DI en secteur de médecine est toutefois notée, source de près de la moitié des souches d’EBLSE chaque année. Ces évolutions avaient varié selon l’espèce entre 2019 et 2020 : la DI de E. coli BLSE était restée stable entre 2019 et 2020 alors que celles de K. pneumoniae et du complexe E. cloacae BLSE avaient significativement augmenté en 2020. Cette différence pourrait être liée à des phénomènes de transmission croisée dans un contexte de pression antibiotique plus élevée en 2020, ainsi qu’à une augmentation de la charge en soins et à des conditions de travail plus difficiles pour le personnel. La comparaison avec les données européennes d’EARS-Net 2019-2021 des pays de population comparable à la France, limitée aux infections invasives, montre une stagnation des niveaux de résistances aux C3G de E. coli et K. pneumoniae (tous mécanismes confondus) 20.
Après une relative stabilité entre 2019 et 2021, tendance également retrouvée par le Centre national de référence (CNR) associé, de la résistance aux antibiotiques entre 2018 et 2020 21, la DI des EPC a augmenté en 2022 de manière significative. Cette évolution est globalement retrouvée dans le monde entier, mais avec des disparités selon les pays 20. Elle s’inscrit dans le contexte de progression de la consommation de carbapénèmes décrite plus haut.
La poursuite de la diminution des isolements de SARM, tous secteurs d’activité clinique confondus, est globalement observée dans les pays européens que ce soit en termes de DI ou du pourcentage (SARM/SA), et semble finalement peu affectée par la pandémie Covid-19. L’objectif de réduction de 10% de l’incidence du SARM par rapport à 2019 4 est ainsi déjà atteint en 2022 dans la cohorte des ES participants.
Les résultats de la surveillance Spares sont cohérents avec les données de la littérature décrivant l’impact de l’épidémie de Covid-19 sur la résistance aux antibiotiques qui montrent des effets variables selon les espèces bactériennes 22,23.
Conclusion
En conclusion, la surveillance Spares a permis d’observer des évolutions contrastées entre 2019 et 2022. Les consommations d’antibiotiques n’ont pas diminué entre 2019 et 2022 et celle des antibiotiques à large spectre a significativement progressé. Sur cette même période, malgré l’observation de fluctuations des DI des EBLSE, la DI 2022 n’était pas significativement différente de celle de 2019 ; la fréquence des SARM poursuit la tendance à la baisse observée depuis 20 ans. Toutefois, la DI des EPC a augmenté de manière significative en 2022, incitant à un renforcement des mesures de prévention, qu’il s’agisse de prévention de la transmission croisée ou de l’usage rationnel des antibiotiques à large spectre tels que les carbapénèmes. Pour son nouveau mandat 2023-2028, la mission Spares conduira des actions en matière de promotion du bon usage des antibiotiques, complémentaires aux actions de surveillance et de prévention, permettant ainsi une meilleure adaptation des actions proposées aux données de la surveillance.
Remerciements
Remerciements à tous les professionnels des établissements ayant participé à la surveillance.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.
Financement
La mission Spares est financée par Santé publique France.