Consommation d’antibiotiques et résistances bactériennes en établissement de santé. Données Spares 2020
// Antibiotic use and antibiotic resistance in French healthcare facilities in 2020: Data from the national SPARES network
Résumé
La surveillance nationale portant sur les données de consommation d’antibiotiques et de résistances bactériennes dans les établissements de santé (ES) selon la méthodologie de la mission nationale de Surveillance et prévention de l’antibiorésistance en établissement de santé (Spares) a permis de recueillir des informations issues de 1 752 établissements pour la partie « consommation d’antibiotiques » et 1 066 pour la partie « résistances bactériennes » en 2020. La consommation globale d’antibiotiques était de 286 doses définies journalières (DDJ) pour 1 000 journées d’hospitalisation, avec des variations selon les ES et les secteurs d’activité clinique, de 38 en psychiatrie à 1 145 en réanimation. La part des antibiotiques à large spectre (selon l’indicateur défini par l’ECDC) était de 35%. Dans une cohorte d’ES, la consommation globale d’antibiotiques était plus élevée en 2020 qu’en 2019, avec une part plus importante d’antibiotiques à large spectre. Concernant les résistances bactériennes, 8,3% des souches d’entérobactéries étaient productrices de bêta-lactamases à spectre étendu (BLSE) et 0,2% de carbapénémase. Parmi les souches de Staphylococcus aureus, 14% étaient résistantes à la méticilline (SARM). Les proportions de SARM et d’EBLSE étaient plus faibles qu’en 2019, dans la continuité des tendances observées depuis 2016 ; l’incidence plus élevée des EBLSE, dans un contexte d’activité hospitalière modifiée en 2020 reste à explorer. Malgré la poursuite de la crise sanitaire en 2021, les ES se sont mobilisés pour participer à la surveillance nationale permettant d’identifier les pistes de travail pour poursuivre la lutte contre l’antibiorésistance.
Abstract
The nationwide surveillance network coordinated by the project for Surveillance and Prevention of Antibiotic Resistance in hospitals (SPARES) collected information on antibiotic use and antibiotic resistance from 1,752 and 1,066 hospitals, respectively, in 2020. Antibiotic consumption for inpatients was 286 defined daily doses (DDD) per 1,000 patient-days (PD) and ranged from 38 DDD/1,000 PD in psychiatric wards to 1,145 in intensive care units (ICUs). The proportion of broad-spectrum antibiotics, according to the ECDC indicator for hospitals, was 35%. In a cohort of hospitals, antibiotic use was higher than the preceding year with a higher proportion of broad-spectrum antibiotics. Among Enterobacteriaceae strains, 8.3% produced extended spectrum ß-lactamase (ESBL) and 0.2% a carbapenemase. Methicillin-resistant Staphylococcus aureus (MRSA) accounted for 14% of S. aureus. Proportions of ESBL-Enterobacteriaceae and of MRSA were lower than in 2019, consistent with previous trends. However, the higher incidence of ESBL-Enterobacteriaceae, in a context of specific hospital activity due to the Covid-19 crisis in 2020, will be further explored. Despite the ongoing health crisis, hospitals were able to monitor their situation regarding antimicrobial resistance; this underscores the usefulness of the SPARES network for providing information that can steer policies to control antimicrobial resistance.
Introduction
Les infections à bactéries multirésistantes sont à l’origine de plus de 12 000 décès chaque année en France 1 et de 700 000 dans le monde 2. À l’horizon 2050, sans actions internationales conjointes, l’antibiorésistance pourrait devenir une des premières causes de mortalité dans le monde, en provoquant jusqu’à 10 millions de décès chaque année 2. C’est dans ce contexte que l’Organisation mondiale de la santé (OMS) a identifié l’antibiorésistance comme l’une des menaces les plus sérieuses de la santé publique mondiale. L’interdépendance de la santé humaine, de la santé animale et des écosystèmes au sein desquels elles coexistent, impose une approche collaborative globale « One Health » de la lutte contre la résistance bactérienne aux antibiotiques. En 2015, un plan d’action global de lutte contre l’antibiorésistance est approuvé par l’OMS 3. En 2017, l’Union européenne a actualisé son plan d’action et conforté l’approche One Health pour lutter de façon coordonnée contre l’antibiorésistance 4.
En France, le premier programme national de lutte contre les infections nosocomiales en 1994 avait déjà pour objectif de réduire la fréquence des bactéries multirésistantes aux antibiotiques à l’hôpital. Le Programme national d’actions de prévention des infections associées aux soins (Propias) a élargi cet objectif à l’ensemble des secteurs de soins en 2015 5. De plus, depuis les années 2000, une politique de préservation de l’efficacité des antibiotiques a été instaurée avec la succession de plans nationaux portant sur la santé humaine. Depuis 2016, une feuille de route interministérielle pour la maîtrise de l’antibiorésistance a été adoptée dans une perspective One Health 6. Dans le cadre de ces programmes, des réseaux de surveillance en établissement de santé (ES) se sont organisés au travers du Réseau d’alerte, d’investigation et de surveillance des infections nosocomiales (Raisin) : la surveillance des bactéries multirésistantes voit le jour en 2002 et celle de la consommation des antibiotiques en 2009. Les surveillances Raisin disparaissent en 2018 au profit de cinq missions nationales coordonnées par les Centres d’appui pour la prévention des infections associées aux soins (Cpias). La surveillance de la consommation des antibiotiques et des résistances bactériennes est ainsi déléguée par Santé publique France à la mission de Surveillance et de prévention de l’antibiorésistance en établissement de santé (Spares) coordonnée par le Cpias Grand Est associé au Cpias Nouvelle-Aquitaine 7,8. Les données de surveillance, en utilisant une méthodologie nationale standardisée, présentent, aux niveaux local, régional et national, un triple intérêt :
–identifier les priorités de travail, notamment en permettant les comparaisons avec des secteurs d’activités comparables ;
–suivre dans le temps les tendances ;
–estimer l’effet des actions entreprises.
L’objectif de ce travail est de décrire la consommation des antibiotiques et les résistances bactériennes en 2020 dans les ES ayant participé au réseau de surveillance national Spares.
Méthode
La participation à la surveillance Spares est basée sur le volontariat des ES. Tout ES offrant une activité d’hospitalisation complète est éligible et peut participer à la surveillance de la consommation des antibiotiques et/ou des résistances bactériennes.
Les ES ont importé leurs données de consommation et de résistance 2020 (1er janvier au 31 décembre) dans une application en ligne, ConsoRes®. La date limite de recueil était fixée au 31 mars 2021. Seules les données issues d’hospitalisation complète étaient recueillies ; les secteurs d’hospitalisation de jour, les consultations, les urgences sans hospitalisation étaient exclues. L’activité, en nombre de journées d’hospitalisation (JH) complète, était recueillie par secteur d’activité clinique : médecine, chirurgie, réanimation, pédiatrie, gynécologie-obstétrique (ces cinq secteurs constituant l’activité de court séjour), soins de suite et de réadaptation (SSR), soins de longue durée (SLD) et psychiatrie. Certains services ayant été réorganisés au cours de la pandémie de Covid-19, certains patients ont pu être hospitalisés dans un service de soins ne relevant pas de leur prise en charge (ex : transformation d’un service de chirurgie en unité de médecine Covid-19). La majorité des participants à la surveillance ont déclaré les données selon l’activité habituelle du service de soins, sans possibilité de distinction des données relevant de patients Covid-19 des autres.
Les quantités d’antibiotiques à visée systémique (classification ATC – anatomique, thérapeutique et chimique – de l’OMS : J01 + imidazolés per os + rifampicine + fidaxomicine) dispensées par la pharmacie à usage intérieur étaient exprimées en nombre de doses définies journalières (DDJ, unité définie par l’OMS) pour 1 000 JH, par secteur d’activité clinique. En complément, la proportion de certains antibiotiques au sein de la consommation globale a été calculée pour :
–les antibiotiques de « première ligne », selon la classification « AWaRe » de l’OMS qui comporte trois classes d’antibiotiques : « Access » pour les antibiotiques de première ligne, « Watch » pour des antibiotiques à utiliser sur contrôle, « Reserve » pour des antibiotiques de dernier recours 9 ;
–les antibiotiques à large spectre dans le contexte hospitalier selon la définition du European Centre for Disease Prevention and Control (ECDC) qui propose un indicateur 10 mesurant la part de : céphalosporines de troisième et quatrième générations (C3G+C4G), association pipéracilline-tazobactam, aztréonam, carbapénèmes, fluoroquinolones, glycopeptides, linézolide, tédizolide, daptomycine et colistine au sein de la consommation des antibiotiques de la classe ATC J01.
Les données de résistance bactérienne étaient recueillies pour toutes les souches isolées de prélèvement à visée diagnostique et ayant fait l’objet d’un antibiogramme. Dans cet article, seules les souches de Staphylococcus aureus et d’entérobactéries ont été étudiées. Le dédoublonnage des données était réalisé automatiquement par ConsoRes® en deux temps. Un premier dédoublonnage permettait une analyse des résistances par type de prélèvement : un seul isolat par antibiotype et par type de prélèvement était retenu pour un patient (types de prélèvement détaillés dans un thésaurus). Un second dédoublonnage permettait une analyse globale tous types de prélèvements confondus : pour un antibiotype donné, une seule souche par patient était conservée. Les pourcentages de résistance correspondaient aux souches caractérisées résistantes ou intermédiaires à un antibiotique donné.
La méthodologie complète est disponible sur les pages Internet de la mission Spares (1).
Pour mettre en perspective les données 2020 avec celles de 2019, des cohortes d’établissements ont été constituées et la significativité des différences entre 2019 et 2020 a été évaluée par le test des rangs signés de Wilcoxon. Pour les consommations d’antibiotiques, la cohorte était constituée de 1 092 ES ayant fourni des données en 2019 et en 2020. Les densités d’incidence (DI) de SARM et d’EBLSE ont été calculées sur des cohortes d’établissements ayant participé à la surveillance de la résistance bactérienne en 2019 et 2020. Deux cohortes distinctes ont été constituées, en prenant en compte les éléments suivants :
–cohorte « SARM », composée de 762 établissements ayant identifié des souches de S. aureus avec résultat à la méticilline ou n’ayant identifié aucune souche de S. aureus ;
–cohorte « EBLSE » composée de 753 établissements ayant identifié des souches d’entérobactéries pour lesquelles une recherche du phénotype « BLSE » a été réalisée, que le résultat de cette recherche soit positif ou négatif.
Résultats
Participation
En 2020, 1 752 ES ont participé à la surveillance de la consommation des antibiotiques, représentant 318 168 lits et 86 024 277 journées d’hospitalisation (JH) complète, soit 82% des lits et 81% des JH d’après les données de la statistique annuelle des établissements de santé (SAE) 2020. Quant à la surveillance des résistances bactériennes, 1 066 ES y ont participé, représentant 211 028 lits et 56 268 312 (JH) complètes, soit 55% des lits et 53% des JH d’après les données de la SAE 2020.
Ces ES, de tous types (centres hospitaliers universitaires ou non, centres de lutte contre le cancer, établissements de soins de suite et de réadaptation, établissements de soins de longue durée, établissements psychiatriques, hôpitaux d’instruction des armées, cliniques privées pratiquant une activité de médecine, chirurgie et/ou obstétrique), étaient situés dans l’ensemble des régions françaises. La moitié de l’activité, en nombre de JH, concernait des secteurs d’activité clinique de court séjour.
Consommation d’antibiotiques en 2020
La consommation globale d’antibiotiques était de 286 DDJ / 1 000 JH, avec des variations selon le secteur d’activité clinique : de 38 DDJ / 1 000 JH en psychiatrie à 1 145 en réanimation (figure 1).
 Agrandir l'image
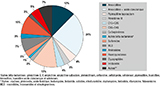
Agrandir l'imageL’amoxicilline et l’amoxicilline associée à l’acide clavulanique représentaient plus du tiers des DDJ utilisées (figure 2).
 Agrandir l'image
Agrandir l'imageLa part des antibiotiques du groupe Access de la classification de l’OMS, qui comporte entre autres l’amoxicilline et l’association amoxicilline-acide clavulanique, représentait 58,1% des antibiotiques consommés. Ces molécules représentaient plus de la moitié des consommations en gynécologie-obstétrique, psychiatrie et soins de longue durée et seulement 17% en réanimation.
La part des antibiotiques à large spectre de l’ECDC était de 35,3% avec des variations selon le secteur d’activité : l’indicateur ECDC variait ainsi de 10% en gynécologie-obstétrique à 53% en réanimation.
Évolution de la consommation d’antibiotiques entre 2019 et 2020
Au sein d’une cohorte de 1 092 ES ayant participé à la surveillance de la consommation d’antibiotiques en 2019 et 2020, l’activité en nombre de JH avait diminué de 8% entre ces deux années. Tous les secteurs d’activité étaient touchés par cette baisse d’activité, notamment la chirurgie (-15,4%). Le seul secteur d’activité ayant connu une augmentation de son activité était la réanimation (+7,6%).
Dans cette cohorte, la consommation d’antibiotiques en 2020 (306 DDJ/1 000 JH) était plus élevée que celle observée en 2019 (300 DDJ/1 000 JH, p=0,017). En particulier, la consommation de certains antibiotiques était significativement plus élevée en 2020 (p<0,01) : antibiotiques à large spectre constituant l’indicateur ECDC (à l’exception des fluoroquinolones) et macrolides comme l’azithromycine et la spiramycine (figure 3). À l’inverse, la consommation de l’association amoxicilline-acide clavulanique était significativement plus faible (p<0,01).
 Agrandir l'image
Agrandir l'imageRésistances bactériennes en 2020
La grande majorité des souches étudiées avaient été identifiées dans des prélèvements de patients hospitalisés en court séjour, respectivement, 83% des souches d’entérobactéries et 91% des souches de Staphylococcus aureus, principalement dans des secteurs de médecine (47% et 36%) (tableau 1).
 Agrandir l'image
Agrandir l'imageStaphylococcus aureus résistant à la méticilline
Durant l’enquête, 14,0% (n=9 221) des souches de Staphylococcus aureus étaient résistantes à la méticilline (SARM), tous prélèvements confondus.
La majorité des souches de SARM étaient isolées de prélèvements de pus profond et de séreuses (22,2%). Toutefois, le pourcentage de SARM était le plus important pour les prélèvements urinaires (28,3%) (tableau 2).
par type de prélèvement (n=9 221). Données Spares, France 2020
 Agrandir l'image
Agrandir l'imageEntérobactéries productrices de bêta-lactamase à spectre étendu (EBLSE)
Tous prélèvements confondus, 31 486 souches d’entérobactéries produisaient une BLSE, soit un pourcentage de 8,3%. Cinq espèces : Escherichia coli (44,6%), Klebsiella pneumoniae (32,7%), Enterobacter cloacae complex (15,3%), Citrobacter freundii (1,8%) et Klebsiella oxytoca (1,6%) représentaient plus de 95% des EBLSE.
Près de deux-tiers des souches d’EBLSE étaient isolées de prélèvements urinaires. La proportion d’EBLSE était la plus importante dans les prélèvements issus de dispositifs intravasculaires (15,4%). (tableau 3).
par type de prélèvements (n=31 486). Données Spares, France 2020
 Agrandir l'image
Agrandir l'imageEntérobactéries productrices de carbapénémase
Au cours de la surveillance, 673 souches d’entérobactéries productrices de carbapénémase (EPC) ont été recueillies, soit une DI de 0,013 prélèvements positifs à EPC pour 1 000 JH.
Les espèces productrices de carbapénémase les plus fréquemment identifiées étaient Klebsiella pneumoniae (39,7%), Enterobacter cloacae complex (22,9%), Escherichia coli (18,3%), Citrobacter freundii (8,9%) et Klebsiella oxytoca (3,4%).
La majorité des EPC était identifiée dans des prélèvements urinaires (41,1%), dans les hémocultures (10,7%) et les prélèvements de pus profond et de séreuses (10,5%).
Évolution des densités d’incidence SARM et EBLSE entre 2019 et 2020
Entre 2019 et 2020, l’activité hospitalière, en nombre de JH, a diminué de 8% environ dans les deux cohortes d’ES (762 ES pour SARM et 753 ES pour EBLSE). La réanimation est le seul secteur ayant vu son activité progresser en 2020 (tableau 4).
 Agrandir l'image
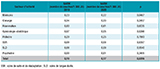
Agrandir l'imageLa DI des prélèvements positifs à SARM pour 1 000 JH était de 0,19 tous prélèvements confondus en 2019 et de 0,17 en 2020 (p=0,0355). La DI la plus élevée était observée en secteur de réanimation avec 0,80 SARM pour 1 000 JH tous prélèvements confondus en 2019 et 0,61 SARM pour 1 000 JH en 2020 (p=0,0035) (tableau 5).
 Agrandir l'image
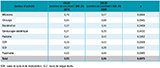
Agrandir l'imageTous prélèvements confondus, la DI était de 0,55 prélèvements positifs à EBLSE pour 1 000 journées d’hospitalisation en 2019 et de 0,59 EBLSE pour 1 000 JH en 2020 (p=0,0073).
La DI la plus élevée était observée en secteur de réanimation avec 3,22 EBLSE pour 1 000 JH en 2019 et 3,55 EBLSE pour 1 000 JH en 2020 (p=0,2409) (tableau 6).
Les infections à EBLSE étaient trois fois plus fréquentes que les infections à SARM.
au sein de la cohorte de 753 établissements. Données Spares, France
 Agrandir l'image
Agrandir l'imageDiscussion
En 2020, les professionnels des ES se sont mobilisés pour participer à la surveillance nationale Spares, permettant le recueil de données sur l’antibiorésistance dans un nombre toujours important d’ES. En effet, entre 2019 et 2020, le nombre d’ES participant à la surveillance de la consommation antibiotiques est resté stable (+1%). Celui des ES surveillant les résistances bactériennes a augmenté de 7% de même que le nombre de lits couverts 11. Malgré cette progression, la répartition des types d’ES et des secteurs d’activité restaient comparables entre ces deux années.
Les données 2020 portent toutefois sur un nombre plus faible de journées d’hospitalisation du fait de la réduction d’activité marquée au cours du 1er semestre, sauf en réanimation 12. Cette modification de l’activité hospitalière et l’accueil de nombreux patients présentant une infection à SARS-CoV-2 est à prendre en compte dans l’interprétation des données.
En ce qui concerne les consommations d’antibiotiques, l’année 2020 est marquée par une stabilisation de la consommation globale, après une période de réduction ces dernières années, et une part plus importante que les années précédentes des macrolides (azithromycine et spiramycine) et des antibiotiques à large spectre surveillés au travers de l’indicateur ECDC. Ces observations pourraient être liées à la prise en charge de patients atteints ou suspects de surinfections bactériennes de pathologies liées au SARS-CoV-2. En effet, les traitements de ces surinfections bactériennes ou suspicions de surinfection ont reposé, dans un premier temps, sur l’azithromycine. En mai 2020, le Haut Conseil de la santé publique (HCSP) a diffusé des recommandations de traitement probabiliste des infections bactériennes des voies respiratoires rappelant la place de l’amoxicilline, associée ou non à l’acide clavulanique, et des C3G 13. Les valeurs de consommation dans les secteurs de chirurgie, plus élevées que les années précédentes 11, sont à interpréter en tenant compte, d’une part, que de nombreux patients Covid-19 ont pu être hospitalisés dans des services reconvertis pour leur accueil du fait de la déprogrammation de nombreuses interventions chirurgicales, et, d’autre part, que les patients accueillis pour intervention chirurgicale étaient sans doute ceux susceptibles de présenter des facteurs de risque d’infection.
L’utilisation plus importante (en nombre de DDJ/1 000 JH) d’antibiotiques dits critiques, comme les carbapénèmes et anti-staphylocoques résistants à la méticilline, pourrait résulter, dans un contexte de réduction d’activité, de la prise en charge de patients plus souvent atteints d’infections graves, les autres patients étant pris en charge à leur domicile ou en hospitalisation de jour. Elle ne semble pas toujours liée, d’après les données de résistance recueillies, à une progression des infections à bactéries résistantes, nécessitant le recours à ces antibiotiques.
En effet, le pourcentage de résistance à la méticilline au sein de l’espèce S. aureus était similaire en 2019 et en 2020, avec une majorité des souches isolées de prélèvements urinaires et de prélèvements de pus profond et de séreuses 13.
La résistance à la méticilline chez S. aureus isolé d’infections invasives est en diminution constante depuis le début des années 2000, la France se situant en 2019 sous la moyenne européenne 14.
Dans les ES, tous prélèvements confondus, la DI globale des prélèvements positifs à SARM a été divisée par quatre entre 2003 et 2019 puis s’est stabilisée ces deux dernières années 13,15.
La DI la plus importante était observée en réanimation, en diminution par rapport à 2019. Si le risque de résistance bactérienne en secteur de réanimation est bien connu, il faut souligner que près de 20% des souches de SARM étudiées dans cette surveillance en 2020 provenaient de prélèvements de patients hospitalisés en secteurs de SSR et SLD, secteurs d’activité où la résistance à la méticilline au sein de l’espèce était la plus importante, respectivement 27,2% et 47,3%. Ce constat, en lien sans doute avec la fréquence élevée des SARM dans les prélèvements urinaires, incite à la vigilance concernant la prévention et la prise en charge des infections urinaires dans ces secteurs.
Le pourcentage d’EBLSE était stable entre 2019 et 2020. Les trois espèces bactériennes E. coli, K. pneumoniae et E. cloacae complex représentaient plus de 90% des EBLSE analysées. La répartition des espèces était semblable avec près des deux-tiers d’EBLSE isolées de prélèvements urinaires. Les urines représentent ainsi un risque important de dissémination en cas de défaillance dans les mesures de prévention. Les hémocultures constituaient la deuxième source d’EBLSE. La production d’une BLSE était la plus fréquente parmi les souches isolées sur dispositif intravasculaire (DIV), en cohérence avec les données de la surveillance des bactériémies associées aux soins qui retrouvait 22,2% de résistance aux céphalosporines de troisième génération dans les bactériémies à entérobactéries associées à un cathéter 16. Ces données illustrent l’intérêt de prévenir les infections sur DIV.
La DI des prélèvements positifs à EBLSE montre une évolution inverse à celles des prélèvements positifs à SARM. En effet, depuis 2011, elle est supérieure à celle des prélèvements positifs à SARM ; en 2020 les infections à EBLSE étaient trois fois plus fréquentes que les infections à SARM.
En 2020, la densité globale des EBLSE était supérieure à la DI des EBLSE en 2019, alors qu’une tendance à la diminution de la DI des EBLSE avait été observée entre 2017 et 2019.
De même, la densité d’incidence des entérobactéries productrices de carbapénémases était plus élevée en 2020 (0,013 prélèvements positifs à EPC pour 1 000 JH contre 0,010 en 2019). La densité plus élevée d’infection à EBLSE et EPC pourrait être liée aux caractéristiques des patients pris en charge (séjours prolongés, notamment en réanimation, traitements par corticoïdes 17) et à la densité d’utilisation plus élevée en 2020 d’antibiotiques à large spectre. Certains auteurs ont en effet décrit que la mise en place de mesures de prévention de la transmission croisée du SARS-CoV2 n’avait pas toujours permis de réduire la fréquence des bactéries résistantes aux antibiotiques ; des épidémies ont même été décrites 18,19.
Conclusion
Malgré la poursuite de la crise sanitaire en 2021, les ES se sont mobilisés pour participer à la surveillance nationale Spares, permettant d’obtenir des informations utiles pour identifier les priorités d’action et évaluer l’impact de la pandémie de Covid-19. Les données de résistance bactérienne en 2020 étaient dans la continuité des tendances observées en 2018 et 2019, avec des proportions plus faibles de SARM et d’EBLSE. L’incidence plus élevée d’infections à EBLSE et à EPC, dans un contexte d’activité hospitalière en 2020 très différent de celui des années précédentes, incite à la vigilance et au renforcement des mesures de prévention de la transmission croisée. La consommation plus importante d’antibiotiques à large spectre en 2020 résulte sans doute en partie de l’utilisation d’antibiotiques en traitement probabiliste pour de nombreux patients atteints de Covid-19 mais non d’infection bactérienne, et souligne l’importance de préserver les capacités de conseils et de maîtrise du bon usage des antibiotiques en période de crise 20,21. Enfin, l’effet à moyen terme de la pression de sélection liée aux macrolides, C3G-C4G et anti-SRM reste à explorer, en tenant compte des pratiques de prévention de la transmission croisée 22.
La mission Spares permet à chaque ES d’analyser ses données, d’identifier les pistes d’amélioration en tenant compte des évolutions d’activité, des données d’évaluations pratique et des nouvelles recommandations. En complément, des outils d’évaluation des pratiques de prévention de la transmission croisée sont régulièrement proposés, en coordination avec les autres missions nationales. Pour mieux répondre aux attentes des professionnels de santé et des autorités sanitaires, l’outil de la surveillance Spares sera modernisé afin de faciliter encore la surveillance à partir des logiciels métiers et poursuivre la production de données utiles pour le pilotage des actions de lutte contre l’antibiorésistance.
Remerciements
Remerciements à tous les professionnels des établissements ayant participé à la surveillance.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.
Références
EN
2015/ 202 du 15 juin 2015 relative au programme national d’actions de prévention des infections associées aux soins (Propias) 2015. Paris: Ministère des affaires sociales, de la santé et des droits des femmes; 2015. 92 p. http://circulaire.legifrance.gouv.fr/pdf/2015/06/cir_39781.pdf
feuille_de_route_antibioresistance_nov_2016.pdf
publiquefrance.fr/maladies-et-traumatismes/infections-associees-aux-soins-et-resistance-aux-antibiotiques/resistance-aux-antibiotiques/documents/enquetes-etudes/surveillance-de-la-consommation-des-antibiotiques-et-des-resistances-bacteriennes-en-etablissement-de-sante.-mission-spares-resultats-2019
documents/surveillance-antimicrobial-resistance-Europe-2019.pdf




