Caractéristiques et évolution des souches cliniques d’entérocoques résistantes aux glycopeptides et/ou au linézolide isolées en France, 2006-2020
// Characteristics and evolution of vancomycin– and/or linezolid-resistant enterococci clinical isolates in France, 2006-2020
Résumé
Introduction –
De nombreuses épidémies impliquant des souches d’entérocoques résistantes aux glycopeptides (ERG) ont été rapportées en France et dans le monde. De plus, l’émergence de souches d’entérocoques résistantes au linézolide (ERL) a récemment été rapportée. L’objectif de ce travail est de décrire les principales caractéristiques des souches d’ERG et d’ERL isolées en France et reçues au Centre national de référence de la Résistance aux antibiotiques entre 2006 et 2020.
Méthode –
Toutes les souches reçues ont été caractérisées phénotypiquement (MALDI-TOF, antibiogramme, CMI) et génotypiquement (qPCR, WGS). Le typage et la comparaison des souches d’ERG ont été réalisés avec différentes techniques au cours du temps (électrophorèse en champ pulsé, rep-PCR, analyse génomique comparative ou spectroscopie infrarouge à transformée de Fourier).
Résultats –
Sur les 6 311 souches d’ERG reçues sur la période 2006-2020, une très grande majorité appartenait à l’espèce E. faecium (91,8-98,3%), suivie par E. faecalis (0,8-7,9%). Le gène vanA était majoritaire (74,9%), suivi du gène vanB (23,8%). Une grande majorité (>95%) des souches d’E. faecium appartenait au complexe clonal (CC) 17. Depuis 2017, il a été observé une augmentation significative des ERL liée à la diffusion dans certaines régions de souches épidémiques présentant une résistance chromosomique, mais aussi à l’acquisition de gènes plasmidiques (notamment optrA et poxtA) par des souches non clonales. Par typage moléculaire, il a été démontré que de nombreux clones d’ERG (majoritairement E. faecium) étaient sporadiques, tandis que certains clones hyper-épidémiques (isolés chez au moins 5 patients) ont été détectés dans plusieurs établissements/villes différents avec une diffusion locorégionale.
Conclusion –
La majorité des souches d’ERG circulant en France sont des souches d’E. faecium adaptées à l’environnement hospitalier (CC17) et porteuses de l’opéron vanA. Il y a aussi l’émergence de souches d’ERL qui doit être surveillée étroitement.
Abstract
Introduction –
Many epidemic outbreaks involving vancomycin-resistant enterococci (VRE) have been reported in France and around the world. In addition, the emergence of linezolid-resistant enterococci (LRE) has recently been reported. This study aims to describe the main characteristics of VRE and LRE human isolates collected in France and received by the National Reference Centre (CNR) for Antimicrobial Resistance between 2006 and 2020.
Method –
All strains received were characterized phenotypically (MALDI-TOF, antibiogram, MIC) and genotypically (qPCR, WGS). Typing and comparison between VRE isolates was performed using a succession of different techniques (pulsed-field gel electrophoresis, rep-PCR, comparative genomic analysis, Fourier transform infrared spectroscopy).
Results –
Out of 6,311 VRE clinical isolates received between 2006 and 2020, a large majority belonged to the species E. faecium (91.8-98.3%), followed by E. faecalis (0.8-7.9%). The main gene found was vanA (74.9%), followed by vanB (23.8%). A large majority (>95%) of E. faecium isolates belonged to the clonal complex (CC) 17. Since 2017, a significant increase in LRE has been observed in association with certain regional outbreaks of epidemic strains that exhibit a chromosome-encoded resistance, but also in association with the acquisition of plasmid-mediated genes (particularly optrA and poxtA) by non-clonally-related strains. The molecular typing demonstrated that numerous VRE clones (mainly E. faecium) were sporadic whereas certain hyperepidemic clones (isolated in at least 5 patients) were detected in several hospitals/cities with regional diffusion.
Conclusion –
The majority of human VRE isolates circulating in France are hospital-adapted E. faecium strains (CC17) harboring the vanA operon. There is also an emergence of LRE isolates, which must be closely monitored.
Introduction
Les entérocoques sont devenus une cause majeure d’infections acquises à l’hôpital (5-15%) et de nombreuses épidémies impliquant des souches d’entérocoques résistantes aux glycopeptides (ERG) ont été rapportées 1,2. Aux États-Unis, près de 80% des isolats cliniques d’Enterococcus faecium sont résistants à la vancomycine tandis que la prévalence de ces souches en Europe varie significativement d’un pays à l’autre, allant de moins de 1% (France) à plus de 45% en 2019 (Chypre, Grèce) 3,4. Chez les entérocoques, la résistance aux glycopeptides est due à l’acquisition d’opérons van codant pour des enzymes permettant la synthèse de précurseurs du peptidoglycane de faible affinité pour ces antibiotiques et prévenant la formation des précurseurs naturels 5. À l’échelle mondiale, les opérons vanA et vanB sont de loin les plus fréquents parmi les souches cliniques d’ERG 6. Le succès épidémiologique des souches d’ERG chez E. faecium est principalement dû à la dissémination internationale d’un complexe clonal particulier, appelé CC17, comprenant des souches cliniques caractérisées par une résistance de haut niveau à l’ampicilline et aux fluoroquinolones, la détection fréquente de gènes de virulence (esp, hyl) et la présence d’une séquence d’insertion spécifique (IS16) 7,8. Plus récemment, il a été proposé que ce CC17 fasse partie d’une lignée génétique (clade A1) comprenant des souches humaines adaptées à l’environnement hospitalier ayant émergé d’une lignée génétique (clade A2) associée aux animaux après l’introduction des antibiotiques, et qui diffère des souches humaines commensales (clade B) 9. Depuis quelques années, des souches d’entérocoques résistantes au linézolide (ERL) sont de plus en plus rapportées en relation avec la diffusion de gènes transférables (cfr-like, optrA et poxtA) portés par des plasmides 10,11.
Cet article décrit les caractéristiques phénotypiques et génotypiques des souches d’ERG et d’ERL isolées en France et reçues au Centre national de référence (CNR) de la Résistance aux antibiotiques entre 2006 et 2020.
Matériel-Méthodes
Les souches reçues au CNR entre 2006 et 2020 ont toutes été caractérisées d’un point de vue phénotypique et génotypique. L’identification des espèces bactériennes a été réalisée par spectrométrie de masse MALDI-TOF (MicroflexTM, Bruker Daltonics) et par séquençage des gènes sodA ou rrs (ARNr 16S) si nécessaire. L’évaluation de la sensibilité in vitro aux antibiotiques (ampicilline, gentamicine, érythromycine, clindamycine, quinupristine-dalfopristine, vancomycine, téicoplanine, norfloxacine, lévofloxacine, linézolide, cotrimoxazole et chloramphénicol) a été réalisée par la méthode des disques sur milieu gélosé selon les recommandations du CA-SFM/EUCAST (1). Depuis 2017, les CMI (concentration minimale inhibitrice) de la vancomycine, de la téicoplanine, de la daptomycine, de la tigécycline, du linézolide, du tédizolide, de la dalbavancine, de la télavancine et de l’oritavancine sont déterminées par la méthode Sensititre (Thermo Fisher Scientific Inc.).
L’identification des gènes de résistance aux glycopeptides les plus fréquents (vanA, vanB, vanC1, vanC2/C3 et vanD) est réalisée dans un premier temps par qPCR. En cas de résultat négatif, les gènes les plus rares (vanE, vanG, vanL, vanM et vanN) sont recherchés secondairement par PCR classique. La détection des gènes de résistance au linézolide (cfr-like, optrA et poxtA) est également réalisée par PCR en temps réel. Le gène ptsD, potentiellement impliqué dans le pouvoir de diffusion des souches d’E. faecium, est recherché par PCR en temps réel ainsi que la séquence d’insertion IS16, spécifique du CC17.
Le typage et la comparaison des souches d’ERG ont été réalisés avec différentes techniques selon la période : électrophorèse en champ pulsé (2006-2012 et 2017-2019), rep-PCR (Diversilab®, bioMérieux) (2012-2016), analyse génomique comparative par séquençage entier du génome (WGS pour Whole Genome Sequencing) (depuis 2019) et spectroscopie infrarouge à transformée de Fourier (IRTF) (IR BiotyperTM, Bruker) (depuis 2020). Toutes ces techniques avaient des performances différentes qui n’ont pas été comparées de façon systématique. Par WGS, il a aussi été possible de détecter les gènes de virulence et de résistance aux antibiotiques et de déterminer le ’Sequence Type’ (ST) par approche MLST (Multi-Locus Sequence Typing) in silico.
Résultats
Après un pic en 2008, le nombre des souches d’ERG reçues et analysées au CNR s’était stabilisé entre 2009 et 2014 (avec une moyenne de 300 à 350 souches par an) puis a fortement augmenté entre 2015 et 2019 (x 3,1) (figure 1A). Sur les 6 311 souches d’ERG reçues pour expertise sur la période 2006-2020, une très grande majorité appartient à l’espèce E. faecium (de 91,8 à 98,3%), suivie par E. faecalis (de 0,8 à 7,9%) et les espèces plus rares (<2%) comme E. avium, E. casseliflavus, E. durans, E. gallinarum, E. gilvus, E. hirae et E. raffinosus (figure 1B, tableau). Ces souches ont principalement été isolées d’écouvillonnages ano-rectaux ou de selles lors de dépistages (>85%) tandis que peu de souches responsables de bactériémies ont été reçues (<3%). Les souches d’ERG ont été isolées dans de nombreux types de services cliniques, dont les principaux (5 à 15% selon les années) sont les services de réanimation, de néphrologie-dialyse, d’hépato-gastro-entérologie et de médecine interne/maladies infectieuses.
Concernant les mécanismes de résistance, le gène vanA est toujours majoritaire parmi les souches d’ERG sur la période 2006-2020 (74,9%), suivi du gène vanB (23,8%) et du gène vanD (n=46, 0,9%) (figure 1C, tableau). Quelques souches sont porteuses des deux gènes vanA et vanB (n=26, 0,4%) tandis que les gènes vanG et vanN n’ont été identifiés qu’une seule fois chacun chez E. faecium (tableau).
Par détection de l’IS16, une grande majorité (>95%) des souches d’E. faecium ont pu être catégorisées comme appartenant au CC17. De la même façon, le gène ptsD, potentiellement impliqué dans le pouvoir épidémique des souches hospitalières d’E. faecium, est retrouvé chez de nombreuses souches (>90%).
Toutes les souches d’E. faecalis sont sensibles à l’ampicilline alors qu’environ un tiers d’entre elles (entre 26 et 42% selon les années) ont été catégorisées résistantes à haut niveau à la gentamicine. Parmi les souches d’E. faecium résistantes aux glycopeptides testés, la grande majorité (>96%) était résistantes à l’ampicilline, alors que la résistance de haut niveau à la gentamicine était présente chez 48 à 69% des souches selon les années, sans qu’une tendance au cours du temps ne soit observée. Chez ces deux espèces, cette résistance est due à la production de l’enzyme bi-fonctionnelle AAC(6’)-APH(2’’) dont le gène a été retrouvé par PCR ou WGS.
Avant 2017, seules quelques rares souches résistantes au linézolide (CMI de 8 à >256 mg/L) avaient été isolées (figure 1D). Depuis 2017, il est noté une augmentation inquiétante des souches d’ERL liée à la diffusion dans certaines régions de souches épidémiques présentant une résistance chromosomique (mutations de l’ARNr 23S), mais aussi à l’acquisition de gènes plasmidiques (notamment optrA et poxtA) par des souches non reliées clonalement (figure 1D). À noter que les souches d’ERL chez E. faecalis (majoritairement optrA+) sont quasi-exclusivement sensibles aux glycopeptides alors que celles chez E. faecium (le plus souvent avec des mutations de l’ARNr 23S) sont principalement des ERG de génotype vanA.
Seules quelques souches (<10) résistantes à la tigécycline (CMI de 0,5 à 2 mg/L) ont été identifiées alors que la résistance de haut niveau à la daptomycine (CMI >8 mg/L) reste exceptionnelle en France, ces souches étant plus volontiers des ERG.
Par typage moléculaire, il a été démontré que de nombreux clones d’ERG (très majoritairement appartenant à l’espèce E. faecium) sont sporadiques tandis que dans les établissements où plusieurs clones étaient rapportés, il existait généralement un clone majoritaire et plusieurs clones minoritaires. Des clones (vanA ou vanB) pouvant être considérés comme hyper-épidémiques (isolés chez ≥5 patients) ont été détectés dans plusieurs établissements/villes différents au sein d’une même région. Sur la période 2015-2020, les principales régions touchées par des épidémies à E. faecium vanA sont l’Île-de-France, les Hauts-de-France et le Grand Est. Concernant les épidémies à E. faecium vanB, ce sont les régions Grand Est et Nouvelle-Aquitaine qui ont été les plus atteintes. Sur 132 souches d’E. faecalis dont le génome a été séquencé, les principaux clones appartenaient aux ST suivants : ST16 (14%), ST40 (10%) et ST179 (8%). Les 402 souches d’E. faecium appartenaient majoritairement aux ST suivants : ST80 (42%), ST117 (17%), ST78 (7%), ST612 (6%) et ST203 (5%).
 Agrandir l'image
Agrandir l'image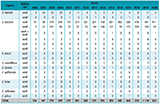 Agrandir l'image
Agrandir l'imageDiscussion
Les entérocoques sont retrouvés de façon ubiquitaire dans la nature et sont généralement considérés comme des espèces commensales. Cependant, ils sont devenus des agents pathogènes humains opportunistes majeurs, E. faecalis et E. faecium étant de loin les principales espèces responsables d’infections hospitalières 2. Les entérocoques sont capables de survivre et de croître dans des environnements hostiles comme le tube digestif d’un patient hospitalisé sous traitement antibiotique 12. Ceci est associé à une remarquable plasticité génomique qui leur permet d’acquérir de nombreux éléments génétiques mobiles par transfert horizontal 13. C’est notamment le cas pour E. faecium qui peut acquérir de nombreux gènes de résistances (ex. vanA, vanB) portés par des plasmides et des transposons 6. En effet, il y a depuis le début des années 90 la dissémination de souches d’E. faecium adaptées à l’hôpital (CC17 ou clade A1) et multirésistantes aux antibiotiques. Ceci explique la large prédominance de cette espèce parmi les souches cliniques d’ERG circulant en France et à l’étranger, comme en témoignent les nombreuses études épidémiologiques.
L’opéron de résistance vanA est majoritaire parmi les souches d’ERG, ce qui est en accord avec les études épidémiologiques conduites dans d’autres pays européens 6,13. Cependant, dans certains pays (ex. Australie), les souches vanB sont majoritaires. Les souches d’entérocoques porteuses du gène vanA sensibles phénotypiquement aux glycopeptides sont appelées VVE (Vancomycin-Variable Enterococci). Elles ont déjà été décrites dans plusieurs pays et quelques-unes (>10) ont déjà été identifiées en France. Elles doivent être signalées car elles peuvent réverter sous pression de sélection antibiotique en redevenant résistantes à la vancomycine 14.
Alors qu’aucune souche d’E. faecalis résistante à l’ampicilline n’a été décrite jusqu’à ce jour en France et en Europe, la quasi-totalité des souches d’E. faecium le sont à haut niveau. Ceci est en accord avec le fait que la grande majorité de ces souches appartiennent au CC17. En effet, les souches CC17 présentent des caractéristiques communes, dont la résistance à haut niveau aux pénicillines et aux fluoroquinolones. Environ un tiers des souches d’E. faecalis et environ deux tiers des souches d’E. faecium ont été catégorisées résistantes à haut niveau à la gentamicine, ce qui est similaire à ce qui est rapporté au niveau européen dans EARS-Net (European Antimicrobial Resistance Surveillance Network, www.ecdc.europa.eu/). Bien connue, cette résistance est due à la production de l’enzyme bi-fonctionnelle AAC(6’)-APH(2’’).
Depuis quelques années, les souches d’ERL sont de plus en plus rapportées, en partie liée à la diffusion de gènes transférables portés par des plasmides (notamment optrA et poxtA). Le gène optrA est principalement détecté chez E. faecalis (généralement sensible aux glycopeptides) et poxtA l’est chez E. faecium (majoritairement vanA) 15,16. Ceci confirme la diffusion récente des ERL en France, probablement en lien avec l’utilisation plus importante du linézolide en médecine humaine, du fait qu’il soit devenu récemment un médicament générique. De plus, les gènes de résistance plasmidique conférant également une co-résistance aux phénicolés, ils peuvent aussi être co-sélectionnés par le florfénicol utilisé en médecine animale.
La résistance à la tigécycline, due à des mutations chromosomiques dans le gène rpsJ codant pour la protéine ribosomale S10 17 est rare. Enfin, l’isolement de souches résistantes à haut niveau à la daptomycine reste exceptionnel en France. La résistance à ces deux antibiotiques est également rarement observée dans les autres pays européens 10.
L’étude épidémiologique des ERG en France a permis de mettre en évidence de nombreuses épidémies d’ampleur plus ou moins importante au sein d’un ou de plusieurs établissements (souvent dans les mêmes régions), ce qui souligne une diffusion locorégionale au cours du temps qui a déjà été décrite précédemment 18. Certains de ces clones peuvent être retrouvés pendant plusieurs années, sans que le réservoir environnemental n’ait été identifié.
La plupart des différents ST détectés en France sont aussi retrouvés au niveau international, soulignant l’importance de la dissémination de souches d’entérocoques adaptées à l’environnement hospitalier et multirésistantes aux antibiotiques 19,20.
Conclusion
La très grande majorité des souches d’ERG circulant en France sont des souches d’E. faecium adaptées à l’environnement hospitalier appartenant au clade A1 (anciennement CC17) et multirésistantes aux antibiotiques. Ces souches sont pour la plupart porteuses de l’opéron vanA, tandis que les souches vanB peuvent aussi être retrouvées. Elles ont été responsables d’épidémies dans de nombreux hôpitaux, avec des régions plus touchées que d’autres. Des clones considérés comme « hyper-épidémiques » ont aussi été détectés dans plusieurs établissements/villes différents au sein d’une même région. À côté des ERG, il y a aussi l’émergence des souches d’ERL qui portent des gènes de résistance transférables. Ce phénomène doit être surveillé étroitement à la fois en médecine humaine et vétérinaire, du fait de la co-sélection possible par des antibiotiques utilisés dans ces deux secteurs. Dans ce contexte, le rôle du CNR est majeur et il est recommandé d’y adresser toute souche suspecte d’être un ERL ainsi que toutes les souches avec des profils atypiques ou exceptionnels de résistance aux antibiotiques (comme les souches d’E. faecalis résistantes à l’ampicilline, les souches résistantes à la tigécycline ou à la daptomycine, les souches VVE).
Remerciements
Nous remercions chaleureusement les nombreux collègues qui ont adressé leurs souches au CNR et ont ainsi permis de dresser la situation des ERG et des ERL en France.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.
Références
documents/surveillance-antimicrobial-resistance-Europe-2019.pdf




