Résistance aux céphalosporines de 3e génération, aux carbapénèmes et aux fluoroquinolones des isolats urinaires de Escherichia coli en soins de ville : tendances 2017-2021 en France
// Resistance to third-generation cephalosporins, carbapenems and fluoroquinolones in Escherichia coli urinary isolates in primary care: trends in France 2017–2021
Résumé
La stratégie nationale 2022-2025 de prévention des infections et de l’antibiorésistance fixe pour l’espèce Escherichia coli en soins de ville des objectifs de résistance inférieurs à 3% pour les céphalosporines de 3e génération (C3G), à 10% pour les fluoroquinolones (FQ), et 0,5% pour les carbapénèmes d’ici 2025. Cet article décrit les évolutions des pourcentages de résistance à ces classes d’antibiotiques au sein des isolats urinaires de E. coli rapportés par les laboratoires de biologie médicale privés participant à la surveillance nationale Primo entre 2017 et 2021.
Une diminution de la résistance aux C3G a été observée entre 2017 et 2021 (3,4% vs 3,2%). Le pourcentage de souches productrices de bêta-lactamase à spectre étendu (BLSE) suivait la même tendance au niveau national (3,0% en 2017 et 2,8% en 2021), ainsi que dans la majorité des régions participantes. Le pourcentage de résistance aux FQ tendait à augmenter entre 2017 et 2021 (11,4% vs 12,7%). La résistance aux FQ était plus contrastée selon les régions en 2021 (8,6% à 19,6%), en augmentation dans 7 régions et en diminution dans 7 autres. Le nombre de souches productrices de carbapénémases isolées dans les prélèvements urinaires d’une cohorte de laboratoire a progressé de 0,59 à 0,84 pour 10 000 antibiogrammes entre 2019 et 2021.
Au regard de la stratégie nationale de prévention de l’antibiorésistance, les indicateurs de résistance sont atteints dans certaines régions, mais des efforts restent à fournir pour d’autres afin que les objectifs soient atteints d’ici 2025.
Abstract
The 2022–2025 national strategy for the prevention of infections and antibiotic resistance sets national and regional indicators for monitoring resistance of E. coli in general practice with a target threshold of 3% for third-generation cephalosporins (3GC), 10% for fluoroquinolones (FQ) and 0.5% for carbapenemase. This article presents changes in the percentages of resistance in E. coli urinary isolates, as reported by clinical laboratories participating in the national surveillance programme Primo between 2017 and 2021.
A decrease in 3GC resistance was observed between 2017 and 2021 (3.4% vs 3.2%). The percentage of extended-spectrum beta-lactamase (ESBL)-producing strains followed the same trend nationally (3.0% in 2017 and 2.8% in 2021), as well as in the majority of participating regions. The percentage of FQ resistance tended to increase between 2017 and 2021 (11.4% vs 12.7%). Resistance to FQs was more contrasted depending on the region in 2021 (8.6% to 19.6%), increasing in seven regions and decreasing in seven others. The amount of carbapenemase-producing strains isolated in urine samples increased from 0.59 to 0.84 per 10,000 antibiograms between 2019 and 2021 in a cohort of laboratories.
With regard to the national antimicrobial resistance prevention strategy, the objectives have been achieved in some regions but efforts are still needed in others to meet the objectives by 2025.
Introduction
L’antibiorésistance est une problématique majeure de santé publique. En 2019, elle aurait causé 1,27 millions de morts à travers le monde 1. Six pathogènes seraient responsables chacun de plus de 250 000 décès attribués à l’antibiorésistance, au premier rang desquels figure Escherichia coli. Pour cette espèce, les principales causes de décès dues à l’antibiorésistance étaient attribuables à la résistance aux céphalosporines de 3e génération (C3G) et aux fluoroquinolones (FQ). La diffusion pandémique des bêta-lactamases à spectre étendu (BLSE) de type CTX-M, conférant la résistance aux céphalosporines de 3e génération aux entérobactéries 2, au sein des établissements de santé 3 et dans la communauté en France 4, constitue un motif d’inquiétude depuis les années 2000. Ainsi, une augmentation de la production de bêta-lactamase à spectre étendu (BLSE) a été constatée entre 2008 et 2011 dans le réseau MedQual-Ville passant de 0,8 à 2,4% des souches urinaires communautaires de Escherichia coli 5. Cette tendance était observée de la même manière en établissements de santé pour tous les secteurs de soins.
Depuis 2018, la mission Primo pilotée par Santé publique France coordonne une surveillance nationale ciblée sur les soins de ville et les établissements d’hébergement des personnes âgées dépendantes (Ehpad). La surveillance pluriannuelle des résistances bactériennes dans ces deux secteurs de soins a pour objectif de décrire l’évolution nationale et locale des profils de résistance, d’alerter sur des phénomènes émergents, et d’évaluer l’impact des plans d’action de bon usage des antibiotiques et de maîtrise de la diffusion.
La stratégie nationale 2022-2025 de prévention des infections et de l’antibiorésistance constitue la déclinaison pour la santé humaine de la feuille de route interministérielle de 2016 pour la maîtrise de l’antibiorésistance. Des indicateurs d’impact ont été fixés avec pour objectif principal de guider le pilotage des actions nationales, régionales et locales. Les indicateurs concernant l’espèce E. coli isolée de prélèvements urinaires en soins de ville sont : une proportion de résistance aux C3G inférieure à 3% au niveau national et régional, une proportion de résistance aux FQ inférieure à 10% au niveau national et régional, et une proportion de souches productrices de carbapénémases inférieure à 0,5%.
Cet article présente les tendances 2017-2021 de ces trois indicateurs issus des données de la surveillance nationale de l’antibiorésistance Primo.
Matériels et méthodes
Cette étude rétrospective porte sur la période allant du 1er janvier 2017 au 31 décembre 2021.
La mission nationale Primo s’appuie sur la participation volontaire de biologistes libéraux responsables des plateaux techniques de microbiologie de laboratoires de biologie médicale (LBM). La transmission des données des LBM à la mission Primo est effectuée par le téléchargement de bases de données sur l’e-outil MedQual-Ville ou par envoi de fichiers bruts anonymisés par email. Les données agrégées sont consultables en accès libre en ligne (1).
Seules les données relatives aux prélèvements à visée diagnostique réalisés pour les patients en ville et pour lesquels un antibiogramme a été réalisé ont été transmises par les LBM participant à la surveillance nationale. Les données concernant les patients (âge, sexe), le type de prélèvement, les souches bactériennes (identification, antibiogramme, mécanisme de résistance : BLSE, carbapénémase) étaient collectées. Cette collecte de données a fait l’objet d’une déclaration à la Commission nationale informatique et liberté (Cnil, no 1685003-v0 datant du 04.07.2013). Après dédoublonnage, seul le premier prélèvement de chaque patient présentant le même antibiogramme a été inclus dans l’étude. Les antibiogrammes et les recherches de BLSE ou de carbapénémases étaient réalisés et expertisés selon les recommandations du Comité de l’antibiogramme de la Société française de microbiologie (CA-SFM) 6. La confirmation de la production de carbapénémase était principalement réalisée par les laboratoires par des techniques phénotypiques (immunochromatographie (n=28), colorimétrie (n=4) ou disques (n=3)), plus rarement par des techniques moléculaires (n=5). Quatre LBM déclaraient sous-traiter la confirmation à un centre hospitalier universitaire (CHU) ou au Centre national de référence (CNR). Quatre LBM n’ont pas fourni d’indication sur la technique employée.
Le pourcentage de résistance aux C3G a été calculé en rapportant le nombre de souches résistantes à au moins une des trois molécules parmi le cefotaxime, la ceftriaxone et la ceftazidime au nombre total de souches testées pour les C3G. Le pourcentage de souches productrices de BLSE a été calculé en rapportant le nombre de souches pour lequel ce mécanisme de résistance a été identifié au nombre total de souches testées pour les C3G. Le pourcentage de résistance aux FQ correspondait au rapport entre le nombre de souches résistantes à au moins une molécule parmi l’ofloxacine, la levofloxacine et la ciprofloxacine et le nombre total de souches testées pour les FQ. Le nombre de E. coli productrices de carbapénémases pour 10 000 antibiogrammes correspondait au rapport entre le nombre de souches produisant une carbapénémase et le nombre total de souches testées pour l’ertapénème.
Pour l’analyse des tendances de la résistance aux antibiotiques au niveau national, le pourcentage de E. coli producteurs de BLSE (E. coli BLSE) et le nombre de souches productrices de carbapénémases pour 10 000 antibiogrammes ont été analysés pour la cohorte des 41 regroupements de LBM ayant fourni leurs données sans discontinuer entre 2019 et 2021.
L’analyse des données a été réalisée sur le logiciel SAS®. Les analyses statistiques ont été réalisées par des tests univariés de Student ou analyse de variance selon la situation, et un p<0,05 était considéré significatif.
Résultats
Évolution nationale de la résistance aux C3G et aux fluoroquinolones
des souches urinaires de l’espèce E. coli (2017-2021)
Le nombre de LBM participant au réseau de surveillance a progressé sur la période de l’étude, passant de 623 LBM répartis dans 11 régions métropolitaines et la Martinique en 2017 à 1 564 LBM dans 15 régions (métropole, Martinique et les îles de Guadeloupe) en 2021 (figure 1).
En soins de ville, 2 167 537 antibiogrammes ont été réalisés pour l’espèce E. coli entre 2017 et 2021. Les souches urinaires représentaient 99,0% de ces antibiogrammes. Le nombre d’antibiogrammes de E. coli urinaires transmis par les laboratoires est passé de 291 183 en 2017 à 578 731 en 2021. L’âge médian des patients a augmenté sur la période, de 62 ans en 2017 à 65 ans en 2020 et 2021 (p<0,001). Le sex ratio hommes/femmes était stable à 0,19 en 2017, 0,18 en 2018, 0,19 de 2019 à 2021.
La proportion de résistance aux C3G observée dans l’espèce E. coli dans l’ensemble du réseau a diminué entre 2017 et 2021 (3,4% et 3,2% respectivement, p<0,001) (figure 2). Le taux de souches productrices de BLSE suivait la même tendance que la résistance aux C3G, avec une diminution de 3,0% à 2,8% entre 2017 et 2021 (p<0,001) (figure 2). Pour la cohorte de laboratoires participant à la surveillance entre 2019 et 2021, une diminution de la proportion de résistance aux C3G au sein de l’espèce a également été observée passant de 3,4% à 3,0% (p<0,001), de même qu’une diminution de la proportion de souches productrices de BLSE (de 3,0% à 2,7% ; p<0,001).
La proportion de résistance aux FQ dans l’espèce E. coli a augmenté entre 2017 et 2021 (11,4 à 12,7%, p<0,001), en passant par un minimum en 2018 (11,0%). Pour la cohorte de laboratoires participants, la même tendance est observée (de 11,6% à 12,2% ; p<0,001). En 2021, la proportion de la résistance aux FQ était de 10,6% pour les souches sensibles aux C3G et de 76,0% pour les souches résistantes aux C3G.
 Agrandir l'image
Agrandir l'image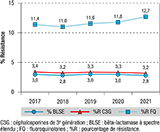 Agrandir l'image
Agrandir l'imageÉvolution nationale de la production de carbapénémases chez E. coli
au sein de la cohorte
Entre 2017 et 2021, 132 souches de E. coli productrices de carbapénémases ont été identifiées par les laboratoires participant à la surveillance, dont 128 souches urinaires (2 en 2017 vs 54 en 2021). Les carbapénémases du groupe D de la classification de Ambler (OXA-48 et apparentées) représentaient le type majoritairement identifié (80%). Les métallo-carbapénémases de type NDM étaient peu rapportées par les laboratoires entre 2017 et 2019 (n=3), mais leur proportion tendait à augmenter entre 2020 (n=2) et 2021 (n=14) représentant respectivement de 5% à 13% des enzymes identifiées. La moitié des carbapénémases étaient isolées dans 3 régions : Provence-Alpes-Côte d’Azur, Île-de-France et Hauts-de-France (par ordre décroissant de souches).
Pour la cohorte de laboratoires participants, 90 souches urinaires de E. coli productrices de carbapénémases ont été identifiées, avec une augmentation de 0,59 à 0,84 pour 10 000 antibiogrammes observée entre 2019 et 2021 (p=0,24) (figure 3).
(pour 10 000 antibiogrammes) de 2019 à 2021 (cohorte de laboratoire)
 Agrandir l'image
Agrandir l'imageÉvolutions régionales des pourcentages de résistance aux C3G
et FQ des souches urinaires de E. coli entre 2017 et 2021
Le pourcentage de résistance aux bêta-lactamines par production de BLSE des souches urinaires de E. coli variait de 1,5% en région Provence-Alpes-Côte d’Azur à 4,0% en Corse en 2017, et de 1,8% en Pays de la Loire à 4,7% en Provence-Alpes-Côte d’Azur en 2021. Une diminution du pourcentage des E. coli BLSE a été observée sur la période pour la majorité des régions participantes à l’exception de la Provence-Alpes-Côte d’Azur, l’Île-de-France et les îles de Guadeloupe où, au contraire, ce pourcentage augmentait (figure 4a).
Les pourcentages de résistance aux FQ parmi les souches de E. coli (E. coli FQ-R%) isolées des prélèvements urinaires était compris entre 8,4% en Centre-Val de Loire à 16,4% en Martinique en 2017, et entre 8,6% en Centre-Val de Loire et 19,6% en Provence-Alpes-Côte d’Azur en 2021 (figure 4b).
Le pourcentage de résistance aux FQ a diminué dans 7 régions : l'Auvergne-Rhône-Alpes, la Bourgogne-Franche-Comté, la Bretagne, la Corse, les îles de Guadeloupe, les Hauts-de-France et la Normandie (figure 4b). En région Nouvelle-Aquitaine, le pourcentage de résistance aux FQ est resté stable (12,1%). En revanche, le pourcentage de résistance aux FQ a augmenté dans les régions Centre-Val de Loire, Grand Est, Île-de-France, Martinique, Occitanie, Pays de la Loire et Provence-Alpes-Côte d’Azur.
à spectre étendu (a) et résistants aux fluoroquinolones (b) dans les prélèvements urinaires en ville
observés par les laboratoires de biologie médicale participant au système de surveillance Primo
 Agrandir l'image
Agrandir l'imageDiscussion
L’évolution du nombre de laboratoires participants à la surveillance entre 2017 et 2021 a permis d’accroître la couverture régionale du réseau, d’obtenir des données de résistance aux antibiotiques pour toutes les régions métropolitaines, et d’améliorer la robustesse des données compilées. Néanmoins, les écarts de représentativité subsistants incitent à la prudence lorsque les pourcentages régionaux de résistance aux antibiotiques sont comparés.
Les tendances observées au sein de la cohorte concernant la résistance aux céphalosporines de 3e génération (C3G) et aux fluoroquinolones (FQ) étaient superposables pour E. coli à ce qui est constaté dans l’ensemble du réseau. Cette cohorte incluant 41 des 55 groupements de LBM participant en 2021 apparaît donc représentative de ce qui est observé au niveau national.
Les données de surveillance montrent une variation depuis 2017 de la proportion de souches de E. coli résistantes aux C3G comprise entre 3,2% et 3,4%. En soins de ville, la stratégie nationale de lutte contre l’antibiorésistance fixe comme objectif d’obtenir une proportion de souches urinaires de E. coli résistantes aux C3G inférieure à 3% aux niveaux national et régional. En 2021, cet objectif n’était pas atteint au niveau national, bien qu’il le soit pour 11 régions. Pour les 4 régions se situant au-delà, l’écart est important pour certaines d’entre elles, mais une diminution encourageante de cette proportion a été constatée par rapport à 2020.
Depuis 2017, la proportion de résistance aux FQ des souches urinaires de E. coli est en lente augmentation, et au-delà de l’indicateur fixé à 10% par la stratégie nationale. L’objectif n’est atteint que pour quatre régions, mais pour trois d’entre elles une lente augmentation est observée sur les trois dernières années.
Les souches de E. coli productrices de carbapénémases étaient rarement isolées des prélèvements urinaires en soins de ville. La surveillance Primo ne s’intéressant qu’aux prélèvements à visée diagnostique, ce pourcentage n’est cependant pas révélateur du portage de ces bactéries hautement résistantes dans la communauté. Au regard de l’indicateur ciblant un pourcentage inférieur à 0,5% de souches résistantes aux carbapénèmes, l’objectif est atteint pour E. coli. Néanmoins, l’augmentation régulière du nombre de souches productrices de carbapénémases identifiée par les LBM participants incite à la vigilance pour les années à venir. Les données du centre national de référence du Kremlin-Bicêtre corroborent ce constat avec une part croissante des souches qui lui sont transmises par les laboratoires privés ces dernières années. Un point de vigilance particulier concerne l’évolution des types de carbapénémases circulant en France avec une augmentation concomitante des métallo-carbapénémases de type NDM résistantes à haut niveau à l’ensemble des bêta-lactamines et, d’autre part, des OXA-244 présentant un spectre plus étroit et une faible activité sur les carbapénémases les rendant plus difficile à détecter 7,8.
La confrontation de données de surveillance Primo aux consommations françaises d’antibiotiques en ville est nécessaire pour aider à mieux comprendre les tendances observées et les disparités régionales. Les différences de consommations inter-régionales peuvent aider à expliquer les disparités territoriales des niveaux de résistance aux antibiotiques constatés et à orienter les messages de bon usage des antibiotiques à destination des prescripteurs et des patients. Cependant, cela n’explique pas tout. En effet la résistance de l’espèce E. coli aux fluoroquinolones n’évolue pas favorablement malgré la diminution de consommation de cette famille d’antibiotique constatée en France entre 2009 et 2020, passant de 1,9 à 0,9 doses définies journalières/1 000 habitants/jour (2). Des études écologiques ont montré que la proportion de souches urinaires de E. coli productrices de BLSE pourrait être associée positivement ou négativement à des facteurs écologiques territoriaux tels que la proportion de la population de moins de 5 ans ou de plus de 65 ans, le niveau social, la suroccupation des logements, la densité des populations animales, le nombre de lits d’hospitalisation ou la surface agricole d’un territoire 9,10. Les facteurs de l’évolution de la résistance aux FQ sont à explorer, mais pourraient faire intervenir, par exemple, la persistance de ces antibiotiques dans l’environnement 11, voire l’utilisation de biocides pouvant favoriser l’hyper-expression de pompes d'efflux, ou l'acquisition d’éléments génétiques mobiles conférant une résistance croisée aux FQ 12. Une approche « One health » est désormais indispensable pour comprendre les déterminants de la diffusion de la résistance aux antibiotiques en soins de ville. Dans cette perspective, une collaboration avec les partenaires du méta-réseau Promise est en cours afin de confronter les données issues de la santé humaine (Primo, Spares …), de la santé animale et de la surveillance de l’antibiorésistance dans l’environnement. Des comparaisons génomiques des souches communautaires avec des souches d’origine hospitalières, animales ou environnementales sont également indispensables pour étudier la transmission des gènes de résistances entre les secteurs. La collaboration des biologistes participant à la surveillance Primo avec le CNR de la résistance aux antibiotiques permet de décrire les phénotypes et les génotypes de résistance en milieu communautaire et devrait se répéter pour surveiller l’émergence de nouveaux clones épidémiques.
La stabilisation de la résistance aux C3G des souches urinaires de l’espèce E. coli est une donnée encourageante, même si des efforts sont à fournir dans certaines régions. Néanmoins, la progression de la résistance aux FQ et aux carbapénèmes en soins de ville confirme l’importance de poursuivre la surveillance et la prévention de l’antibiorésistance en soins de ville, en lien avec les acteurs locaux impliqués dans le bon usage des antibiotiques (CRAtb, ARS, Cpias, Assurance maladie…). C’est dans cet objectif que, pour la prochaine mandature 2023-2028, deux CRAtb seront partie prenante de la mission Primo afin de promouvoir des actions à destination des professionnels de santé de ville, qu’ils soient prescripteurs ou non.
Remerciements
L’équipe Primo tient à remercier les biologistes impliqués dans la mission :
A. Vrain, Labouest, Ancenis ; P. Andorin, Biolaris, Laval ; J. Besson, Bioliance, Nantes ; F. Maillet, Bioloire, Nantes ;
G. De Gastines, Biorylis, La Roche-sur-Yon ; P.-Y. Léonard, Laborizon Maine Anjou, Le Mans ; A. Priet, Sevre Biologie, Les
Herbiers ; V. Plong, Activ’biolab, Challans ; J. Renard, Reseaubio, La Chapelle-sur-Erdre ; F. Kerdavid, Alliance Anabio,
Melesse ; A.-S. Reinhard, Bioceliande, Montauban-de-Bretagne ; S. Gillard, Biolor, Lorient ; B. Guesnon, Biorance, Saint-Malo ;
B. Gestin, Labazur, Chateaulin ; H. Banctel, SBL Bio, Saint-Brieuc ; J. Lacroze, Bioarvor, Lannion ; D. Laforest, Biocentre,
Coutances ; S. Arsene, Cerballiance Normandie, Lisieux ; E. Pradier, Groupe biologique des Carmes, Caen ; D. Grisard, LBM
Flers & Condé, Flers ; F. Artur, Biocéane, Le Havre ; O. Dorson, D-Lab, Dieppe ; A. Holstein, Abo +, Tours ; B. Dubet, LBM
Dubet, Neuville-aux-Bois ; D. Bouvet, Bio Médi Qual Centre, Châteauroux ; C. Laudignon, Mlab, Orléans ; E. Jobert, Mirialis,
Annecy ; R. Gebeile, Dynabio, Lyon ; X. Fournel, Dyomedea, Lyon ; G. Deleglise, Genbio, Clermont-Ferrand ; N. Lecordier, Analysis
88, Épinal ; S. Fougnot, Atoutbio, Nancy ; E. Grandsire, Dynalab, Romilly-sur-Seine ; J.-P. Rault, Espacebio, Metz ; S. Huck,
Biogroup Est, Strasbourg ; G. Defrance, Biofutur, L’isle-Adam ; V. Vieillefond, Bioépine-Bpo-Biogroup, Levallois-Perret ;
J. Cadenet, Biovsm, Noisy-le-Grand ; L. Libier, Ax Bio Océan, Bayonne ; A. Touzalin, Bio17, Marans ; A. Allery, Bio86, Poitiers ;
H. Valade, Bioffice, Bordeaux ; G. Payro, Cerballiance-Charente, Saintes ; D. Robert, Exalab Groupe Labexa, Le Haillan ; C. Morate,
Novabio, Périgueux ; M Hipolyte, 2A2B, Porto-Vecchio ; E. Parisi, Vialle, Bastia ; J. Bayette, Labosud, Montpellier ; M.-F. Aran,
Biopole66, Perpignan ; S. Coutanson, Bioaxiome, Avignon ; A. François, Bioesterel, Mandelieu-la-Napoule ; G. Gay, Labosud
Provence, Marseille ; L. Prots, Cerballiance Côte d’Azur, Nice ; K. Decrucq, Cerballiance Hauts-de-France, Lille ; O. Duquesnoy,
Biopath, Dunkerque ; E. Mbenga, Biolab, Beaune ; A. Desjardins, Evorial, Nevers ; M.-C. Paolini, CBM25, Besançon ; P. Marchenay,
LPA18, Vesoul ; S. Millet, Medilys, Dole ; P. Kassab, Bio Pôle Antilles, Guadeloupe ; O. Menuteau, Synergibio, Guadeloupe ;
F. Nestour, Biolab Martinique, Martinique ; M.-H. Louveau De La Guigneraye, Biosanté, Martinique.
Financement
La mission Primo est financée par Santé publique France.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.
Références
Citer cet article
publiquefrance.fr




