Chronique
d'un début
de pandémie
Coordination scientifique : Jean-Claude Desenclos et Hélène Therre, Institut de veille sanitaire, Saint-Maurice, France.
- ÉDITORIAL 1/9 Grippe A(H1N1)v : L'Institut de veille sanitaire face à la pandémie The French Institute for Public Health Surveillance faces the Influenza A(H1N1)v pandemic
- PERSPECTIVE 2/9 Que nous apprennent les pandémies du passé ? What do we learn from pandemics of the past ?
- ARTICLES ORIGINAUX 3/9 Le point sur le virus de la nouvelle grippe A(H1N1)v Update on the new A(H1N1)v influenza virus
- 4/9 Cas d'infection par le nouveau virus de la grippe A(H1N1)v en France, situation au 5 juin 2009 Cases of infection with the new influenza A (H1N1)v virus in France, situation as of 5 June 2009
- 5/9 VoozaFlu : un outil au service de la surveillance de la nouvelle grippe A(H1N1)v VoozaFlu: a tool for monitoring the new influenza A(H1N1)v
- 6/9 Le point sur les paramètres épidémiologiques dans l’épidémie due au nouveau virus de la grippe A(H1N1)v Update on the epidemiological parameters in the epidemics caused by the new influenza A(H1N1)v virus.
- 7/9 Adaptation du dispositif de surveillance à la situation épidémiologique Adjusting the surveillance system to the epidemiological situation
-
8/9
Manifestations cliniques observées dans les premières séries de cas de grippe due au virus émergent Influenza
A(H1N1)v Clinical manifestations observed in the first groups of patients affected by the new influenza A(H1N1)v virus - 9/9 Grippe A(H1N1)v : naissance d’une pandémie - Bilan mondial au 5 juin 2009 Influenza A(H1N1)v: Birth of a pandemic – Global review as of 5 June 2009
 Le point sur les paramètres épidémiologiques dans l’épidémie due au nouveau virus de la grippe A(H1N1)v
Le point sur les paramètres épidémiologiques dans l’épidémie due au nouveau virus de la grippe A(H1N1)v
Dans un contexte de diffusion d’une infection émergente transmissible de personne à personne, disposer d’estimations précoces puis actualisées de certains paramètres épidémiologiques est crucial pour orienter et adapter les mesures de gestion et de contrôle de l’épidémie. Il s’agit, d’une part, de paramètres caractérisant le potentiel de dissémination de l’infection dans une population (taux de reproduction et intervalle de génération), d’autre part, de paramètres caractérisant l’impact sanitaire de cette infection (taux d’attaque, taux de complications, taux de létalité).
Potentiel de dissémination
- Le taux de reproduction est le nombre moyen de cas secondaires générés par une personne durant la période où elle est infectieuse, symptomatique ou non. Lors de l’introduction d’une infection dans une population entièrement susceptible, on parle de taux de reproduction de base (Ro). Si ce taux est inférieur à 1, chaque cas donne naissance en moyenne à moins d’un cas secondaire, le nombre de cas diminue à chaque génération et la chaîne de transmission finit par s’interrompre. Inversement, si R0 > 1, le nombre de cas s'accroît à chaque génération créant une situation épidémique.
- Dans une population présentant un certain niveau d’immunité initial, consécutif par exemple à une épidémie passée, une immunité croisée ou à une vaccination, on définit le taux de reproduction net ou effectif, (R), avec R = R0 x S, où S est la proportion initiale de sujets susceptibles à l’infection dans la population. Un moyen de stopper la diffusion au sein d’une population consiste à en vacciner une proportion Sv telle que R = R0 x Sv < 1.
- Le taux de reproduction diffère selon l’agent infectieux et dépend entre autres des caractéristiques de la population. La formule ci-dessous illustre les déterminants de R0 dans un contexte simple, pour permettre une interprétation intuitive : le nombre d’infections secondaires croît avec la durée de la phase infectieuse, la fréquence des contacts, et l’efficacité de la transmission au cours d’un contact. Pour stopper ou ralentir la diffusion d’une maladie transmissible, on peut envisager d’agir sur chacun de ces déterminants : par exemple, le port de masques, le lavage des mains avec une solution hydro-alcoolique visent à réduire p, la mise en place de mesures de réduction des contacts sociaux (isolement, quarantaine, fermeture des écoles, limitation des rassemblements, couvre-feu …) a un impact sur la valeur de c, et les traitements antiviraux peuvent contribuer à diminuer la durée de la phase infectieuse D.
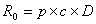
où :
- p est la probabilité de transmission de l’infection au cours d’un contact (caractérise l’efficacité d’un contact en termes de transmission)
- c (en personnes par jour) est le nombre moyen de contacts qu’un individu a par unité de temps
- D (en jours) est la durée moyenne de la phase infectieuse.
- L’intervalle de génération explore une autre dimension essentielle de la dissémination, à savoir la rapidité de survenue des cas résultant du contact avec une personne infectieuse. L'intervalle de génération est le temps moyen qui sépare l’infection d'une personne de celle de ses descendants directs dans une chaîne de transmission. L’intervalle de génération dépend du temps de latence (entre l’infection et le début de la contagiosité) et de la durée de la phase contagieuse, ainsi que de la répartition des contacts au cours du temps.
- La dynamique d’une maladie transmissible résulte de la combinaison du taux de reproduction et de l’intervalle de génération (figure). La maîtrise de la transmission d'une maladie à long intervalle de génération peut être plus facilement accessible à des mesures de type identification des cas, isolement et quarantaine. La possibilité d'une transmission avant les symptômes, comme celle de personnes contagieuses sans jamais présenter de symptômes, doit également être prise en compte pour le succès des interventions.
- Différentes méthodes d’estimation du taux de reproduction d’une maladie émergente à partir d’une courbe épidémique ont été publiées récemment [1-4] ; la plupart nécessitent la spécification complète (forme et paramètres) de la distribution de l’intervalle de génération.
Les connaissances actuelles sur les paramètres de transmission du virus de la nouvelle grippe A(H1N1)v
Une analyse détaillée des premières données disponibles a été publiée dans la revue Science en mai [5]. Ce travail fournit des estimations du taux de reproduction à partir de données épidémiologiques de l’ordre de 1,4 à 1,6, caractérisant la diffusion de la souche sur le territoire mexicain en mars-avril. Il présente une autre estimation du R0 à 1,2, basée sur une analyse génétique des souches collectées auprès de cas confirmés mexicains. Les données recueillies au cours d’une investigation détaillée d’une épidémie survenue dans un village isolé (La Gloria, Veracruz) y sont également présentées ; elles ont permis en particulier d’estimer par modélisation l’intervalle de génération à 1,9 jours (IC95% : 1,3-2,7). Il est à noter qu’une co-circulation de plusieurs virus grippaux au cours de cette épidémie à La Gloria a été documentée [6]. Une seconde publication [7], basée sur la courbe épidémique mexicaine disponible au 8 mai 2009, conduit à une borne supérieure sur le taux de reproduction fixée entre 2,2 et 3,1, selon l’hypothèse faite sur l’intervalle de génération. Ces valeurs reposent cependant sur des choix d'intervalles de génération plus longs que celui rapporté pour les données mexicaines, et ne prennent pas en compte explicitement la sous-déclaration, deux facteurs qui mènent à une surestimation. Enfin, l’analyse des cas confirmés associés à une transmission autochtone au Japon au 1er juin 2009 [8] fournit une estimation globale (i.e. tous âges confondus) du R0 à 2,3. Une modélisation structurée par âge (i.e., chez les + ou - de 20 ans), suggère une transmission plus soutenue dans cette population chez les sujets de moins de 20 ans (population dans laquelle le R0 est estimé à 2,8). Ces dernières estimations intègrent les connaissances disponibles sur l’intervalle de génération du virus A(H1N1)v : 1,9 jours, estimé à partir des données mexicaines en population générale [5], et 3,5 jours à partir de données espagnoles dans des foyers [9].
![]()
- 1
- 2
- Pascale Bernillon 1,
- Lucie Léon 1,
- Pierre-Yves Boëlle 2,3,
- Jean-Claude Desenclos 1
1/ Institut de veille sanitaire, Saint-Maurice, France
2/ Inserm U707, Paris, France
3/ Université Pierre et Marie Curie – Paris 6, UMR S 707, Paris, France
RÉFÉRENCES
 (1) Wallinga J, Teunis P. Different epidemic curves for severe acute respiratory syndrome reveal similar impacts of control measures. Am J Epidemiol. 2004; 160:509-16.
(1) Wallinga J, Teunis P. Different epidemic curves for severe acute respiratory syndrome reveal similar impacts of control measures. Am J Epidemiol. 2004; 160:509-16.
 (2) Cauchemez S, Boëlle PY, Donnelly CL, Ferguson NM, Thomas G, Lueng GM, et al. Real-time estimates in early detection of SARS. Emerg Infect Dis. 2006; 12: 110-3.
(2) Cauchemez S, Boëlle PY, Donnelly CL, Ferguson NM, Thomas G, Lueng GM, et al. Real-time estimates in early detection of SARS. Emerg Infect Dis. 2006; 12: 110-3.
 (3) Wallinga J, Teunis P. How generation intervals shape the relationship between growth rates and reproductive numbers. Proc R Soc. Ser B 2007; 274: 599-604.
(3) Wallinga J, Teunis P. How generation intervals shape the relationship between growth rates and reproductive numbers. Proc R Soc. Ser B 2007; 274: 599-604.
 (4) Roberts MG, Heesterbeek JA. Model-consistent estimation of the basic reproduction number from the incidence of an emerging infection. J Math Biol. 2007; 55(5-6): 803-16.
(4) Roberts MG, Heesterbeek JA. Model-consistent estimation of the basic reproduction number from the incidence of an emerging infection. J Math Biol. 2007; 55(5-6): 803-16.
 (5) Fraser C, Donnelly CA, Cauchemez S, Hanage WP, Van Kerkhove MD, Hollingsworth, et al. Pandemic Potential of a Strain of Influenza A (H1N1) : Early Findings. Science. 2009 May 14. [Epub ahead of print]
(5) Fraser C, Donnelly CA, Cauchemez S, Hanage WP, Van Kerkhove MD, Hollingsworth, et al. Pandemic Potential of a Strain of Influenza A (H1N1) : Early Findings. Science. 2009 May 14. [Epub ahead of print]
 (6) Centers for Disease Control and Prevention (CDC). Update: Novel Influenza A (H1N1) virus infection – Mexico, March-May, 2009. MMWR Morb Mortal Wkly Rep. 2009 June 5;58(21):585-9.
(6) Centers for Disease Control and Prevention (CDC). Update: Novel Influenza A (H1N1) virus infection – Mexico, March-May, 2009. MMWR Morb Mortal Wkly Rep. 2009 June 5;58(21):585-9.
 (7) Boëlle PY, Bernillon P, Desenclos JC. A preliminary estimation of the reproduction ratio for new influenza A(H1N1) from the outbreak in Mexico, March-April 2009. Euro Surveill. 2009;14(19):pii=19205.
(7) Boëlle PY, Bernillon P, Desenclos JC. A preliminary estimation of the reproduction ratio for new influenza A(H1N1) from the outbreak in Mexico, March-April 2009. Euro Surveill. 2009;14(19):pii=19205.
 (8) Nishiura H, Castillo-Chavez C, Safan M, Chowell G. Transmission potential of the new influenza A(H1N1) virus and its age-specificity in Japan. Euro Surveill. 2009;14(22):pii=19227.
(8) Nishiura H, Castillo-Chavez C, Safan M, Chowell G. Transmission potential of the new influenza A(H1N1) virus and its age-specificity in Japan. Euro Surveill. 2009;14(22):pii=19227.
 (9) Surveillance Group for New Influenza A(H1N1) Virus Investigation and Control in Spain. New influenza A(H1N1) virus infections in Spain, April-May 2009. Euro Surveill. 2009;14(19):pii=19209.
(9) Surveillance Group for New Influenza A(H1N1) Virus Investigation and Control in Spain. New influenza A(H1N1) virus infections in Spain, April-May 2009. Euro Surveill. 2009;14(19):pii=19209.
 (10) Ghani AC, Donnelly CA, Cox DR, Griffin JT, Fraser C, Lam TH, et al. Methods for estimating the case fatality ratio for a novel, emerging infectious disease. Am J Epidemiol. 2005; 162(5):479-86.
(10) Ghani AC, Donnelly CA, Cox DR, Griffin JT, Fraser C, Lam TH, et al. Methods for estimating the case fatality ratio for a novel, emerging infectious disease. Am J Epidemiol. 2005; 162(5):479-86.
 (11) Yip PS, Lau EH, Lam KF, Huggins RM. A chain multinomial for estimating the real-time fatality rate of a disease, with an application to severe acute respiratory syndrome. Am J Epidemiol. 2005; 161:700-6.
(11) Yip PS, Lau EH, Lam KF, Huggins RM. A chain multinomial for estimating the real-time fatality rate of a disease, with an application to severe acute respiratory syndrome. Am J Epidemiol. 2005; 161:700-6.
 (12) Lipsitch M, Riley S, Cauchemez S, Ghani AC, Ferguson NM. Managing and Reducing Uncertainty in an Emerging Influenza Pandemic. N Engl J Med. 2009 May 28. [Epub ahead of print]
(12) Lipsitch M, Riley S, Cauchemez S, Ghani AC, Ferguson NM. Managing and Reducing Uncertainty in an Emerging Influenza Pandemic. N Engl J Med. 2009 May 28. [Epub ahead of print]
 (13) Centers for Disease Control and Prevention (CDC). Update: novel influenza A (H1N1) virus infections - worldwide, May 6, 2009. MMWR Morb Mortal Wkly Rep. 2009 May 8;58(17):453-8.
(13) Centers for Disease Control and Prevention (CDC). Update: novel influenza A (H1N1) virus infections - worldwide, May 6, 2009. MMWR Morb Mortal Wkly Rep. 2009 May 8;58(17):453-8.