Campagne de dépistage universel « Montpellier sans hépatite C » 2019 : description et évaluation
// “Montpellier sans hépatite C” universal screening campaign: Description and assessment
* Comité technique Montpellier sans VHC : Association SOS Hépatites Occitanie, Mairie de Montpellier, Coordination hépatites (Cohep) Occitanie.
Résumé
Introduction –
Un programme innovant rassemblant de nombreux partenaires (hospitaliers, libéraux, associatifs et institutionnels) a été élaboré afin de mettre en place, dans différents sites d’un même laboratoire de biologie médicale (LBM), une campagne de dépistage universel des personnes pouvant avoir été infectées par le virus de l’hépatite C (VHC) dans la ville de Montpellier pendant trois mois, de mi-septembre à mi-décembre 2019.
L’objectif de cet article est de présenter la campagne de dépistage et de fournir des éléments quantitatifs d’évaluation de cette campagne.
Méthodes –
La population d’étude était : i) Les personnes se présentant directement pendant la période définie au LBM de Montpellier, sans ordonnance et sans frais ; ii) les personnes pour lesquelles une exposition à risque d’infection par le VHC avait été identifiée par un médecin qui avait alors prescrit un dépistage. Un questionnaire identifiant les facteurs de risques était proposé au moment du prélèvement.
Résultats –
Sur les 13 semaines de dépistage, 10 143 tests de dépistage ont été réalisés, dont 8,7% chez des patients sans ordonnance. Une augmentation de 22% du nombre de tests réalisés par rapport à la même période de 2018 a été notée. Le taux de séropositivité était de 0,89% (90 sérologies positives), contre 1,12% (N=95) en 2018. Au total, 9 patients avaient un ARN positif et ont été pris en charge. Le taux de réponse au questionnaire était de 57% et les principaux facteurs de risque étaient des actes divers à risque (33%) et des actes médicaux (33%).
Conclusion –
Ce modèle de campagne de dépistage est innovant et pourrait être reproduit pour d’autres thématiques. Bien que l’évaluation n’ait pas pu mettre en évidence une amélioration en termes de détection du nombre de nouveaux cas, elle a permis de montrer l’intérêt d’une collaboration multipartenariale associant dépistage et prise en charge des patients.
Abstract
Introduction –
An innovative program bringing together many partners (hospital, private, associative, and institutional) has been developed in order to set up a universal screening campaign for HCV-infected persons in the city of Montpellier for 3 months, from mid-September to mid-December 2019, in different sites of the same medical biology laboratory (MBL).
The objective of this article is to present the screening campaign, and to provide quantitative elements for the evaluation of this campaign.
Methods –
The study population was: i) Individuals presenting directly to the MBL in Montpellier during the defined period without a prescription, the test was free of charge; ii) Individuals for whom an exposure at risk of HCV infection had been identified by a physician who had then prescribed screening. A questionnaire identifying risk factors was proposed at the time of collection.
Results –
Over the 13 weeks of screening, 10,143 screening tests were performed, 8.7% of which were performed in patients without prescription. There was a 22% increase in the number of tests performed compared to the same period in 2018. The seropositivity rate was 0.89% (90 positive serologies) compared to 1.12% (N=95) in 2018. A total of 9 patients were RNA positive and were refered for medical care. The response rate to the questionnaire was 57% and the main risk factors reported were various risk acts (33%) and medical acts (33%).
Conclusion –
This screening campaign model is innovative and could be implemented concerning other diseases. Although this evaluation had not shown a higher number of new cases detected compared to 2018, it has shown the benefits of multi-partner collaborations combining both screening and patient management.
Introduction / contexte
Avec 71 millions de personnes présentant une infection chronique par le virus de l’hépatite C (VHC) dans le monde, 1,75 millions de personnes nouvellement infectées chaque année et, pour 80% d’entre elles, une évolution vers une infection chronique pouvant entraîner des complications sévères (cirrhose, cancer du foie), l’hépatite C est un enjeu de santé publique majeur 1. Depuis 2014, les antiviraux d’action directe (AAD) permettent d’éradiquer le virus chez plus de 95% des patients traités et de réduire significativement le risque de survenue d’un cancer du foie et la mortalité (voir F. Carrat et coll. dans ce numéro du BEH) avec une très bonne tolérance. La disponibilité de ces nouveaux traitements a conduit l’Organisation mondiale de la santé (OMS) à fixer un objectif mondial d’élimination des hépatites B et C d’ici 2030 2.
La France s’est engagée à atteindre l’élimination de l’hépatite C d’ici 2025 3. La prévalence de l’infection chronique par le VHC chez les personnes résidant en France métropolitaine, âgées de 18 à 75 ans, a été estimée à 0,30% (intervalle de confiance à 95%, IC95%: [0,13-0,70]) en 2016 4, tendant à diminuer depuis 2011 (0,42% [0,33-0,53]) et 2004 (0,53% [0,40-0,70]) 5. Les usagers de drogues par voie intraveineuse constituent la population la plus touchée, avec une prévalence de l’infection chronique estimée à 30% en 2011-2013 6, et la plus à risque d’être contaminée, avec une incidence estimée à 11,2 [9,0-19,0] pour 100 personne-années pour les injecteurs au cours du dernier mois en 2011 7. Les personnes ayant des antécédents de transfusion avant 1992 (année de mise en place du dépistage systématique des dons de sang) et celles ayant des antécédents d’actes médicaux invasifs peuvent également être à risque d’avoir été contaminées par le passé. Le risque de transmission sexuelle, considéré comme extrêmement faible chez les couples hétérosexuels stables, peut être augmenté en cas de rapports sexuels traumatiques, en particulier chez les hommes ayant des rapports sexuels avec les hommes (HSH), notamment chez ceux atteints par le virus de l’immunodéficience humaine (VIH), possiblement en lien avec un contexte de consommation de produits psychoactifs 8.
Avec 58 943 patients ayant initié un traitement par AAD en France métropolitaine entre 2014 et 2017, le recours à ces antiviraux a été très important, notamment avec l’accès universel pour l’ensemble des patients depuis 2016 9. Le diagnostic des personnes infectées méconnaissant leur infection constitue aujourd’hui un enjeu majeur pour atteindre l’objectif d’élimination. La proportion de personnes infectées méconnaissant leur statut a été estimée à 19,4% en population générale métropolitaine en 2016 4 et à 39% chez les usagers de drogues ayant injecté au cours de la vie en 2011-2013 6. Afin d’atteindre ces personnes, dont une partie peuvent ne pas avoir conscience d’avoir été exposées au VHC, des experts, l’Association française pour l’étude du foie (Afef) 10 et des associations de patients (dont SOS Hépatites et la campagne « Du bruit contre l’hépatite C ») 11 préconisent, depuis plusieurs années, la mise en place d’un dépistage universel de l’hépatite C, combiné à ceux du virus de l’hépatite B (VHB) et du VIH, en complément du renforcement du dépistage ciblé. Cette préconisation s’appuie sur les résultats d’une modélisation suggérant que le dépistage universel serait coût-efficace 12.
Cependant, dans leur rapport d’évaluation de l’efficience des stratégies de dépistage, les experts de la Haute Autorité de santé (HAS) concluent qu’un dépistage universel élargi à la population générale ne serait pas efficient en France et qu’il faudrait plutôt renforcer le dépistage dans les populations les plus à risque de contamination 13.
C’est dans ce contexte qu’une campagne de dépistage universel de l’hépatite C « Montpellier sans hépatite C » a été mise en place à l’automne 2019 à l’initiative de l’association SOS Hépatites Occitanie, de la Mairie de Montpellier et de la Coordination hépatites (Cohep) Occitanie qui développe des actions de lutte contre les hépatites B et C (information, prévention, dépistage, prise en charge et accompagnement).
L’objectif de cette campagne était de lutter contre la persistance d’une circulation virale du VHC dans une population présentant des facteurs de risque méconnus par ces personnes et de sensibiliser les médecins et autres professionnels de santé ainsi que la population générale sur le dépistage du VHC. Il s’agissait de faire la promotion d’un dépistage novateur, ouvert et accessible à la population montpelliéraine afin de dépister les personnes porteuses du VHC et de les orienter vers le traitement.
Santé publique France - Occitanie a été associée à ce projet pour fournir des éléments d’évaluation de cette campagne. Cette évaluation visait à quantifier le recours au dépistage lors de cette campagne de dépistage généralisé de la population, le nombre de découvertes de positivité VHC et à décrire les caractéristiques des personnes dépistées et des personnes positives pour les anticorps anti-VHC (rapport à paraître).
L’objectif de cet article est de présenter la campagne de dépistage et de fournir des éléments quantitatifs d’évaluation de cette campagne.
Matériel et méthodes
Description de la campagne
La campagne s’est déroulée du 16 septembre au 16 décembre 2019, dans différents sites d’un même laboratoire de biologie médicale (LBM) (entité juridique multisite). Ces sites couvraient tous les quartiers de la ville de Montpellier et représentaient 81% des sites LBM du secteur privé de la ville (incluant quatre sites rattachés à des cliniques privées).
La campagne a également impliqué un ensemble de partenaires : le Centre hospitalo-universitaire, les cabinets libéraux de gastroentérologie de Montpellier, les Unions régionales des professionnels de santé (URPS), médecins, biologistes et pharmaciens, la Caisse primaire d’assurance maladie (CPAM), la Mutualité sociale agricole (MSA) et la Sécurité sociale des indépendants de l’Hérault, l’Agence régionale de santé (ARS) Occitanie et Santé publique France.
La campagne de dépistage a été précédée d’une campagne de communication à partir du 14 août 2019 : affichage sur panneaux publicitaires, diffusion via les réseaux sociaux, site Internet dédié, affiches et flyers, médias.
La population cible de la campagne était : i) les personnes se présentant directement pendant la période définie au LBM de Montpellier pour se faire dépister sans rendez-vous, sans ordonnance et sans frais ; ii) les personnes pour lesquelles une suspicion ou un risque d’exposition à l’infection par le VHC avait été identifiée par un médecin qui avait alors prescrit un dépistage du VHC.
Le financement des tests des personnes sans ordonnance a été pris en charge par l’ARS Occitanie qui a souhaité soutenir cette démarche innovante visant à favoriser le dépistage et la prise en charge des personnes infectées par le VHC.
Déroulement du dépistage et recueil de données pour l’évaluation
Pour toute personne se présentant au LBM pour un dépistage du VHC (ou éligible au dépistage si elle venait sans ordonnance), des données sociodémographiques (âge, sexe, couverture sociale et assurances complémentaires), médicales (antécédents et actes de dépistage antérieurs VHB, VIH, syphilis) étaient recueillies par la personne à l’accueil du LBM.
La population d’étude pour l’évaluation de la campagne était l’ensemble des personnes dépistées pour les anticorps anti-VHC, au cours de la période de la campagne, dans l’entité LBM de Montpellier et ayant accepté de participer à l’étude. Les personnes ayant réalisé un don de sang ou une sérologie VHC dans le mois précédent et celles qui présentaient une infection par le VHC connue (en cours de traitement ou pas) n’étaient pas éligibles pour l’évaluation. Ce critère d’exclusion permettait de s’assurer que les personnes dont le résultat était positif au cours de la campagne correspondaient à de nouveaux diagnostics.
L’étude était présentée et proposée aux personnes éligibles, par le préleveur. En cas d’accord de participation, un questionnaire papier était complété par le préleveur en face-à-face. Il portait sur l’existence d’expositions à risque vis-à-vis du VHC, correspondant aux recommandations de dépistage 14 : usage de drogues par voie injectable ou pernasale, acte médical (endoscopie, dialyse, intervention chirurgicale lourde, soins dentaires, accident d’exposition au sang), transfusion avant 1992, actes divers à risque (tatouage, piercing, acupuncture, mésothérapie, barbier), entourage proche porteur d’hépatite C, séjour prolongé ou soins de santé à l’étranger, rapport sexuel traumatique (avec présence de sang). Il recueillait également la connaissance par la personne de la campagne « Montpellier sans hépatite C ».
Si le résultat de la sérologie était positif, une recherche d’ARN du VHC était réalisée après demande de prescription au médecin traitant ou de la Cohep. En cas de résultat positif, un lien avec le médecin traitant, un hépato-gastroentérologue ou la Cohep était fait pour orienter le patient vers une prise en charge adaptée.
Si le patient avait un résultat négatif, des conseils de prévention lui étaient transmis en même temps que son résultat (figure 1).
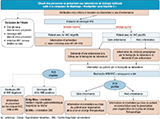 Agrandir l'image
Agrandir l'imageÉtait également proposé au patient, un dépistage d’éventuelles co-infections VIH, VHB, syphilis.
Indicateurs pour l’évaluation et analyse statistique
Les indicateurs utilisés pour fournir des éléments quantitatifs d’évaluation de la campagne étaient les suivants :
–nombre de tests de dépistage anti-VHC réalisés par le LBM multisite au cours de la campagne et nombre de personnes dépistées ;
–nombre de tests positifs et de personnes positives pour les anticorps anti-VHC, selon les critères d’inclusion dans l’évaluation ;
–taux de positivité, défini comme le rapport du nombre de tests positifs sur le nombre de tests réalisés.
Ces indicateurs ont été comparés avec ceux de la même période de l’année précédente. À cette fin, le LBM a fourni les données de dépistage pour la même période en 2018.
Les caractéristiques sociodémographiques et les expositions à risque de la population d’étude ainsi que celles des personnes positives pour les anticorps anti-VHC ont été décrites. L’analyse descriptive a été stratifiée selon l’existence ou non d’une prescription médicale pour la réalisation du test de dépistage VHC.
Les variables qualitatives des facteurs de risques influençant le dépistage ont été comparées à l’aide des tests du Chi2 (seuil de significativité du p à 0,05).
Aspects éthiques
Une note d’information transmise au patient, présentant la finalité de l’étude, les données collectées et le responsable du traitement, précisait l’absence de tout élément permettant une identification dans l’analyse des données par Santé publique France. Elle informait la personne de la possibilité d’accéder et de rectifier ses données, voire de s’opposer à leur traitement. Les données se conformaient à la méthodologie de référence MR004 (déclaration de conformité n° 2204676).
Résultats
Nombre de tests réalisés, nombre de tests positifs et taux de positivité
Sur les 13 semaines du dépistage, 10 323 tests de dépistage du VHC ont été réalisés chez 10 143 personnes s’étant présentées pour un dépistage (172 personnes ont bénéficié de plus d’1 test). Dans 8,7% des cas (N=879 tests), les personnes étaient venues au LBM sans ordonnance. Les proportions de dépistages réalisés avec ou sans ordonnance ne diffèraient pas d’une semaine sur l’autre.
Le taux de séropositivité au VHC était globalement de 0,89% (90 sérologies positives), sans différence significative entre les patients venus avec ou sans ordonnance (respectivement 0,97% vs 0,34%, p=0,072).
Par rapport à la même période en 2018, on note une augmentation de 22% du recours au dépistage au sein du LBM. Quant au taux de positivité sur cette même période de 2018, il était de 1,12% (95 sérologies positives). À noter qu’en 2018, l’ensemble des tests réalisés a été comptabilisé sans tenir compte du fait des critères d’exclusion de 2019.
Concernant les dépistages associés proposés, la majorité concernait le VIH (81,7%), le VHB (72,2%) et la syphilis (56,4%). Le taux de séropositivité le plus important était celui de la syphilis (1,4%), puis de l’hépatite B (0,6%) et du VIH (0,3%).
Caractéristiques des personnes dépistées
Le taux global de participation à l’étude sur les facteurs de risques a été de 58%. Parmi les 5 837 questionnaires complétés sur les facteurs d’exposition, 5 334 étaient exploitables. Parmi l’ensemble des participants, 41% (N=2 161) ont répondu n’avoir aucun facteur de risque à leur connaissance (31% pour les personnes venant sans ordonnance versus 20% pour celles avec ordonnance). Parmi ceux ayant signalé un ou plusieurs facteurs de risque, les risques déclarés étaient les actes divers à risque (33,5%), les actes médicaux (33,5%) et les rapports sexuels traumatiques (9,8%). Les patients sans ordonnance rapportaient davantage d’actes médicaux à risque (47,8% vs 30,9%) (tableau 1).
 Agrandir l'image
Agrandir l'imageLes femmes représentaient 60,3% des participants, la classe d’âge la plus importante était celle des 20-49 ans (70,2%) et 13% bénéficiaient de la Couverture maladie universelle (CMU). Comparées aux personnes s’étant présentées avec ordonnance, on notait une plus grande proportion de femmes (64,8% vs 59,9%, p<0,05) et de personnes âgées de 50 ans ou plus (66,6% vs 25,8%, p<0,05) parmi les personnes venues sans ordonnance (tableau 2).
 Agrandir l'image
Agrandir l'imagePersonnes séropositives
Parmi les 90 personnes séropositives au VHC, la très grande majorité était venue au laboratoire avec une ordonnance (seules 3 personnes étaient venues sans ordonnance). Comparées aux personnes testées négatives, ces 90 personnes étaient majoritairement de sexe masculin (58,9% vs 39,5%, p<0,05), et étaient plus souvent bénéficiaires de la CMU (23,3% vs 12,8%, p<0,05). On note également chez les personnes séropositives, un gradient significatif d’âge croissant, les personnes de plus de 50 ans représentant 66,7% vs 27,9% chez les séronégatifs (figure 2).
 Agrandir l'image
Agrandir l'imageParmi les 31 personnes séropositives ayant complété le questionnaire sur les facteurs de risques (soit un taux de participation de 34% chez les séropositifs), 10 ne déclaraient aucun facteur de risque. Afin de vérifier l’absence d’indication au dépistage et comprendre pourquoi ces personnes avaient eu une ordonnance, leur médecin traitant a été contacté par le LBM : en pratique, tous les patients avaient des facteurs de risques connus et 6 n’auraient pas dû être dépistés lors de cette campagne. Les principaux facteurs de risques étaient d’avoir fait usage de drogues injectables ou d’avoir un proche porteur du VHC.
La recherche d’ARN a été réalisée pour les 69 personnes séropositives pour le VHC, les autres étant perdues de vue, et 9 personnes ont eu un ARN positif. Toutes ces personnes avaient des facteurs de risques et ont été orientées pour une prise en charge médicale.
Discussion
Discussion des résultats de la campagne
Cette étude a montré une augmentation du nombre de sérologies sur la période de dépistage comparativement à la même période de l’année précédente (+22%). Cependant, le nombre de découvertes de séropositivité est inférieur en 2019 à celui de 2018 (N=90 vs N=95). Le taux de séropositivité semble avoir légèrement diminué entre les deux années. Cette diminution peut s’expliquer par un plus grand nombre de personnes dépistées en 2019, dont une partie sans facteur de risque connu. Par ailleurs, les différentes études de prévalence depuis 2004 montrent une diminution du réservoir de personnes infectées 4,5,6.
Les caractéristiques des personnes ayant participé au dépistage sans ordonnance diffèrent de celles du dépistage ciblé par le médecin traitant : il s’agit plus souvent de femmes, âgées de 50 ans ou plus. Une des explications est qu’il s’agit probablement de personnes venant au LBM pour faire d’autres examens de routine en raison de leur âge et qui ont bénéficié de la campagne de dépistage.
Les avis d’experts de la HAS préconisent un dépistage ciblé autour des personnes ayant des facteurs de risque 13. Notre étude a montré que parmi les personnes ayant répondu au questionnaire, une proportion de 40% parmi les répondants déclarait ne pas avoir de facteur de risque.
Les informations recueillies ont pu être vérifiées auprès des médecins traitants pour les 10 personnes séropositives qui avaient déclaré une absence de facteur de risque. En pratique, elles en présentaient toutes au moins un et le dépistage était donc bien ciblé par leur médecin. Le questionnaire proposé témoigne donc qu’une partie de la population ignore encore qu’elle est potentiellement exposée au VHC, ne connaissant pas son facteur de risque. La communication autour des facteurs de risque du VHC dans la population constitue une piste de réflexion pour améliorer le dépistage et la prise en charge. Parmi ces pistes, il pourrait être proposé des campagnes de sensibilisation, en population générale, aux facteurs de risques (notamment les expositions iatrogènes antérieures aux années 1990) et de déstigmatiser le regard sur la maladie et les facteurs de risque connus.
Un des intérêts de cette campagne de dépistage est également d’avoir proposé de coupler le dépistage de l’hépatite C avec un dépistage combiné VHB, VIH et syphilis en présence de facteurs de risque pour ces trois pathologies, prescrits par le médecin.
Les recommandations des experts de la HAS préconisent, au moins une fois dans la vie, un dépistage du VIH pour toute personne âgée de 15 à 70 ans lors d’un recours aux soins, en dehors de toute notion d’exposition à un risque de contamination par le VIH 15 et estiment qu’une proposition conjointe de tests de dépistage de l’infection à VHB et VHC en fonction des facteurs de risque pourrait faciliter le dépistage du VIH 15.
À notre connaissance, aucune expérimentation de dépistage universel à l’échelle d’une ville n’avait été réalisée en France ; une expérimentation de dépistage de proximité de l’hépatite C à l’aide de TROD (test rapide d’orientation diagnostique) dans des pharmacies volontaires des départements de l’Aude et des Pyrénées-Orientales est actuellement en cours. En 2015-2016, une étude longitudinale en population générale dans la ville de Tromsø en Norvège, chez des adultes âgés de 40 ans et plus, retrouvait une prévalence basse des anticorps anti-VHC (0,6% [0,5-0,7]) et une prévalence de 0,2% des patients virémiques 16. Une autre étude menée en Russie, dans la ville de Belgorod, confirme aussi une prévalence basse en population générale 17.
Forces et limites de l’évaluation de la campagne de dépistage universel
Concernant les éléments d’évaluation de la campagne de dépistage de 2019, certains atouts peuvent être soulignés.
Il s’agit en effet de la première campagne de ce genre dans une grande ville en France. Le dispositif mis en place est innovant, alliant partenariat public et privé, institutionnels et municipalité. Parmi les acteurs ayant participé réellement à la campagne, la coordination a été très efficace et dynamique et a permis un parcours de prise en charge facilité vers le médecin prescripteur (patient avec ordonnance), le service expert hépatites du CHU (patient sans ordonnance) ou le médecin du choix du patient.
Cette stratégie nouvelle « de l’aller-vers » (certains laboratoires étant allés faire la promotion du dépistage dans leur quartier) et de coordination de toute la chaine du dépistage au traitement est gage d’efficacité. Elle permet de souligner l’intérêt d’avoir accès à toutes les populations y compris celles plus marginalisées n’ayant pas de médecin traitant, du fait de la proximité et de la facilité d’accès.
La mise en place d’un recueil standardisé de données d’emblée a été facilitée par l’implication d’un LBM multisite. En effet, cette configuration a permis de mettre en place un circuit d’information simple. Il aurait sans doute été plus difficile de faire adhérer plusieurs LBM indépendants.
Concernant les limites de cette campagne, nous pouvons préciser plusieurs éléments. En premier lieu, concernant la partie de recueil par questionnaire sur les facteurs de risque, nous notons une participation partielle des personnes venues se faire dépister : 57% des personnes dépistées ont accepté de le compléter et 34% parmi les personnes séropositives. Il n’est pas possible de déterminer si cela a pu entraîner ou non un biais dans les informations recueillies, et encore moins d’en connaître le sens. Un biais de désirabilité sociale lors du remplissage du questionnaire est possible, c’est-à-dire que, face à la personne qui les interrogeait et devait ensuite faire le prélèvement, il est possible que le patient ait voulu se montrer sous un jour favorable. Par exemple, une hypothèse serait que le patient n’ait pas souhaité mentionner un passé de toxicomanie. Un autre biais possible est le biais de mémorisation des facteurs de risque par les participants : dans la liste des facteurs de risque, des soins anciens ont pu ne pas revenir en tête au moment du remplissage. Ces biais expliquent que près de 40% des répondants ont déclaré ne pas avoir de facteur de risque. En raison de cette absence de réponse au questionnaire ou de réponses biaisées à celui-ci, les résultats du dépistage sont difficilement interprétables en termes de facteurs de risques.
Même si nos résultats de la campagne de dépistage ne semblent pas retrouver de nouveaux cas hors critères de dépistage de la HAS (et qui seraient donc passé à côté du dépistage en l’absence de cette campagne), la campagne a permis une augmentation du dépistage et de la coordination entre les divers acteurs de la lutte contre l’hépatite C.
Conclusion
La démarche mise en place a permis aux différents acteurs d’organiser cette campagne de dépistage menée à Montpellier en population générale et d’orienter les personnes porteuses du virus vers un parcours de soins coordonné, avec un dépistage fluide et simplifié. Ceci permet de répondre à l’objectif d’éliminer les hépatites virales d’ici 2030 fixé par l’OMS et encourage toutes les stratégies innovantes pour améliorer l’accès à leur dépistage 8. Le modèle de campagne de dépistage s’appuyant sur des LBM de proximité pourrait facilement être transposable à d’autres thématiques.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.
Remerciements
Clothilde Hachin, Santé publique France, Saint-Maurice.
L’ensemble des personnes des membres de copilotage 34 : Marie Claude Wey pour le réseau Coordination hépatite, Françoise Imbert
pour l’association SOS Hépatites Occitanie, Caroline Navarre et Olivier Dufour pour la mairie de Montpellier.
L’ensemble des personnels du LBM multisites pour leur implication.
L’Agence régionale de santé d’Occitanie et les agents impliqués dans la démarche.
Références
fr/news-room/fact-sheets/detail/hepatitis-c
santepubliquefrance.fr/beh/2019/24-25/2019_24-25_1.html
2018_11_1.html
fr/beh/2019/24-25/2019_24-25_5.html
upload/docs/application/pdf/2019-09/evaluation_economique_evaluation_des_strategies_de_depistage_des_
personnes_infectees_par_le_vhc_volet_1.pdf
has-sante.fr/upload/docs/application/pdf/vhc_rapport_final_formate-_recommandations.pdf
strategie_depistage_vih_-_synthese_reco.pdf




