Impact clinique du traitement de l’hépatite C chronique par les antiviraux d’action directe. Résultats de la cohorte prospective ANRS CO 22-Hepather*
// Clinical outcomes in patients with chronic hepatitis C after direct-acting antiviral treatment: A prospective ANRS CO-22 Hepather cohort study*
* Cet article est une adaptation de l’article suivant, paru dans le Lancet : Carrat F, Fontaine H, Dorival C, Simony M, Diallo A, Hezode C, et al. Clinical outcomes in patients with chronic hepatitis C after direct-acting antiviral treatment: A prospective cohort study. Lancet 2019;393:1453-64.
Résumé
Introduction –
L’objectif de cette étude était de comparer la mortalité, l’incidence du carcinome hépatocellulaire (CHC) et de la cirrhose décompensée (CD) chez les patients traités par rapport aux non traités par antiviraux d’action directe (AAD) dans la cohorte prospective française Hepather.
Patients et méthodes –
Des adultes atteints d’une infection chronique par le VHC, sans co-infection virale B, ni antécédent de CD, CHC, transplantation hépatique ou de traitement avec inhibiteurs de protéase de 1ère génération, ont été inclus entre août 2012 et décembre 2015. L’association entre AAD et survenue des évènements a été analysée à l’aide de modèles de Cox à risques proportionnels temps-dépendants.
Résultats –
9 895 patients ont été inclus : 7 344 traités et 2 551 non traités (suivi médian de 33 mois [IQR: 24-41]). Le décès, le CHC et la CD ont été observés chez 218 (129 traités, 89 non), 258 (187 traités, 71 non) et 106 (74 traités, 32 non) patients respectivement. L’exposition aux AAD était associée à un risque de CHC et de CD en modèle de Cox non ajusté (HR : 2,77) et (HR : 3,83), respectivement. Après ajustement, l’exposition aux AAD était associée à une diminution de la mortalité globale (HR : 0,48 ; IC95%: [0,33-0,70]), de CHC (HR : 0,66 [0,46-0,93]) et n’était plus associée à la CD (HR : 1,14 [0,57-2,27]).
Conclusion –
Chez les patients ayant une infection chronique par le VHC, le traitement par AAD est associé à un risque réduit de mortalité et de CHC.
Abstract
Background –
The objective of the study was to compare the incidence of outcomes rates of death, hepatocellular carcinoma (HCC) and decompensated cirrhosis between patients treated or not with direct antivirals (DAA) in the French ANRS CO22 Hepather cohort.
Methods –
Between August 2012 and December 2015, adult patients with chronic HCV infection without HBV coinfection, history of decompensated cirrhosis, HCC, liver transplantation or treatment with first generation protease inhibitors were included. The association between DAA and outcomes was quantified using time-dependent Cox proportional hazards models.
Findings –
9,895 were included: 7,344 treated and 2,551 not treated (median follow-up of 33 months [IQR: 24-41]). Death, HCC and decompensated cirrhosis were reported in 218 (129 treated, 89 not treated), 258 (187 treated, 71 not treated) and 106 (74 treated, 32 not treated) patients, respectively. Exposure to DAA treatment was associated with an increased risk of HCC and decompensated cirrhosis on the unadjusted Cox model (Hazard Ratio (HR)=2.77 and 3.83, respectively. On adjusted multivariable analysis, exposure to DAA was associated with a decrease in all cause-mortality (HR=0.48 [95%CI 0.33-0.70]) and HCC (HR=0.66 [0.46-0.93]), and was no longer associated with decompensated cirrhosis (HR=1.14 [0.57-2.27]).
Conclusion –
In patients with chronic HCV infection, DAA treatment is associated with a reduced risk of mortality and HCC.
Introduction
L’infection chronique par le virus de l’hépatite C (VHC) (1% de la population mondiale) est responsable de 400 000 décès annuels (par cirrhose et carcinome hépatocellulaire (CHC)) 1. L’élimination du VHC, objectif actuel de l’Organisation mondiale de la santé (OMS) pour 2030, est théoriquement possible depuis la disponibilité de combinaisons d’antiviraux à action directe (AAD), pendant 8 à 12 semaines, permettant d’obtenir une réponse virologique soutenue (RVS ou guérison virologique) pangénotypique chez plus de 95% des patients, avec une bonne tolérance 2,3,4.
Si des études observationnelles 5,6,7,8,9,10,11,12,13,14 ont montré que la RVS était associée à une diminution des complications de la cirrhose, incluant le CHC, après des traitements à base d’interféron ou d’AAD, peu d’études ont comparé le pronostic des patients traités et non traités par AAD, comme l’aurait fait une étude randomisée.
Le but de notre étude était d’évaluer les bénéfices et les risques des AAD en comparant la mortalité, l’incidence du CHC et de la cirrhose décompensée (CD) chez les patients traités ou non par AAD, dans la cohorte prospective CO22 Hepather de l’AFEF/ANRS (ClinicalTrials.gov. NCT01953458).
Patients et méthodes
Schéma de l’étude et patients
La cohorte ANRS CO22 Hepather est une cohorte française multicentrique prospective observationnelle ayant inclus des patients ayant eu une hépatite C et/ou B entre le 6 août 2012 et le 31 décembre 2015, dans 32 centres experts d’hépatologie. Ses principaux objectifs étaient d’analyser l’efficacité et la tolérance des nouveaux traitements des hépatites « en vie réelle » 15.
Au total, 14 389 patients avec une hépatite C ont été recrutés, dont 11 870 patients avec une hépatite C chronique à l’inclusion. Les caractéristiques démographiques, cliniques et biologiques ont été collectées à la visite d’inclusion et aux visites systématiques (au moins annuelles), et parfois à des visites supplémentaires en cas de survenue de décès, CD, traitement antiviral. Dans cette étude observationnelle, le suivi de la fibrose, le traitement et le dépistage du CHC était laissé au libre choix du clinicien en s’appuyant sur les recommandations en cours 16.
Chaque patient a signé un consentement écrit avant l’inclusion. Le protocole a été réalisé en accord avec la Déclaration d’Helsinki et la réglementation française sur la recherche biomédicale, et approuvé par le Comité d’éthique d’Île-de-France 3 (Paris, France) et l’Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Nous avons sélectionné tous les patients avec une hépatite chronique C débutant un traitement par AAD, après exclusion de ceux avec une co-infection virale B (n=95), un antécédent de CHC (n=653), de CD (n=1 003), de transplantation hépatique (n=326) et ceux ayant reçu un traitement incluant de l’interféron pégylé après leur inclusion (n=148). Enfin, les données de suivi étaient manquantes chez 271 patients des 10 166 patients restants. Dans le respect des bonnes pratiques cliniques, certains patients vulnérables n’ont pas été inclus dans la cohorte : détenus, patients sans couverture sociale ou sans domicile fixe, migrants ayant l’aide médicale d’État.
Événements
Les événements étaient la mortalité globale, hépatique et non hépatique, le CHC de novo et la CD (définie par l’apparition d’une ascite, d’une hémorragie par rupture de varices, d’une encéphalopathie et/ou d’un ictère). Le nombre de lésions de CHC au moment du diagnostic, la taille du nodule le plus volumineux, la somme de la taille des différents nodules, les résultats des imageries et le traitement ont été collectés.
Variables prédictives
L’exposition aux AAD était considérée comme une covariable temps-dépendante ; le premier jour du premier traitement par AAD définissait le point à partir duquel le patient n’était plus considéré dans le groupe des patients non traités mais dans le groupe des patients traités. Si un patient recevait plusieurs traitements par AAD au cours du suivi, il ou elle a été considéré(e) comme exposé(e) aux AAD depuis le premier jour du premier traitement par AAD.
Les autres facteurs prédictifs d’événements cliniques évalués à l’inclusion étaient : l’âge, le sexe, l’indice de masse corporelle (IMC), l’origine géographique, le mode de contamination, le délai entre le diagnostic de l’infection et l’inclusion, le score de fibrose, le statut naïf ou en échec d’un précédent traitement, le génotype viral, le diabète, l’hypertension artérielle, la consommation d’alcool, les données biologiques (albumine, aspartate aminotransférase, alanine aminotransférase, gamma glutamyl-transférase, taux de prothrombine, plaquettes, alfa-fœtoprotéine) et le score MELD chez les patients cirrhotiques. Les patients avec un taux de plaquettes <150 000/mL ou un taux de prothrombine <70% étaient considérés comme cirrhotiques, sauf exception spécifiée (n=1 326) 17,18,19. Ces critères étaient disponibles chez 757 patients qui n’avaient pas eu d’évaluation de la fibrose entre un an avant et trois mois après l’inclusion, dont 755 (99,8%) qui n’avaient pas été classés comme cirrhotiques. La fibrose a été évaluée chez les autres par biopsie hépatique (n=398) ou autres techniques non invasives de fibrose – élastographie par Fibroscan® (n=3 188), Fibrotest® (n=1 812), Fibromètre® (n=635) ou Hepascore (n=143) – réalisées au plus proche de l’inclusion (moins d’un an avant à trois mois après). En l’absence d’évaluation ou en cas de discordance entre marqueurs non invasifs, les investigateurs précisaient le score de fibrose le plus probable d’après les scores mesurés, les comorbidités du patient et leur évolution (n=1 521). Le score initial de fibrose, basé sur la classification Métavir 20 restait indéterminé chez 872 patients. Les seuils considérés pour définir la fibrose sévère et la cirrhose par des tests non invasifs étaient de 9,5 kPa et 12,5 kPa pour le Fibroscan®, 0,59 et 0,75 pour le Fibrotest®, 0,62 et 0,98 pour le Fibromètre® et 0,61 et 0,84 pour l’Hepascore.
Analyses statistiques
Le calcul de l’effectif a été basé sur un taux de cirrhotiques de 33% à l’inclusion, une incidence de la mortalité de 2/100 personnes-années en l’absence de traitement chez les patients cirrhotiques 21 et un Hazard Ratio (HR) en analyse multivariée ajustée de mortalité globale de 0,43 (intervalle de confiance à 95%, IC95%: [0,33-0,57]) chez les patients traités versus non traités. Ce calcul a montré qu’un suivi de 1 500 personnes-années chez les patients non exposés aux AAD et de 4 500 personnes-années chez les patients exposés était nécessaire pour obtenir une puissance statistique de 86%, permettant de déterminer un HR inférieur à 0,5.
Le temps de survie a été calculé comme l’intervalle de temps entre l’inclusion (période non exposée) ou le début du premier traitement (période exposée) et la dernière visite de suivi, ou la date de survenue de l’évènement (décès, CHC ou CD), ou le 1er janvier 2018 (évènement de survenue la plus précoce).
Les caractéristiques à l’inclusion étaient comparées en utilisant les tests de Mann-Whitney pour les variables quantitatives et le test exact de Fisher pour les variables évaluées sous forme de classes. Des courbes de Kaplan-Meier ont été réalisées en tenant compte du changement d’exposition pour les patients exposés aux AAD pendant le suivi 22. Les incidences et les intervalles de confiance à 95% ont été estimés par la méthode exacte basée sur la distribution de Poisson. Nous avons utilisé un modèle de Cox avec des pondérations pour réduire le risque de biais d’indication, utilisant des probabilités inverses de recevoir un traitement. Pour tenir compte d’une mise sous traitement par AAD évoluant dans le temps, nous avons également utilisé un modèle de Cox séquentiel 23,24.
Pour mieux caractériser l’impact potentiel de la RVS chez les patients exposés aux AAD par comparaison aux patients non traités, la période d’exposition a été divisée en période de traitement (entre le premier jour de traitement et la fin du troisième mois après l’arrêt du traitement) et période où l’efficacité virologique pouvait être affirmée (à partir de trois mois après l’arrêt du traitement jusqu’à la fin du suivi) considérées comme des covariables tempsdépendant dans le modèle de Cox. Le statut de RVS était évalué après le premier traitement et n’a pas été réactualisé si le patient recevait un autre traitement par AAD. Ces analyses ont été réalisées dans la population globale, chez les patients avec cirrhose et chez les patients sans cirrhose ou avec un score de fibrose indéterminé à l’inclusion dans la cohorte. Comme les patients les plus sévères n’avaient pas été traités en raison du risque de complications liées aux AAD, une analyse de sensibilité supplémentaire a été réalisée en incluant les patients pour lesquels un suivi d’au moins 12 mois était disponible. Toutes les analyses ont été réalisées avec SAS® 9.4 (SAS Institute Inc., Cary, Caroline du Nord, États-Unis). Une valeur de p était définie comme statistiquement significative si inférieure à 0,05.
Résultats
Au total, 10 166 des 14 389 patients infectés par le VHC étaient éligibles dont 9 895 (97%) avec des données de suivi disponibles : 53% d’hommes, d’âge moyen de 56 ans, 7 344 patients traités par AAD après un intervalle de temps médian depuis l’inclusion de 4,3 mois (écart interquartile, IQR : 0,2-17,2). Le suivi médian des patients était de 33,4 mois (IQR : 24,0-40,7) ; à la dernière visite de suivi, 2 551 n’avaient pas été traités avec un suivi médian de 31,2 mois (IQR : 21,5-41,0). Les patients, qui avaient été traités, étaient significativement plus âgés, plus souvent des hommes, avec un IMC plus élevé, une surconsommation d’alcool passée plus fréquente, une hépatite C diagnostiquée depuis plus longtemps que les non traités. Les patients traités par rapport aux non traités étaient plus souvent au stade de cirrhose (42 vs 10%), en échec d’un précédent traitement antiviral C (57 vs 39%), dont 49 (0,7%) vs 3 (0,1%) après un traitement sans interféron, infectés par un génotype 3 (13 vs 9%), diabétiques (13 vs 8%) et hypertendus (30 vs 24%). Le fait que 40% des patients avec une surconsommation d’alcool passée aient une cirrhose (vs 28% chez les autres) (p<0,0001) explique l’association entre consommation excessive passée d’alcool et initiation d’un traitement par AAD.
Au total, 218 décès (73 de cause hépatique, 114 de cause non hépatique et 31 non classés), 258 CHC, 106 CD et 25 transplantations hépatiques ont été observés au cours du suivi.
Les incidences brutes de mortalité globale, de cause hépatique, de CHC et de CD étaient plus élevées chez les patients exposés aux AAD par rapport aux patients non exposés (tableau 1, figure 1). En modèle de Cox non ajusté, l’exposition aux AAD était associée à une augmentation du risque de CHC (HR : 2,77 ; IC95%: [2,07-3,71], p<0,0001) et du risque de CD (HR : 3,83 [2,29-6,42], p<0,0001). Après ajustement en analyse multivariée, l’exposition aux AAD était, au contraire, associée à une diminution de la mortalité globale (HR : 0,48 [0,33-0,70], p<0,0001), de la mortalité hépatique (HR : 0,39 [0,21-0,71]), p<0,002), de la mortalité non hépatique (HR : 0,60 [0,36-1,00)], p<0,048), de l’incidence du CHC (HR : 0,66 [0,46-0,93]), p<0,018) et n’était plus associée à la survenue de CD (HR : 1,14 [0,57-2,27], p=0,72). Des résultats similaires étaient obtenus avec les modèles de Cox pondérés et lorsque l’analyse était limitée aux évènements survenus au-delà des 12 mois de suivi après l’arrêt du traitement. D’autres facteurs prédictifs indépendants de mortalité, de CHC et de CD sont présentés tableau 2.
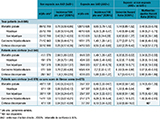 Agrandir l'image
Agrandir l'imageen fonction de l’exposition aux AAD, dans la population globale
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageParmi les 7 344 patients traités, la RVS a été observée chez 5 615 (76%), un échec virologique chez 341 (5%), une réponse indéterminée en raison de données non disponibles chez 709 (10%) et une réponse indéterminée en raison d’un suivi trop bref chez 679 (9%) patients. En analyse multivariée ajustée, la RVS, obtenue chez 94% des patients évaluables (5 615/5 956), était associée à une diminution significative de la mortalité globale, de cause hépatique et non hépatique, de la survenue de CHC et non significative de la survenue de CD alors que l’absence de RVS était associée à un risque accru de CHC (HR : 2,23 [1,37-3,64]), p=0,0012). Il n’y avait pas d’augmentation du risque de CHC observée pendant la période de traitement (HR : 0,74 [0,49-1,13], p=0,17).
En analyse multivariée ajustée, chez les 3 045 patients cirrhotiques, l’exposition aux AAD était fortement associée à une diminution de la mortalité globale (HR : 0,34 [0,22-0,55], p<0,0001), de la mortalité de cause hépatique (HR : 0,28 [0,15-0,54], p=0,0001) et non hépatique (HR : 0,40 [0,19-0,83], p=0,015) et à une diminution du CHC (HR : 0,57 [0,40-0,81], p=0,0016) (tableau 1 et figure 2). Les facteurs prédictifs de survenue d’évènements cliniques chez les cirrhotiques étaient identiques à ceux identifiés dans la cohorte entière.
en fonction de l’exposition aux AAD, chez les patients cirrhotiques
 Agrandir l'image
Agrandir l'imageParmi les 2 823 patients cirrhotiques traités, la RVS a été observée chez 2 329 (83%), un échec virologique chez 195 (7%), une réponse indéterminée en raison de données non disponibles chez 179 (6%) et une réponse indéterminée en raison d’un traitement encore en cours au moment de l’analyse chez 120 (4%) patients. Au total, la RVS était observée chez 2 329 (92%) des 2 524 cirrhotiques évaluables. L’analyse multivariée confirmait l’association entre RVS et diminution de la mortalité globale, de cause hépatique et non hépatique, de la survenue du CHC ainsi que l’association entre absence de RVS et augmentation du risque de CHC.
Chez les patients non cirrhotiques ou avec un score de fibrose non identifié à l’inclusion, aucune association entre l’exposition aux AAD et la survenue d’évènements cliniques n’a été trouvée (tableau 1).
Parmi les 4 521 patients non cirrhotiques traités, la RVS a été observée chez 3 286 (73%), un échec virologique chez 146 (3%), une réponse indéterminée en raison de données non disponibles chez 559 (12%) et une réponse indéterminée en raison d’un traitement encore en cours au moment de l’analyse chez 530 (12%) patients. Au total, la RVS était observée chez 3 286 (96%) des 3 432 cirrhotiques évaluables.
La comparaison des caractéristiques des CHC incidents, obtenues chez 249 (97%) patients, ne montrait pas de différence de délai entre la dernière imagerie normale et le diagnostic de CHC, des caractéristiques macroscopiques (nombre, taille des nodules) ou du taux d’alfafœtoprotéine entre les patients traités ou non.
Discussion
Dans cette large cohorte française, le traitement par AAD était associé à une diminution de la mortalité (52%) et de la survenue du CHC (34%) après ajustement sur les facteurs potentiellement confondants par comparaison aux patients non traités. Ces résultats étaient similaires chez les patients cirrhotiques et ce bénéfice était observé chez les patients avec RVS, alors que le risque de CHC était augmenté chez les autres. Aucune augmentation du risque de CHC au cours du traitement par AAD n’a été montrée dans cette étude.
Nos résultats, montrant une association forte et indépendante entre la mortalité globale et la cirrhose, les marqueurs d’insuffisance hépatique, l’hypertension artérielle et l’anémie sont comparables à ceux de la cohorte rétrospective ERCHIVES 12.
Comme dans d’autres études, après AAD, le risque de décès et de CHC était faible chez les patients en RVS alors que le risque de CHC était significativement plus élevé chez les patients en échec virologique (7,19/100 [5,16/100-9,76/100] personnes-années vs 3,45/100 [2,73/100-4,18/100] personnes-années), en raison des règles de priorisation de l’accès aux AAD chez les patients ayant un risque de mortalité et de morbidité plus élevé.
La mortalité non hépatique était plus faible chez les patients traités et en RVS par rapport aux autres, comme cela a déjà été observé après traitement par interféron 25, mais il faut aussi tenir compte du fait que les patients avec les lésions hépatiques les plus sévères (risque le plus élevé de mortalité hépatique) ont été moins souvent traités par AAD. Les patients avec une CD ou un antécédent de CHC avaient été initialement exclus de l’analyse et l’analyse multivariée a été ajustée sur de nombreux marqueurs de fonction hépatique et sur les comorbidités.
Les limites de cette étude concernent le recueil hétérogène (test invasif ou non) de la sévérité de la fibrose à l’inclusion, sans actualisation préthérapeutique (même si le diagnostic de cirrhose était validé par les taux de plaquettes et de prothrombine et les résultats comparables chez les cirrhotiques, moins biaisés par la classification de la fibrose), la durée brève du suivi, le caractère observationnel de l’étude susceptible de sous-estimer l’incidence du CHC en cas de dépistage suboptimal (cette hypothèse étant infirmée par un nombre d’échographies plus élevé chez les patients pendant et juste après le traitement, qui entraînerait plutôt une diminution de la détection des CHC chez les patients non traités), une association non significative entre AAD et CD (probable défaut de puissance statistique) et l’exclusion de certaines populations vulnérables.
Si une relation de cause à effet entre AAD et diminution de la mortalité est difficile à confirmer par un observatoire, les différences de risques observées chez les patients traités avec ou sans RVS suggèrent que la RVS liée aux AAD diminue les lésions hépatiques, l’évolution vers le décès ou le CHC.
En conclusion, cette large étude de cohorte prospective a montré une diminution significative de la mortalité globale et de la survenue du CHC associée au traitement par AAD et l’absence d’effet facilitateur des AAD sur le développement du CHC. L’influence à long terme des AAD sur la décompensation hépatique reste encore à clarifier.
Remerciements
Nous remercions les participants et les cliniciens de l’étude, ainsi que Clovis Lusivika Nzinga pour son aide dans l’analyse statistique et méthodologique.
Liens d’intérêt
Professeur Carrat : financements de l’Inserm-ANRS pour cette l’étude ; honoraires d’Imaxio, sans lien avec l’étude. Docteur
Fontaine : honoraires et invitations à des congrès médicaux par Gilead, Abbvie, BMS, MSD, Janssen sans lien avec cette étude.
Professeur Pol : honoraires et financements de Bristol-Myers Squibb, Janssen, Gilead, Roche, Boehringer Ingelheim, MSD et
Abbvie.
Les liens d’intérêts des membres du groupe français ANRS CO22 Hepather sont détaillés dans l’article : Carrat F, Fontaine H,
Dorival C, Simony M, Diallo A, Hezode C, et al. Clinical outcomes in patients with chronic hepatitis C after direct-acting antiviral treatment: A prospective cohort study.
Lancet 2019;393:
1453-64.
Financement de l’étude
Inserm-ANRS (France recherche nord&sud sida-VIH hépatites), ANR (Agence nationale de la Recherche), DGS (Direction Générale
de la Santé), MSD, Janssen, Gilead, Abbvie, BMS, Roche.
La cohorte ANRS-CO22 Hepather a été promue par l’ANRS-Inserm, qui a contribué à sa construction et à sa réalisation, mais
n’a pas eu de rôle dans la collecte, l’analyse et l’interprétation des données. Les autres sponsors n’ont joué aucun rôle
dans la construction, la réalisation de l’étude, la collection, l’analyse et l’interprétation des données. Le Professeur Carrat
avait un accès à toutes les données et les Professeurs Carrat et Pol ont pris la décision finale de soumission des résultats
pour publication.
Références
publications/global-hepatitis-report2017/en/
fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm225333.pdf.
europa.eu/docs/en_GB/document_library/Scientific_guideline/2016/07/WC500209917.pdf.
3661-79.
817-26.




