Prévalence des hépatites chroniques C et B et antécédents de dépistage en population générale en 2016 : contribution à une nouvelle stratégie de dépistage, Baromètre de Santé publique France-BaroTest*
// HCV and HBV prevalence based on home blood self-sampling based, and screening history in the general population: contribution to the new French screening strategy, 2016 Barometer of Santé publique France-BaroTest
* Cet article est une adaptation de l’article :
Brouard C, Saboni L, Gautier A, Chevaliez S, Rahib D, Richard JB, et al. HCV and HBV prevalence
based on home blood self-sampling
and screening history in the general population in 2016: contribution
to the new French screening strategy. BMC Infectious
diseases. 2019 (à paraître).
Résumé
La stratégie de dépistage de l’hépatite C est actuellement en cours de réévaluation par la Haute Autorité de santé. L’une des options envisagées consisterait en un dépistage combiné des virus des hépatites C (VHC) et B (VHB) et du VIH au moins une fois au cours de la vie pour l’ensemble des adultes (« dépistage universel et combiné »). Des données nationales récentes sont nécessaires pour guider cette nouvelle stratégie.
Notre objectif est de fournir des estimations de prévalence des hépatites chroniques C (HCC) et B (HCB) et de dépistage à partir du BaroTest et du Baromètre de Santé publique France 2016. Ce baromètre est une enquête téléphonique réalisée auprès d’un échantillon aléatoire en population générale métropolitaine. BaroTest est un volet virologique adossé au Baromètre de Santé publique France 2016, basé sur un auto-prélèvement de sang déposé sur buvard réalisé à domicile.
La prévalence chez les 18-75 ans a été estimée à 0,30% (IC95%: [0,13-0,70]) pour l’HCC et 0,30% [0,13-0,70] pour l’HCB. L’estimation de personnes infectées connaissant leur statut est de 80,6% [44,2-95,6] pour l’HCC et 17,5% [4,9-46,4] pour l’HCB. Un dépistage universel et combiné du VHC/VHB/VIH impliquerait de tester entre 32,6% de cette population, si l’on considère les individus n’ayant eu aucun des trois tests, et 85,3% en prenant également en compte ceux déjà testés pour un ou deux des virus.
Ces résultats, utiles pour guider la nouvelle stratégie de dépistage de l’hépatite C, soulignent également que des efforts importants sont encore nécessaires pour atteindre les objectifs d’élimination des hépatites C et B.
Abstract
In France, the screening strategy for hepatitis C virus (HCV) is being reassessed by the French National Authority for Health. One of the options considered would be combined HCV, hepatitis B virus (HBV) and HIV screening for all adults at least once during lifetime (“universal and combined screening”). Recent national data are necessary to guide this new strategy.
The main objective of the present study was to update the prevalence of chronic hepatitis C (CHC) and B (CHB) and screening history from the BaroTest and the 2016 Barometer of Santé publique France. This barometer is a national cross-sectional phone survey, conducted in 2016 among randomly selected individuals in the French Metropolitan general population. BaroTest is a virological sub-study nested in the 2016 Barometer of Santé publique France, based on home blood self-sampling on dried blood spots.
CHC and CHB prevalence was estimated at 0.30% (95%CI: [0.13-0.70]) and 0.30% [0.13-0.70] respectively. The proportion of individuals
who are aware of their status was estimated
at 80.6% [44.2-95.6] for CHC and 17.5% [4.9-46.4] for CHB. Universal and combined
screening would involve testing between 32.6% and 85.3% of 15-75 year olds according to whether we consider only individuals
not previously tested for any of the three viruses, or also those already tested for one or two of the viruses.
These data, essential to guide decision-making regarding the new HCV screening, also highlight that efforts are still needed to achieve WHO’s elimination targets of HCV and HBV.
Introduction
La France est un pays de faible endémicité pour le VIH et les virus des hépatites C (VHC) et B (VHB), avec des prévalences estimées respectivement à 0,36% (pour 2016), 0,42% (pour 2011) et 0,65% (pour 2004) dans la population générale adulte 1,2,3.
L’activité de dépistage de ces trois virus est importante avec, pour 1 000 habitants, un nombre annuel de tests réalisés dans les laboratoires de biologie médicale de : 81 pour le VIH, 62 pour le VHC et 65 pour le VHB en 2016 4,5. Ces dernières années, les outils de dépistage se sont diversifiés avec le développement des tests rapides d’orientation diagnostique (TROD) pour le VIH, le VHC et le VHB, et l’introduction des autotests pour le VIH.
Cependant, les taux de dépistage restent à améliorer, en particulier pour le VHC et le VHB. En effet, alors que l’Organisation mondiale de la santé (OMS) a fixé pour objectif que 90% des personnes infectées soient diagnostiquées d’ici 2020 pour le VIH 6 et d’ici 2030 pour les hépatites B et C 7, la proportion de personnes connaissant leur statut en France a été estimée à 86% pour le VIH (en 2016) 3, mais à seulement 57% pour l’hépatite C (en 2004) et 45% pour l’hépatite B (en 2004) 8.
Les antiviraux à action directe (AAD), très efficaces contre l’hépatite C, disponibles depuis 2014 et désormais recommandés pour l’ensemble des personnes infectées 9, laissent espérer un contrôle de l’épidémie à moyen terme avec un taux de guérison >95%. Dans ce contexte, la Haute Autorité de santé (HAS) réévalue la stratégie de dépistage de l’hépatite C. La principale option envisagée consiste à compléter la stratégie actuelle, qui cible les personnes à risque élevé d’exposition 10, par le dépistage combiné du VHC, du VHB et du VIH pour tous les adultes au moins une fois dans leur vie (« dépistage universel et combiné ») 11. Cette option, proposée par plusieurs rapports d’experts 8,12, serait coût-efficace 13.
S’il existe des données récentes sur la prévalence et la connaissance du statut pour le VIH (2016), les données disponibles
pour le VHC et le VHB sont basées sur l’enquête de prévalence réalisée en 2004.
Il était donc urgent de publier des données
actualisées sur ces deux infections, en particulier pour contribuer à la réévaluation de la stratégie de dépistage.
L’objectif de cet article est de fournir des estimations pour l’année 2016 de la prévalence des hépatites chroniques C (HCC) et B (HCB), à partir de l’étude BaroTest, et sur le dépistage, à partir du Baromètre de Santé publique France 2016.
Méthode
Recueil de données
Le Baromètre de Santé publique France 2016 est une enquête menée par téléphone auprès d’un échantillon représentatif de la population des 15-75 ans résidant en France métropolitaine et parlant français. La méthode de sondage est identique à celle du Baromètre santé 2014 14. L’échantillon national du Baromètre de Santé publique France 2016 a été complété par quatre sur-échantillons régionaux (Bourgogne-Franche-Comté, Île-de-France, Midi-Pyrénées et Provence-Alpes-Côte d’Azur).
Les caractéristiques sociodémographiques, les expositions à risque vis-à-vis du VHC et du VHB, les antécédents de dépistage du VHC, VHB et VIH au cours de la vie et le résultat du dernier test ont été recueillis.
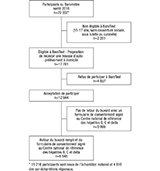
BaroTest est une enquête virologique adossée au Baromètre de Santé publique France 2016. À la fin de l’interview de ce baromètre, les participants éligibles à BaroTest, c’est-à-dire les personnes âgées de 18 à 75 ans, ayant une couverture sociale et n’étant pas sous tutelle ou curatelle, étaient invitées à bénéficier d’un dépistage gratuit pour le VHC, VHB et VIH à partir d’un auto-prélèvement sanguin réalisé à domicile. Les personnes ayant accepté de participer à BaroTest recevaient une trousse d’auto-prélèvement par courrier postal. Après piqûre au bout du doigt, elles déposaient plusieurs gouttes de sang sur un buvard et le renvoyaient, accompagné d’un formulaire de consentement signé, au Centre national de référence des hépatites virales B, C et delta (CNR) en charge des analyses biologiques. Si tous les résultats étaient négatifs, ils étaient envoyés par courrier au participant et au médecin désigné dans le formulaire de consentement. Si l’un des tests était positif, les résultats étaient envoyés au médecin désigné, chargé d’annoncer les résultats au participant, et le participant était invité à consulter son médecin pour prendre connaissance de ses résultats. Le protocole détaillé de BaroTest a été publié récemment 15.
Analyses biologiques
La détection des anticorps (Ac) anti-VHC et de l’antigène (Ag) HBs ont été réalisées à partir du sang total déposé sur papier
buvard (aHCV Vitros ECi®, Ortho-Clinical Diagnostics, Raritan, New Jersey, États-Unis ; VIDAS Ag HBs Ultra®, BioMerieux, France) 15. Pour les échantillons positifs en Ac anti-VHC, l’ARN du VHC a été recherché par PCR (Abbott RealTime HCV® assay, Abbott Molecular, Des Plaines, Illinois,
États-Unis).
Pondérations
Les données du Baromètre de Santé publique France 2016 ont été pondérées pour tenir compte de la probabilité d’inclusion, puis redressées par calage sur marges. Pour l’échantillon BaroTest, une pondération spécifique a été appliquée, reposant sur la méthode des scores par quantiles 16 : 1) pour prendre en compte les différences de participation selon le sexe, l’âge, le pays de naissance, la région de résidence, le niveau d’éducation, le revenu mensuel du ménage et la taille d’agglomération, 2) pour caler la structure sociodémographique de l’échantillon du BaroTest sur les données de l’Institut national de la statistique et des études économiques (Insee).
Analyses de données
L’HCC a été définie par la détection de l’ARN VHC et l’HCB par la détection de l’AgHBs.
Les prévalences de l’HCC et de l’HCB ont été estimées par les proportions de personnes testées positives parmi la population testée dans l’échantillon BaroTest, extrapolées aux 18-75 ans de la population métropolitaine en 2016 (Insee).
La part de personnes connaissant leur infection a été estimée par la proportion de personnes ayant déclaré être positives dans le Baromètre de Santé publique France 2016 parmi celles testées positives dans BaroTest.
La proportion de la population générale qui nécessiterait d’être dépistée, dans l’option du dépistage universel et combiné, a été estimée selon deux scenarii : 1) les personnes rapportant n’avoir jamais été testées pour aucun des trois virus (« estimation minimale »), 2) les personnes déclarant ne pas avoir été testées pour l’un au moins des trois virus (« estimation maximale »). Les nombres de personnes qui nécessiteraient d’être dépistées ont été estimés en appliquant ces proportions aux estimations de population âgée de 15 à 75 ans en France métropolitaine en 2016 (Insee).
Des modèles multivariés de régression de Poisson ont été utilisés pour identifier les facteurs indépendamment associés aux antécédents de dépistage VHC et VHB au cours de la vie.
Résultats
Participation
Parmi les 20 032 répondants au Baromètre de Santé publique France 2016 (15 216 issus de l’échantillon national et 4 816 provenant des quatre sur-échantillons régionaux), 17 781 personnes éligibles à participer à BaroTest ont été invitées à recevoir un kit d’autoprélèvement à domicile (figure). Parmi elles, 12 944 ont accepté de participer et 6 945 ont renvoyé un buvard et un formulaire de consentement signé au CNR, soit 39,1% des personnes invitées à participer. Les participants à BaroTest ont été décrits précédemment 17.
Prévalence des hépatites chroniques C et B
L’ARN du VHC a été détecté chez 11 individus. La prévalence de l’HCC dans la population générale âgée de 18 à 75 ans vivant en France métropolitaine a été estimée à 0,30% (intervalle de confiance à 95%, IC95% : [0,13-0,70]), correspondant à 133 466 individus [56 880-312 616].
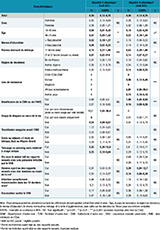
Cette prévalence n’était pas significativement différente entre les hommes (0,34%) et les femmes (0,26%) (tableau 1). Elle était plus élevée parmi les 46-75 ans (0,51%) que parmi les 18-45 ans (0,08%, p<0,05), parmi les individus n’ayant pas le Baccalauréat (0,52%) par rapport à ceux détenant un diplôme supérieur ou égal au Baccalauréat (0,08%, p<10-2) et chez ceux dont le revenu mensuel du ménage était bas (0,74%) comparés à ceux vivant dans un ménage avec un revenu mensuel moyen ou élevé (0,07%, p<10-3).
âgée de 18 à 75 ans, BaroTest 2016
 Agrandir l'image
Agrandir l'imageConcernant les expositions à risque vis-à-vis de l’hépatite C, la prévalence de l’HCC atteignait 12,1% parmi les individus ayant rapporté avoir utilisé de la drogue par voie intraveineuse au cours de leur vie (vs 0,24% pour ceux n’ayant pas déclaré d’usage de drogue, p<10-3), et était plus élevée chez les individus avec un tatouage ou un piercing réalisé sans matériel à usage unique (2,55% vs. 0,25% chez les autres, p<10-2). Elle était plus élevée (mais non significativement) chez les personnes avec un antécédent de transfusion sanguine avant 1992 (1,12%) que parmi celles n’en ayant pas eu (0,24%).
Parmi les personnes avec une HCC, la part de celles connaissant leur infection a été estimée à 80,6% [44,2-95,6], correspondant à 107 574 [58 992-127 594] personnes âgées de 18 à 75 ans en population générale métropolitaine.
L’AgHBs a été détecté chez 18 individus. La prévalence de l’HCB dans la population générale âgée de 18 à 75 ans vivant en France métropolitaine a été estimée à 0,30% [0,13-0,70], correspondant à 135 706 individus [58 224-313 960]. La prévalence de l’HCB n’était pas significativement différente entre les hommes (0,28%) et les femmes (0,32%) (tableau 1). Elle était plus élevée chez les personnes âgées de 46 à 75 ans (0,51%) que chez celles âgées de 18 à 45 ans (0,10%, p<0,05), parmi les individus dont le revenu mensuel du ménage appartenait au tercile le plus faible (0,63%) comparés à ceux vivant dans un ménage avec un revenu mensuel dans le 2e ou 3e tercile (0,14%, p<0,05), et parmi les bénéficiaires de la couverture médicale universelle (CMU) ou de l’aide médicale d’état (AME) (1,98%) comparés aux personnes bénéficiaires des autres régimes (0,16%, p<10-3).
La prévalence de l’HCB était associée au lieu de naissance (p<10-3), atteignant 5,81% pour les personnes nées en Afrique subsaharienne comparé à 0,14% pour les personnes nées en France métropolitaine. Pour les hommes ayant déclaré au moins un partenaire sexuel masculin au cours de leur vie, la prévalence de l’HCB a été estimée à 3,39% (vs 0,16% pour les autres hommes, p<10-3).
Parmi les personnes avec une HCB, la part de celles connaissant leur infection a été estimée à 17,5% [4,9-46,4], ce qui correspond à 23 749 [6 650-62 967] personnes âgées de 18 à 75 ans en population générale métropolitaine.
Antécédents de dépistage VHC et VHB
Parmi les répondants au Baromètre de Santé publique France 2016, 19,2% [18,6-19,9] avaient déclaré avoir déjà effectué un test de dépistage de l’hépatite C au cours de leur vie et 35,6% [34,8-36,5] un test de dépistage pour l’hépatite B.
En analyse multivariée, les antécédents de dépistage VHC et VHB augmentaient de manière statistiquement significative avec le niveau d’éducation (tableau 2) et étaient plus fréquemment rapportés par les participants vivant dans l’agglomération parisienne ou dans une ville d’au moins 100 000 habitants comparativement à ceux résidant dans une zone rurale, et par les répondants bénéficiant de la CMU ou de l’AME par rapport aux non-bénéficiaires.
 Agrandir l'image
Agrandir l'imageLes participants rapportant les expositions à risque suivantes, vis-à-vis du VHC ou du VHB, déclaraient également significativement plus fréquemment un test de dépistage du VHB ou du VHC au cours de la vie : usage de drogue au cours de la vie, soins ou séjour prolongé dans des pays à forte endémicité pour le VHC ou le VHB, transfusion sanguine avant 1992, vécu ou relations sexuelles avec une personne infectée par le VHB, rapports sexuels entre hommes au cours de la vie, infection sexuellement transmissible au cours des 12 derniers mois.
Les participants âgés de 61 à 75 ans étaient moins nombreux à déclarer avoir déjà été dépistés pour l’hépatite C que ceux âgés de 15 à 30 ans. Pour l’hépatite B, les participants les plus jeunes (15-30 ans) déclaraient moins souvent un test au cours de la vie que ceux âgés de 31 à 45 ans et de 46 à 60 ans. Les antécédents de dépistage de l’hépatite B étaient plus fréquents parmi les participants ayant déclaré être vaccinés contre le VHB.
Au total, 32,6% [31,7-33,4] des participants au Baromètre de Santé publique France 2016 indiquaient n’avoir jamais avoir été testés pour aucun des trois virus (VHC, VHB et VIH) et 85,3% [84,7-85,9] rapportaient ne pas avoir été testés pour au moins l’un de ces trois virus. Ceci correspondait à une estimation minimale de 15 380 061 [14 955 458-15 757 485] et une estimation maximale de 40 242 919 [39 959 851-40 525 988] individus âgés de 15-75 ans en population générale métropolitaine qui nécessiteraient d’être dépistés si le dépistage universel et combiné était mis en place.
Discussion
Grâce à une étude originale qui utilise un auto-dépistage sanguin à domicile, accolée à une enquête téléphonique de grande ampleur, notre travail fournit de nouvelles estimations de prévalence des hépatites chroniques B et C dans la population générale métropolitaine, ainsi que des données sur les antécédents de dépistage, utiles pour la réévaluation de la stratégie de dépistage de l’hépatite C.
En population générale âgée de 18-75 ans, la prévalence de l’HCC a été estimée à 0,30% [0,13-0,70], soit et celle de l’HCB à 0,30% [0,13-0,70], soit environ 135 000 individus pour chacune de ces pathologies. En 2004, une enquête de prévalence avait permis d’estimer à 0,53% [0,40-0,70] la prévalence de l’HCC et à 0,65% [0,45-0,93] celle de l’HCB 2.
À partir de cette étude, plusieurs études de modélisation ont permis d’estimer à 0,42% la prévalence de l’HCC (intervalle de crédibilité à 95% : [0,33-0,53]) pour 2011 et à 0,3% (intervalle d’incertitude à 95% (II95%) : [0,1-0,3]) et 0,29% (II95%: [0,14-0,34]), toutes deux pour 2015 1,18,19. Pour l’HCB, seule une estimation est disponible depuis 2004 à partir d’un modèle : 0,5% (II95% : [0,4-0,7]) pour 2016 20.
Du fait des différences de méthodes utilisées, il convient d’être prudent dans la comparaison de ces estimations. En particulier, l’utilisation de sang total déposé sur buvard pour BaroTest a pu conduire à une sous-estimation des prévalences des hépatites chroniques C et B par rapport à l’enquête de prévalence de 2004, à cause d’une possible perte de sensibilité. Cependant, plusieurs études, dont une méta-analyse, ont montré de très bonnes performances (avec une sensibilité et une spécificité supérieures à 98%) des tests de détection des anticorps anti-VHC, de l’AgHBs et de l’ARN du VHC à partir de sang total déposé sur buvard comparé au sérum issu d’un prélèvement veineux 21,22.
La baisse que nous observons pour la prévalence de l’HCC depuis 2004, même si non statistiquement significative, est sans doute liée à la diminution du nombre de personnes infectées par transfusion avant 1992, aux AAD disponibles depuis fin 2013, ainsi qu’à la baisse de l’incidence du VHC. En effet, l’incidence du VHC parmi les usagers de drogues (UD), population où surviennent la majorité des nouvelles contaminations, a diminué de 7,9/100 personnesannées en 2004 à 4,4/100 personnes-années en 2011 23. Concernant l’HCB, l’estimation de prévalence a également tendance à diminuer.
Il convient également d’être prudent en extrapolant nos résultats à l’ensemble de la population. En effet, les populations marginalisées, pour lesquelles les prévalences de l’HCC et de l’HCB sont probablement plus élevées, étaient soit non représentées du fait des critères d’éligibilité au BaroTest (personnes francophones et avec couverture sociale) ou probablement sous-représentées (UD actifs, personnes sans domicile fixe par exemple) du fait du recrutement du Baromètre de santé publique France par téléphone. De plus, malgré une bonne participation ayant permis de disposer de près de 7 000 buvards, la puissance statistique était probablement sousoptimale, conduisant à certains résultats non significatifs (par exemple, une prévalence de l’HCC non significativement plus élevée chez les personnes rapportant des antécédents de transfusion avant 1992 ou une prévalence de l’HCB non significativement plus élevée chez les hommes).
Pour autant, nos estimations de prévalences sont cohérentes avec les estimations récentes dans les pays d’Europe occidentale, que ce soit pour l’HCC ou l’HCB 19,20,24.
Parmi les personnes testées positives, la proportion de celles déclarant connaitre leur statut a été estimée à 80,6% (IC95% : [44,2-95,6%]) pour l’HCC et seulement 17,5% [4,9-46,4%] pour l’HCB. Ces estimations ne sont pas robustes étant donné le très faible nombre de participants testés positifs, entraînant des intervalles de confiance très larges.
Le faible niveau de connaissance et la confusion possible entre les différents types d’hépatites déjà décrits 25 impactent probablement les proportions de personnes rapportant des antécédents de test VHB ou VHC dans leur vie. Ainsi, comparativement aux estimations antérieures utilisant la même méthodologie, la proportion de personnes rapportant un antécédent de test de dépistage est proche pour le VHC (19,2% dans le Baromètre de Santé publique France 2016 vs 19,7% dans le Baromètre 2010), mais diffère nettement pour le VHB (35,6% dans le Baromètre 2016 vs 15,2% dans le Baromètre 2010 et 27,4% dans l’enquête KABP-2010) 26. Cependant, en analyse multivariée, les facteurs associés aux antécédents de dépistage VHC et VHB sont cohérents avec ceux décrits précédemment, en particulier l’âge, le niveau d’éducation et la taille d’agglomération. Un résultat important est que, après ajustement, le dépistage VHC et VHB est plus fréquemment déclaré par les individus rapportant des expositions à risque et donc concernés par les recommandations actuelles de dépistage, même si les niveaux de dépistages énoncés sont insuffisants (par exemple, 65% pour l’hépatite C pour les personnes rapportant un usage de drogue par voie intraveineuse, 50% pour l’hépatite B pour les personnes nées dans des zones de forte endémicité).
L’option de dépistage universel et combiné du VHC, du VHB et du VIH impliquerait de tester une proportion importante de la population générale âgée de 15-75 ans puisqu’un tiers de celle-ci rapportait n’avoir jamais été dépistée pour aucun des trois virus et 85% rapportait ne pas avoir été testés pour au moins l’un de ces virus. Ces estimations sont un élément important à prendre en compte pour le choix de la future stratégie de dépistage du VHC.
Remerciements
Aux personnes ayant participé aux enquêtes Baromètre de Santé publique France 2016 et BaroTest, à l’institut Ipsos (Christophe David, Valérie Blineau, Farah El Malti, Elisabeth Diez, les enquêteurs et chefs d’équipe) ainsi qu’à l’institut CDA en charge de l’audit du terrain d’enquête, les équipes du Centre national de référence des hépatites virales B, C et delta (Mélanie Wlassow, Lila Poiteau, Alexandre Soulier, Adrienne Reid et Laurence Ledit) et du VIH (Francis Barin, Kevin Babaud, Céline Desouche, Damien Thierry) ; à Noémie Soullier pour ses conseils techniques sur l’ajustement de la non-réponse, Hélène Haguy et Béatrice Gallaine de Santé publique France pour leur aide en secrétariat ; aux Observatoires régionaux de santé d’Île-de-France (Catherine Embersin-Kyprianou, Valérie Féron, Isabelle Grémy), de Bourgogne-Franche-Comté et de Midi-Pyrénées et à l’Agence régionale de santé de Provence-Alpes-Côte d’Azur pour nous avoir donné accès à leurs sous-échantillons régionaux du Baromètre de Santé publique France 2016.
Financement
Santé publique France a financé l’étude BaroTest pour tous les participants et l’échantillon national du Baromètre de Santé
publique France 2016 (15 216 participants).
Pour le Baromètre de Santé publique France 2016, les sur-échantillons régionaux (4 816 participants) ont été financés par
les Agences régionales de santé suivantes : Île-de-France, Bourgogne-Franche-Comté, Midi-Pyrénées et Provence-Alpes-Côte d’Azur.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt au regard du contenu de l’article.
Références
files/files/Autres/Prevalence-VIH.pdf
upload/docs/application/pdf/2016-12/recommandation_college_hepatite_c.pdf
hepatite.pdf.
of HIV, hepatitis B, and hepatitis C in the general population: Protocol for an acceptability and feasibility study (BaroTest 2016). JMIR Res Protoc. 2018;7(10):e180.
25-43.
recherche/SPF00000028