Évaluation coût-efficacité de la vaccination contre les papillomavirus humains dans le cadre du dépistage du cancer du col de l’utérus en France
// Cost-effectiveness analysis of human papillomavirus vaccination in the context of organized cervical cancer screening in France
Résumé
Introduction –
L’Institut national du cancer (INCa) a souhaité quantifier les bénéfices de santé additionnels (lésions précancéreuses, cancers du col de l’utérus (CCU) et décès par CCU évités) en France de la vaccination contre les papillomavirus humains (HPV), dans le contexte de la récente commercialisation du vaccin nonavalent (Gardasil® 9) et de la mise en place du dépistage organisé (DO) du CCU.
Méthodes –
L’étude est fondée sur un modèle de micro-simulation qui reproduit l’histoire naturelle du CCU générant une cohorte de jeunes filles de 14 ans et suit chacune d’elles jusqu’à son décès. Les autres affections liées à l’infection HPV (condylomes, cancers de l’anus, cancer du pénis et oropharynx) ne sont pas modélisées. Différentes stratégies sont comparées à la situation de couverture vaccinale (CV) actuelle de 21,4% (2017) : impact de l’augmentation de la CV seule et impact de l’augmentation de la CV conjuguée à la correction des inégalités de vaccination (hypothèse où les femmes bénéficiaires de la couverture maladie universelle complémentaire (CMU-C) sont autant vaccinées que les femmes non bénéficiaires de la CMU-C). Un horizon temporel vie entière et une perspective collective (tous payeurs) sont utilisés. L’analyse de sensibilité, incluant la durée de protection du vaccin (20 ans ou vie entière) et le prix du vaccin (prix français et prix moyens européens), est évaluée et discutée.
Résultats –
Toutes les stratégies évaluées sont associées à un ratio différentiel coût-résultat (RDCR) inférieur à 15 000 euros par QALY (quality-adjusted life year: année de vie pondérée par la qualité de vie). En comparaison à la situation actuelle, une augmentation de CV jusqu’à 85% avec correction des inégalités permettrait d’éviter a minima par cohorte annuelle de jeunes filles de 14 ans : 2 546 conisations, 2 347 lésions précancéreuses CIN2/3 diagnostiquées, 377 CCU, 139 décès par CCU (protection du vaccin de 20 ans). Les scénarios basés sur l’augmentation de la CV avec correction des inégalités sont les plus coûts-efficaces.
Conclusion –
L’étude permet d’estimer les cas de lésions précancéreuses, CCU et décès par CCU qui pourraient être évités en augmentant la couverture vaccinale et de chiffrer les investissements permettant la mise en place d’actions visant à améliorer l’efficience des stratégies actuelles et à lutter contre les inégalités de santé (campagne de communication, actions à destination des femmes bénéficiaires de la CMU-C).
Abstract
Introduction –
The National Cancer Institute (INCa) wished to quantify the expected additional health impact of human papillomavirus (HPV) vaccination (pre-cancerous lesions, cervical cancers (CC) and deaths by CC avoided) in the context of the recent commercialization of the nonavalent HPV vaccine (Gardasil® 9) and the implementation of organized screening of CC in France.
Methods –
The study is based on a micro-simulation model that replicates the natural history of CC. A cohort of 14-year-old women is generated and followed until death. Others HPV-infection related diseases (condyloma, anal cancer, penile cancer and oropharynx cancer) are not modelled. Different strategies were compared with the current vaccination coverage rate (VCR) of 21.4% (2017): impact of increased VCR alone and increased VCR combined with correction of inequalities (hypothesis that women who are beneficiaries of a specific free complementary health insurance cover for those on a low income (CMU-C) are as equally vaccinated as women that are not beneficiaries). A lifetime horizon and a ‘collective’ (i.e. all payers) perspective are used. The sensitivity analysis includes the duration of the protection by the vaccine (limited to 20 years or lifetime) and the price of the vaccine (French price and average European prices).
Results –
The incremental cost-effectiveness ratio (ICER) was less than 15,000 euros per QALY (quality-adjusted life year: year of life weighed by quality of life) for all the assessed strategies. Compared with the current situation, 85% VCR increase with correction of inequalities would prevent at least for each 14-year-old women cohort: 2,546 conisations, 2,347 precancerous lesions CIN 2/3 diagnosed, 377 CCs, 139 deaths from CC (20 years vaccine protection). Scenarios based on increasing VCR with correction of inequalities are the most cost-effective.
Conclusion –
The study allows to estimate the cases of precancerous lesions, CC and deaths by CCU that could be avoided by increasing the vaccination coverage and to quantify the investments allowing the implementation of actions aiming at improving the efficiency of the current strategies and address health inequalities (communication campaign, actions toward underserved women).
Introduction
En France, les infections à papillomavirus humain (HPV) représentent une morbidité et une mortalité évitables non négligeables dans le domaine du cancer. Pour l’année 2015, plus de 6 300 cancers seraient attribuables aux HPV, soit près de 2% des cancers incidents. Les cancers du col de l’utérus (CCU), de l’anus et de l’oropharynx représentent la majorité des cas, respectivement : 44%, 24% et 22% des cancers attribuables aux HPV 1. À ce jour, les vaccins contre les HPV ont une indication qui se limite à la prévention des lésions précancéreuses et des cancers du col de l’utérus et de l’anus. Cette prévention primaire s’inscrit en complémentarité avec le dépistage organisé (DO) du CCU.
Selon les données de projection pour le cancer de col de l’utérus, l’année 2018 serait marquée par 2 920 nouveaux cas et plus de 1 100 décès associés 2. L’incidence de ce cancer diminue depuis 1980, avec toutefois un ralentissement de cette baisse depuis le début des années 2000 2. De plus, en 2016, près de 35 000 femmes ont été traitées pour des lésions précancéreuses du col de l’utérus et 50% d’entre elles avaient moins de 39 ans 3. Le traitement par conisation des lésions précancéreuses peut entraîner pour la femme un sur-risque obstétrical pour les grossesses futures (accouchement prématuré, petit poids de naissance, mortalité périnatale et complications néonatales sévères) 4.
Des inégalités en termes d’incidence du cancer du col de l’utérus et de survie selon le statut socioéconomique des femmes ont été décrites en France 5. Ainsi, les femmes bénéficiaires de la couverture maladie universelle complémentaire (CMU-C) participent moins au dépistage du cancer du col de l’utérus que les femmes non bénéficiaires de la CMU-C (risque relatif (RR) : 0,8) et les jeunes filles dont les mères n’ont pas eu de dépistage récent ont environ deux fois moins de chances d’être vaccinées (rapports de prévalence de 0,64 pour les dépistages tous les trois ans, respectivement) que celles de mères avec dépistage récent 6,7.
Le dépistage du CCU et la vaccination sont deux méthodes de prévention complémentaires pour diminuer l’incidence et la mortalité par cancer du col de l’utérus. Actuellement, la vaccination contre les HPV est recommandée pour les jeunes filles (2 doses entre 11 et 14 ans, ou 3 doses entre 15 et 19 ans) et pour les hommes qui ont des relations sexuelles avec des hommes (3 doses jusqu’à 26 ans). La vaccination contre les HPV n’est pas organisée : le vaccin est majoritairement prescrit par un médecin généraliste. En 2017, le taux de couverture vaccinale des jeunes filles de 16 ans était de 21,4% (schéma complet). Il s’agit d’un des plus faibles taux de couverture vaccinale (CV) parmi les pays qui ont recommandé cette vaccination. Le dépistage du cancer du col de l’utérus est organisé et recommandé à toutes les femmes de 25 à 65 ans, aujourd’hui par cytologie.
Le plan cancer 2014-2019 s’est donné pour objectif d’« améliorer le taux de couverture de la vaccination par le vaccin anti-papillomavirus en renforçant la mobilisation des médecins traitants et en diversifiant les accès, notamment avec gratuité, pour les jeunes filles concernées » (action 1.2). Dans ce cadre, l’Institut national du cancer (INCa) a conduit une évaluation médico-économique permettant d’estimer, dans le contexte du DO du CCU, l’efficience associée à une augmentation de la CV contre les HPV à des niveaux plus élevés (50%, 70%, 85%) en tenant compte des cas de lésions précancéreuses, CCU et décès par CCU qui pourraient être évités.
Matériel et méthode
Le modèle médico-économique utilisé est un modèle de micro-simulation qui reproduit l’histoire naturelle du CCU à l’échelle individuelle afin de tenir compte des interactions entre l’histoire naturelle de la maladie, la vaccination, le dépistage et la prise en charge des lésions. Il a fait l’objet d’une première publication par l’INCa en 2017 pour comparer les stratégies de dépistage du CCU possibles en termes d’impact épidémiologique et d’efficience 8. La méthodologie détaillée a été déjà publiée 9. Dans le cadre de cette étude, ce modèle a été adapté afin de modéliser différents scénarios de CV et les données d’efficacité de prévention des infections à HPV oncogènes chez les personnes vaccinées.
L’INCa a constitué et réuni un groupe d’appui scientifique afin de l’appuyer sur les choix méthodologiques, la mise en œuvre et les résultats de l’analyse et de l’évaluation médico-économique.
Intégration de la vaccination à la structure du modèle
La structure du modèle était celle initialement développé par Demarteau et coll. 10, adaptée au contexte français et à la modélisation du dépistage. La simulation de l’histoire naturelle de la maladie s’appuyait sur le passage des femmes à travers des états de santé mutuellement exclusifs et collectivement exhaustifs, sur des cycles d’une durée d’un an (figure 1).
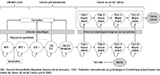 Agrandir l'image
Agrandir l'imageLa vaccination a été intégrée au modèle sous la forme d’une réduction de l’incidence des infections HPV à haut risque oncogène chez les femmes vaccinées par le vaccin nonavalent. Au début de la simulation, le modèle déterminait si une femme était vaccinée (deux doses) à 14 ans selon la CV définie dans le scénario.
Les critères de résultats principaux étaient la survie et les années de vie ajustée par la qualité de vie (QALY) associant survie et qualité de vie liée à l’état de santé exprimée sous forme d’utilités reflétant les préférences de la population générale. Le nombre de cancers et lésions précancéreuses CIN2/3 diagnostiqués, de colposcopies et de conisations réalisées constituaient des critères secondaires. L’efficience a été évaluée au moyen du rapport différentiel coûts-résultats (RDCR), qui permet d’apprécier le coût par unité de résultat gagné ou évité supplémentaire (coût pour une année de vie ajustée sur la qualité de vie ou par QALY gagnée, par lésion précancéreuse diagnostiquée, par décès/cancer du col/hystérectomie évités, etc.).
Population simulée
Le modèle générait une cohorte de femmes de 14 ans (recommandation pour l’âge de la vaccination) qui était suivie sur un horizon temporel vie entière jusqu’à la disparition de la cohorte. La perspective était la perspective collective tous payeurs (incluant l’État, l’Assurance maladie, les assurances complémentaires de santé et les femmes).
Paramètres principaux liés à la vaccination
L’analyse proposée compare les coûts et les résultats de santé attendus pour la couverture vaccinale actuelle d’une cohorte de femmes de 14 ans, à ceux obtenus avec des taux de couverture vaccinale supérieurs (50%, 70%, 85%) obtenus grâce à des campagnes de communication à large échelle.
L’efficacité du vaccin nonavalent est fondée sur l’hypothèse d’une efficacité de 97% pour les génotypes responsables de 88,3% des cancers du col de l’utérus, correspondant à un risque relatif d’infection de 0,143 chez les femmes vaccinées par rapport aux non vaccinées 11,12.
Un paramètre de durée de protection, c’est-à-dire de durée d’efficacité de la vaccination contre les HPV, a été inclus dans le modèle. Les analyses sont présentées avec une protection limitée à 20 ans (analyse de référence) et selon une hypothèse d’une protection vie entière (scénario complémentaire). Aucune donnée n’est disponible dans la littérature pour estimer la durée de protection du vaccin nonavalent avec 2 doses. Toutefois, les données actuelles ont montré une durée de protection du vaccin quadrivalent d’au moins 10 ans, avec une tendance jusqu’à 12 ans pour l’administration de 3 doses 13.
Pour prendre en compte la disparité de la vaccination selon le statut socioéconomique, un risque relatif de vaccination chez les femmes bénéficiant de la couverture maladie universelle complémentaire (CMU-C) et celles n’en bénéficiant pas (non CMU-C) a été intégré au modèle (rapport de prévalence (RP) : 0,704). Ce RP a été déterminé à partir de la part des filles ayant reçu un schéma complet avant 16 ans pour les cohortes de jeunes filles nées entre 1997 et 2000 (n=1 417 369), selon leur statut CMU-C (travaux réalisés par Santé publique France à partir des données de consommation inter-régimes (DCIR) de l’assurance maladie pour la période 2007-2016 ; données non publiées).
Paramètres principaux liés au dépistage
Lors de la réalisation de la modélisation, la révision récente des recommandations de la Haute Autorité de santé (HAS) sur le dépistage du cancer du col de l’utérus (ex. : dépistage par test HPV à partir de 30 ans) n’était pas encore publiée 14. Dans ce modèle, les femmes de 25 à 35 ans réalisaient le dépistage par frottis tous les trois ans et les femmes de plus de 35 ans réalisaient un test HPV tous les cinq ans (test de recherche d’ADN HPV), et non à 30 ans comme dans les nouvelles recommandations de la HAS. Le taux de participation au dispositif de dépistage était celui attendu lors de la mise en place du DO : les femmes invitées avaient une probabilité de participer (par frottis et par test HPV) après invitation estimée à partir des données des expérimentations réalisées au sein de 13 départements entre 2010 et 2014 (soit un taux de participation de 72,5% à cinq ans) 15, ajustée sur l’âge et le statut CMU-C (tableau 1).
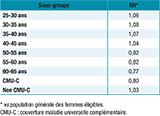 Agrandir l'image
Agrandir l'imageLes coûts pris en compte
L’évaluation des coûts a identifié toutes les ressources mobilisées dans le cadre du dépistage et du traitement de la population dépistée et/ou malade. Les ressources ont été valorisées selon leur coût de production (coûts directs uniquement). Les coûts et les résultats ont été actualisés au taux annuel de 4% et après 30 ans à 2%. Les coûts de prise en charge des cancers par stade de sévérité sont issus du modèle de Dervaux et coll. 16. La valorisation des autres coûts et consommation de ressources a été effectuée à partir des tarifs de l’Assurance maladie et des données issues des expérimentations 17. Les valeurs d’utilités et désutilités, associées aux états de santé, aux actes diagnostiques réalisés, à l’attente des résultats des tests de dépistage, sont issues de la littérature française et internationale 10,18,19. En outre, par hypothèse, les femmes ayant un CCU voient leur qualité de vie affectée à partir du diagnostic ou de l’apparition des symptômes du cancer pendant 15 ans. Enfin, en complément de l’analyse de référence, des analyses de sensibilité sur la durée de protection du vaccin et le prix du vaccin ont été réalisées.
Le coût de la vaccination tient compte du coût total pour l’administration (deux consultations) et l’acquisition des deux doses (135,68 € par dose), soit 324,16 € par femme vaccinée. Pour les scénarios avec une CV de 50%, 70% et 85%, un coût additionnel a été intégré, représentant le coût d’une campagne de communication à large échelle permettant d’atteindre ces niveaux de couverture élevés. L’hypothèse d’un coût de campagne de communication identique à celui de la campagne pour la vaccination contre la grippe répétée sur quatre années (sur la période d’éligibilité à la vaccination, les jeunes filles de 11 à 14 ans seront sensibilisées quatre fois) a été retenue, soit 1,8 millions d’euros. En l’absence de données françaises, ce modèle n’a pas pu introduire de coûts supplémentaires associés aux stratégies d’augmentation de la couverture vaccinale HPV et de correction des inégalités de santé (coût organisationnel notamment).
Scénarios comparés
Différents scénarios ont été analysés et comparés à la situation de CV actuelle de 21,4% pour le vaccin nonavalent. Les scénarios sont les suivants :
–impact de l’augmentation de la CV sur les bénéfices de santé additionnels ;
–impact de l’augmentation de la CV conjuguée à la correction des inégalités de CV (RR vaccination femmes bénéficiaires CMU-C par rapport aux non bénéficiaires=1).
Chaque scénario est décliné selon cinq hypothèses de CV où les jeunes femmes ont reçu le schéma complet à 14 ans :
–absence de vaccination (cas du Japon où le taux de CV est quasi nul suite à une controverse) ;
–couverture actuelle (21,4%) ;
–couverture États-Unis (50%) ;
–couverture Nouvelle-Zélande (70%) ;
–couverture Portugal/Royaume-Uni (85%).
Les résultats des scénarios sont présentés selon deux hypothèses concernant :
–la durée de protection du vaccin : protection limitée à 20 ans (analyse de référence) et vie entière (analyse de sensibilité) ;
–le prix du vaccin : prix actuel français (analyse de référence) et prix moyen européen du vaccin de 49,1 €/dose calculé à partir des données de 15 pays (analyse de sensibilité) 20. La différence de prix peut notamment s’expliquer par la réalisation d’appels d’offres dans les autres pays et le processus français d’établissement des prix des médicaments par le Comité économique des produits de santé.
Résultats
Bénéfices de santé additionnels de l’augmentation de la couverture vaccinale (durée de protection du vaccin de 20 ans)
Dans le contexte du DO, il est estimé, pour une cohorte de 389 003 jeunes filles non vaccinées (nombre de jeunes filles de 14 ans au 1er janvier 2018), une incidence de 396 décès par CCU, 1 276 CCU, 8 118 lésions précancéreuses CIN 2/3 diagnostiquées et 10 499 conisations.
Les résultats montrent une diminution plus importante du nombre de cas et d’actes dans les scénarios avec correction des inégalités par rapport aux scénarios d’augmentation de la CV seule.
En comparaison à la situation actuelle (CV de 21,4%), une augmentation de CV jusqu’à 85% avec correction des inégalités permettrait d’éviter a minima, par cohorte annuelle de femmes de 14 ans : 2 546 conisations (réduction du risque de 26%), 2 347 lésions précancéreuses CIN2/3 diagnostiquées (réduction du risque de 31%), 377 CCU (réduction du risque de 32%), 139 décès par CCU (réduction du risque de 39%) (durée de protection du vaccin de 20 ans) (tableau 2).
 Agrandir l'image
Agrandir l'imageÉvaluation de l’efficience des stratégies (durée de protection du vaccin de 20 ans)
Les deux analyses de l’efficience que nous rapportons sont : une comparaison par rapport à la situation actuelle, où par définition la CV à 21,4% sert de référence dans la détermination du RDCR des stratégies, et une analyse de l’efficience classique basée sur la constitution de la frontière d’efficience 21 où la stratégie de référence est la stratégie la moins chère non dominée, c’est-à-dire l’absence de vaccination dans le cas présent.
Toutes les stratégies évaluées sont associées à un RDCR inférieur à 15 000 €/QALY (tableau 3), confirmant l’efficience des stratégies d’augmentation de la CV pour la prévention du cancer du col de l’utérus, au regard des seuils d’efficience de communément admis à l’international 22 (aucune valeur de seuil d’efficience n’ayant été définie en France). Ainsi, l’augmentation de la CV (en prenant en compte les coûts du vaccin, des consultations et des campagnes de vaccination dédiées) est une stratégie efficiente.
 Agrandir l'image
Agrandir l'imageLes scénarios basés sur l’augmentation de la CV avec correction des inégalités sont les plus coûtefficaces et constituent la frontière d’efficience. Les résultats d’efficience des scénarios dans l’analyse de référence sont présentés sur le plan coût-efficacité pour 10 000 femmes (figure 2). La frontière d’efficience est constituée des scénarios avec correction des inégalités et CV de 21,4%, 50%, 70% et 85%.
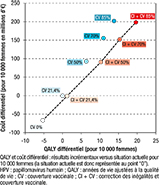 Agrandir l'image
Agrandir l'imageLes femmes CMU-C sont celles qui ont aussi un recours au dépistage moins fréquent et sont ainsi plus à risque d’évolution de lésions ou cancers car non détectés. La vaccination de ces femmes dégage alors des économies de soins associées à ces états. Le scénario de correction des inégalités permettrait une économie supplémentaire de 2,3 millions à 3,5 millions d’euros (dépenses de santé évitées) par rapport au scénario sans correction des inégalités selon le taux de CV :
–2 346 002 € pour une CV de 50% représentant 4% des coûts liés à la vaccination pour la cohorte ;
–2 532 285 € pour une CV de 70% représentant 3% des coûts liés à la vaccination pour la cohorte ;
–3 481 443 € pour une CV de 85% représentant 3% des coûts liés à la vaccination pour la cohorte.
Les résultats présentés ci-dessus sont issus de l’hypothèse conservatrice d’une durée de protection du vaccin limitée à 20 ans, sous-estimant l’efficience du vaccin si sa durée de protection était vie entière.
Analyse de sensibilité (durée de protection du vaccin vie entière)
L’hypothèse d’une protection vie entière du vaccin aboutit à une augmentation de l’impact de la vaccination sur le nombre de cancers évités et une diminution du coût par cancer évité par rapport au scénario de durée de protection 20 ans (tableau 4).
 Agrandir l'image
Agrandir l'imageEn comparaison de l’analyse de référence (durée de protection du vaccin limitée à 20 ans), l’impact de l’augmentation de la CV pour une durée de protection du vaccin vie entière sur la réduction du risque de cancer est multiplié par deux, y compris dans les stratégies de correction des inégalités : par rapport à la CV de 21,4%, les résultats montrent une diminution du risque de cancer jusqu’à 47% (sans correction des inégalités versus 22% dans l’analyse de référence) ou 66% (avec correction des inégalités versus 32% dans l’analyse de référence).
En comparaison à la situation actuelle (CV de 21,4%), une augmentation de CV jusqu’à 85% avec correction des inégalités permettrait d’éviter a minima, par cohorte annuelle de femmes de 14 ans : 4 863 conisations, 4 632 lésions précancéreuses CIN2/3 diagnostiquées, 731 CCU, 222 décès par CCU (protection du vaccin de 20 ans). Pour chaque cohorte, l’incidence résiduelle de ces cas et actes serait de 115 décès par CCU, 369 CCU, 2 407 lésions précancéreuses CIN 2/3 diagnostiquées et 4 507 conisations.
Prix européen du vaccin
Le prix du vaccin a un impact sur les résultats d’efficience. Si le prix du vaccin en France était identique au prix moyen européen (49,1 € par dose au lieu de 135,68 €), le ratio différentiel coût-résultat (RDCR) serait 2,2 fois plus faible pour chacun des scénarios mentionnés dans le tableau 3.
Discussion
L’étude montre que l’augmentation de la CV contre les papillomavirus (comprenant le coût du vaccin, des consultations et d’une campagne de communication dédiée) est une stratégie efficiente, même en tenant compte uniquement de la seule prévention des cancers du col de l’utérus.
Les stratégies basées sur la correction des inégalités démontrent l’intérêt du renforcement de la CV chez ces femmes. Du fait de leur moindre participation au dépistage du CCU, les bénéficiaires CMU-C ont une plus grande probabilité d’avoir des lésions de bas grade et précancéreuses (CIN2/3) susceptibles d’évoluer en cancers du col de l’utérus avant d’être dépistées. Ainsi, le scénario « correction des inégalités et atteinte d’une couverture vaccinale de 70% » est plus coût-efficace que le scénario CV de 85% (réduction du risque de 25% pour un surcoût de 155 € par femme versus une réduction du risque de 22% pour un surcoût de 204 € par femme) 23, montrant l’importance de mener une politique de lutte contre les inégalités de santé dans ce domaine en particulier.
L’hypothèse de la durée de protection du vaccin a un impact important sur les résultats. En effet, le nombre de lésions diagnostiquées, de CCU et de décès évités par CCU serait multiplié par deux dans un scénario de protection vie entière plutôt que 20 ans.
Comparaisons aux résultats d’autres modélisations publiées
Une étude française a déterminé la perte de chance relative à la faible CV française (17%) par rapport à une CV de 70%, mais avec le vaccin quadrivalent et un modèle dynamique. L’étude conclut à l’intérêt de la vaccination et la perte de chance associée à la CV actuelle avec une diminution de risque de cancer du col de l’utérus de 67% 24. Le modèle présenté ici trouve une réduction du risque comparable (de 60%) selon le scénario « CV de 70% avec correction des inégalités et durée de protection vie entière ». La réduction du risque avec le vaccin nonavalent aurait dû être supérieure à celle induite par le vaccin quadrivalent. Cependant, le différentiel de la réduction du risque peut s’expliquer par la non-prise en compte des inégalités de participation au dépistage dans le modèle de Uhart et coll. 24.
Une étude italienne conclut à une diminution du risque de cancer de 76% (vaccin nonavalent) supérieure à celui de notre modèle et qui peut s’expliquer par un taux de participation au dépistage par frottis plus élevé en Italie (77%) et qu’il s’agisse d’un modèle dynamique sur un horizon temporel de 100 ans 25.
Limites méthodologiques de ce modèle
L’analyse présente les limites inhérentes à la structure, aux données d’entrée du modèle, à certaines hypothèses intentionnellement conservatrices, pour éviter toute surestimation des bénéfices de la vaccination contre les HPV, et au manque de données disponibles, notamment celles relatives aux corrections des inégalités et aux coûts de campagne de communication.
Une première limite méthodologique de ce modèle concerne l’approche non dynamique de la circulation du virus et de sa transmission (hommes-femmes). Une deuxième porte sur les données de probabilités de transition. En effet, la littérature est relativement hétérogène et la probabilité varie d’un modèle à l’autre. Toutefois, le modèle a été calibré et validé sur les données épidémiologiques disponibles 9. De plus, ce modèle ne prend pas en compte la moindre performance probable du dépistage par cytologie chez les femmes vaccinées comme cela est suggéré dans la littérature 26. Par ailleurs, il n’a pas été introduit la possibilité d’un rappel pour l’analyse de la protection vie entière du vaccin, car les données publiées ne montrent pas encore de baisse de l’immunogénicité après 12 ans.
Par ailleurs, un certain nombre de limites inhérentes au modèle sont conservatrices, c’est-à-dire qu’elles sous-estiment les bénéfices de la vaccination contre les HPV. Ce modèle ne permet pas de prendre en compte les effets d’immunité de groupe qui ont été démontrés dans la littérature 27. L’efficacité du vaccin en serait renforcée par une moindre circulation du virus et une protection indirecte des individus non vaccinés. De plus, ce modèle surévalue la prévalence des HPV après 34 ans (modélisée à partir des femmes non vaccinées) pour le scénario « Durée de protection du vaccin limitée à 20 ans » : la prévalence à 34 ans chez les femmes non vaccinées est surestimée car on ne modélise pas l’impact de la moindre circulation du HPV sur la dynamique de l’infection. Par ailleurs, le modèle ne prend pas en compte la protection conférée par une seule dose de vaccin qui commence à être documentée 28. De plus, le modèle n’intègre pas l’effet de la vaccination sur les autres pathologies liées aux infections HPV : cancers de l’anus, de l’oropharynx, de la vulve, du vagin, de la cavité orale, du pénis ainsi que les condylomes (verrues anogénitales), ni les coûts associés. Malgré la non-prise en compte de coûts liés aux effets indésirables du vaccin (syncopes en particulier), il est donc attendu que les résultats présentés sous-estiment l’efficience de la vaccination.
Par ailleurs, d’autres limites non conservatrices sont à souligner. Le coût de campagne de communication est identique pour tous les taux de couverture vaccinale et ce coût de campagne de communication peut être sous-estimé. De plus, aucun coût supplémentaire n’a été inclus pour les scénarios relatifs à la correction des inégalités. Or, des ressources plus importantes doivent être mobilisées pour les interventions ciblant des populations difficiles à atteindre. Finalement, le seul recours à l’indicateur CMU-C ne permet pas de mesurer tous les déterminants socioéconomiques qui ont un impact sur la participation au dépistage du cancer du col de l’utérus. Il reste néanmoins un indicateur pertinent pour appréhender les inégalités de santé.
Enfin, les résultats de ce modèle reposent sur des stratégies de dépistage définies pour les femmes non vaccinées voire peu vaccinées.
En conclusion, l’augmentation de la CV contre les papillomavirus est une stratégie efficiente, même lorsque l’on ne considère son efficacité qu’en prévention du cancer du col de l’utérus et même en choisissant pour le modèle des paramètres « conservateurs », en particulier : la protection du vaccin sur une durée réduite à 20 ans, l’existence d’inégalités d’accès au dépistage et à la vaccination, le prix du vaccin actuel.
À terme, l’évolution des stratégies de dépistage pour des cohortes de jeunes filles fortement vaccinées devra être envisagée (espacement des intervalles de dépistage) et rendra ainsi la stratégie globale de prévention du cancer du col de l’utérus (dépistage et vaccination) encore plus efficiente.
Ce modèle est l’un des rares qui prenne en compte les inégalités de participation au dépistage et de vaccination HPV. Les résultats mettent en lumière la nécessité d’agir sur la réduction de ces déterminants à travers les mesures politiques de la vaccination contre les HPV.
L’étude permet d’apprécier les pertes de chances liées au faible niveau de CV actuelle et chiffre les investissements qui pourraient être dédiés à des stratégies efficaces et ambitieuses pour réduire les inégalités et augmenter la couverture vaccinale. Ce pourrait être la diversification et la simplification de l’accès au vaccin, voire l’organisation d’un programme de vaccination, que cela soit réalisé en milieu scolaire ou non. L’article de V. Campana et coll. dans ce numéro du BEH synthétise les interventions les plus efficaces pour augmenter la CV : « Les approches multi-composantes, combinant des stratégies d’action différentes et ciblant à la fois les jeunes, les parents et les professionnels de santé semblent avoir les meilleurs résultats sur la couverture vaccinale ». Une autre alternative serait la mise en place de la vaccination en milieu scolaire, comme l’a recommandé le Haut Conseil de la santé publique en 2014 29.
Remerciements
Les auteurs remercient les membres du groupe d’appui scientifique réuni par l’INCa afin d’apporter des avis sur les choix méthodologiques, la mise en œuvre et les résultats de l’analyse et de l’évaluation médico-économique : AS Barret (Santé publique France), M. Bonneault (Université de Versailles Saint-Quentin-en-Yvelines), Dr FF. Hamers (Santé publique France), Dr D. Levy-Bruhl (Santé publique France), Pr. JL Prétet (Centre national de référence Papillomavirus)
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article. Marc Massetti et Henri Leleu ont reçu des financements de MSD sur des projets autres que le vaccin contre les HPV.
Références
evaluation-de-la-recherche-des-papillomavirus-humains-hpv-en-depistage-primaire-des-lesions-precancereuses-et-cancereuses-du-col-de-l-uterus-et-de-la-place-du-double-immuno-marquage-p16/ki67




