Cancer du col de l’utérus en France : tendances de l’incidence et de la mortalité jusqu’en 2018
// Cervical cancer in France: incidence and mortality trends until 2018
Résumé
L’objectif de cet article est de dresser un état des lieux du fardeau du cancer du col de l’utérus (CCU) en France et des tendances d’incidence et de mortalité à partir des estimations les plus récentes au niveau national et infranational. En 2018, en France métropolitaine, le nombre de nouveaux diagnostics de CCU est estimé à 2 920 et le nombre de décès par CCU à 1 117. Les estimations d’incidence territoriales révèlent une hétérogénéité géographique importante. La diminution de l’incidence et de la mortalité observée depuis plusieurs décennies se poursuit, mais à un rythme décroissant. Les analyses d’incidence par âge et cohorte de naissance indiquent que le ralentissement de la baisse de l’incidence est probablement dû à une augmentation de l’exposition aux papillomavirus humains à haut risque oncogène (HPV-HR), résultant de modifications dans les comportements sexuels. Les données suggèrent que l’impact de l’augmentation de la transmission du HPV-HR sur l’incidence et la mortalité du CCU a été contrebalancée par l’effet du dépistage mais que cet effet s’essouffle et qu’il existe un risque d’inversion des tendances. Une meilleure couverture de la vaccination contre le HPV, jusqu’ici très insuffisante (<25%), combinée à un programme de dépistage organisé fondé sur le test HPV est indispensable à l’élimination du cancer du col de l’utérus, déclarée priorité de santé publique par l’Organisation mondiale de la santé.
Abstract
The objective of this paper is to provide an overview of the burden of cervical cancer (CC) in France and trends in incidence and mortality using the latest national and subnational estimates. In 2018, 2,920 cervical cancer cases and 1,117 deaths were estimated in mainland France. Regional CC incidence estimates show marked geographic disparities. Decreasing trends in CC incidence and mortality observed for several decades are continuing, but at a decreasing rate. Age and birth cohort analyzes indicate that the slowing of the decline in incidence is likely due to an increase in exposure to high-risk oncogenic human papillomavirus (HPV-HR) resulting from changes in sexual behaviours. The data suggest that the impact of increased HPV-HR transmission on CC incidence and mortality was offset by the effect of screening, but that this effect is fading with a risk of reversal of trends. Achieving a higher HPV vaccine coverage, so far very insufficient (<25%), combined with an organized screening programme based on the HPV test is needed for the elimination of cervical cancer, which has been declared public health priority by the World Health Organization.
Introduction
Avec environ 570 000 cas et 311 000 décès en 2018 dans le monde, le cancer du col de l’utérus (CCU) est l’un des cancers féminins les plus fréquents, aussi bien en termes d’incidence que de mortalité 1. Les pays où l’on trouve les taux d’incidence les plus élevés sont principalement situés en Afrique subsaharienne, mais aussi en Amérique latine, dans les Antilles et en Asie du Sud-Est 1,2. À l’exception des pays baltes, de la Roumanie et de la Bulgarie 3, l’Europe est une région du monde où le fardeau du CCU est faible. La France se situe au 8e rang des pays de l’Union européenne (EU), avec les taux d’incidence les plus bas, et au 15e rang en termes de mortalité 4.
En France, comme dans la majorité des autres pays industrialisés, l’incidence et la mortalité par CCU ont considérablement diminué au cours des dernières décennies 5,6,7,8. Cette diminution est attribuée à l’utilisation à large échelle du dépistage cytologique par frottis cervico-utérin 9. En effet, de tous les cancers, le CCU est celui qui peut être le plus efficacement contrôlé par un dépistage qui permet la détection et le traitement des lésions précancéreuses, prévenant ainsi le développement du CCU. Les deux principaux types histologiques de CCU sont les carcinomes épidermoïdes, qui représentent 75 à 90% des CCU dans les pays industrialisés, et les adénocarcinomes 5,10. Le dépistage par cytologie est moins efficace pour la prévention des adénocarcinomes que des carcinomes épidermoïdes 11.
Une infection persistante par un papillomavirus humain à haut-risque oncogène (HPV-HR), transmis par voie sexuelle, est la condition nécessaire au développement de quasiment tous les CCU 12. Les génotypes les plus fréquemment associés au CCU sont les HPV-HR 16 et 18. Le HPV-HR 16 est associé à un risque de cancer 10 fois supérieur aux autres génotypes de HPV-HR. L’infection par un HPV-HR est favorisée par la multiplicité des partenaires. La persistance de l’infection par un HPV-HR au niveau du col de l’utérus, et sa transformation vers des lésions précancéreuses et un cancer, est favorisée par une parité élevée, le tabagisme, la contraception orale et une baisse de l’immunité 13. L’infection à HPV peut être prévenue par la vaccination.
L’objectif de cet article est de dresser un état des lieux du fardeau du CCU en France et des tendances de l’incidence et de la mortalité à partir des estimations les plus récentes au niveau national et infranational, ainsi que des données observées dans l’ensemble des départements couverts par des registres de cancers.
Matériels et méthodes
La surveillance épidémiologique des cancers s’appuie en France sur les registres des cancers et sur un partenariat associant le Réseau des registres des cancers français (Francim), le service de biostatistique-bioinformatique des Hospices civils de Lyon (HCL), Santé publique France et l’Institut national du cancer (INCa). Les registres des cancers, créés progressivement depuis les années 1970, ne couvrent pas l’ensemble du territoire. En France métropolitaine, leur couverture est d’environ 20% de la population. Dans les territoires français ultra-marins, plusieurs registres existent, notamment en Guadeloupe, Guyane et Martinique. Pour les territoires non couverts par les registres, l’incidence des cancers est estimée.
Les estimations les plus récentes concernant le CCU, reprises dans cet article, incluent (i) des estimations nationales d’incidence et de mortalité en France métropolitaine de 1980 à 2018 14 et (ii) des estimations régionales et départementales d’incidence pour la période 2007-2016 15. L’article présente également des données observées (non modélisées) pendant la période 2005-2014, issues de l’ensemble des registres de cancers Francim (zone registre), sur les lésions précancéreuses et sur les types histologiques. Les lésions précancéreuses, répertoriées par les registres de cancers, présentées dans cet article, incluent les lésions malpighiennes intraépithéliales de haut grade (CIN3) et les adénocarcinomes in situ.
Les méthodes d’estimation d’incidence et de mortalité par cancer ont été décrites en détail ailleurs 14,15. En résumé, l’incidence nationale pour la France métropolitaine est modélisée à partir des données provenant de 15 registres (19 départements). La méthode repose sur l’hypothèse que la zone géographique constituée par les registres est représentative de la France métropolitaine en termes d’incidence des cancers. Pour les territoires de France métropolitaine, les estimations d’incidence départementales et régionales sont réalisées à partir de données médico-administratives en utilisant un modèle de calibration 15. En résumé, le rapport entre le nombre d’hospitalisations incidentes pour CCU identifiées dans le Programme de médicalisation des systèmes d’information (PMSI) et le nombre de cas incidents observés dans les départements avec registre est utilisé pour redresser les données PMSI observées dans chaque département. Le modèle a permis d’estimer le nombre annuel moyen de nouveaux diagnostics et l’incidence annuelle moyenne (taux brut et taux standardisé sur la population mondiale) du CCU pour la période 2007-2016. Le ratio du taux d’incidence standardisé (SIR), dans une zone géographique donnée (département ou région), est le rapport entre le nombre de cas incidents estimés et le nombre attendu de cas si les taux d’incidence par âge dans cette zone géographique étaient identiques à ceux de la France métropolitaine. Par exemple, un SIR de 1,2 dans un département représente 20% de cas supplémentaires par rapport à ce qu’on attendrait si les taux d’incidence par âge du département étaient égaux aux taux nationaux. Au contraire, un SIR de 0,8 représente 20% de cas en moins. Pour les départements/régions d’outre-mer (DROM), les estimations d’incidence annuelle moyenne sont produites à partir des données observées dans les registres des cancers de Guadeloupe (période 2008-2014), Martinique (2007-2014) et Guyane (2010-2014) pour chacun de ces trois DROM 16.
La mortalité par cancer est calculée à partir des données de mortalité issues des causes médicales de décès de l’Institut national de la santé et de la recherche médicale (CépiDc-Inserm). Les données de mortalité couvrent l’ensemble du territoire national. Du fait du nombre important de décès par « cancers de l’utérus sans autre indication » ne différenciant pas col et corps utérin, la mortalité par CCU est estimée au niveau national à partir de l’ensemble des décès par cancer de l’utérus selon une méthode décrite précédemment 17. Cette estimation n’est pas réalisable à l’échelle infranationale.
Afin de faciliter des comparaisons internationales et au cours du temps, les taux d’incidence et de mortalité sont standardisés sur l’âge en utilisant la population mondiale standard (taux standardisé monde [TSM]) 18, comme le fait le Centre international de recherche sur le cancer (Circ). Les estimations nationales pour les années 2016 à 2018 sont des projections réalisées à partir de données observées jusqu’en 2015.
Résultats
Cancer du col de l’utérus en France en 2018
En 2018, en France métropolitaine, le nombre de nouveaux diagnostics de CCU est estimé à 2 920. Le taux d’incidence standardisé monde (TSM) est de 6,1 pour 100 000 personnes-années (PA). Avec 1 117 décès par CCU, le taux de mortalité (TSM) est de 1,7 pour 100 000 PA (tableau). Ce cancer touche des femmes relativement jeunes. En 2018, 40% des cas ont été diagnostiqués chez des femmes de moins de 50 ans, l’âge médian au diagnostic était de 53 ans et l’incidence la plus élevée était observée chez les femmes âgées de 45 à 49 ans (18,0 pour 100 000 PA).
(pour 100 000 personnes-années), estimations France métropolitaine, 2018
 Agrandir l'image
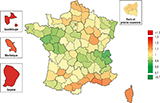
Agrandir l'imageDisparités territoriales, 2008-2016
Les estimations d’incidence territoriales révèlent une hétérogénéité géographique importante (figure 1). Comparé au taux d’incidence en France métropolitaine (TSM annuel moyen pour la période 2008-2016 : 6,6 pour 100 000 PA), il existe une sur-incidence qui dépasse les 10% par rapport à la moyenne nationale sur le pourtour méditerranéen (Bouches-du-Rhône, Var, Gard, Hérault) et en Côte-d’Or. L’incidence est plutôt inférieure à la moyenne nationale dans les Pays de la Loire (Loire-Atlantique, Maine-et-Loire, Mayenne) et en Auvergne-Rhône-Alpes (Haute-Savoie, Savoie, Ain, Isère). Au total, 10 départements ont une incidence estimée inférieure d’au moins 10% à la moyenne nationale.
et Guyane (2010-2014) ; la référence est le taux pour la France métropolitaine (SIR=1)
 Agrandir l'image
Agrandir l'imagePar région, on observe une sur-incidence en Corse, Provence-Alpes-Côte d’Azur, Hauts-de-France et Occitanie et une sous-incidence en Auvergne-Rhône-Alpes et Pays de la Loire. Dans les DROM, le nombre de nouveaux cas annuel moyen est de 28 cas en Guadeloupe, 26 en Martinique et 25 en Guyane. En comparaison avec la France métropolitaine, l’incidence est supérieure en Guadeloupe (8,7 pour 100 000 PA) et très largement supérieure en Guyane (22,4) ; en Martinique, l’incidence (7,2) n’était pas statistiquement différente de celle de la France métropolitaine.
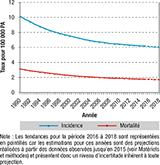
Tendances de l’incidence et de la mortalité, 1990-2018
L’incidence et la mortalité par CCU n’ont cessé de diminuer depuis 1990 (figure 2). Le nombre annuel de nouveaux cas de CCU est passé de 3 990 en 1990 à 2 920 en 2018. Le taux d’incidence (TSM) a diminué à un rythme annuel moyen de 1,8%, passant de 10,2 pour 100 000 PA à 6,1 au cours de cette même période, avec cependant un ralentissement de cette diminution depuis 2005. La mortalité a suivi une évolution similaire à celle de l’incidence avec une diminution du taux de mortalité (TSM) de 2,1% en moyenne par an entre 1990 et 2018 (3,1 pour 100 000 en 1990 contre 1,7 en 2018) et un ralentissement de cette diminution depuis 2005 (figure 2).
 Agrandir l'image
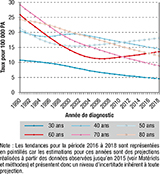
Agrandir l'imageL’évolution du taux d’incidence au cours de la période 1990-2018 est variable selon l’âge (figure 3). La diminution du taux d’incidence entre 1990 et 2018 est plus marquée pour les femmes les plus âgées (≥70 ans) et pour les plus jeunes (<35 ans). Cette tendance globale à la baisse est observée, sauf aux âges intermédiaires (45-65 ans) pour lesquels la baisse s’arrête dans les années 2000-2005, l’incidence se stabilisant ensuite, avec une légère augmentation en fin de période observée depuis les années 2000. Une analyse par cohorte de naissance (de 1920 à 1950 ; données non présentées) montre que le risque d’être atteinte d’un CCU entre 0 et 74 ans diminue fortement avec les cohortes de naissance : il passe de 1,9% pour la cohorte 1920 à 0,6% pour celle de 1950. L’analyse montre également une diminution importante du taux d’incidence par âge dans les cohortes successives jusqu’à la cohorte de femmes nées en 1950 chez qui les tendances s’inversent à partir de 50 ans.
estimations France métropolitaine, 1990-2018
 Agrandir l'image
Agrandir l'imageLésions précancéreuses et type histologique des cancers du col de l’utérus,
zone registre, 1990-2014
Les données observées par les registres de cancer Francim fournissent des informations plus détaillées sur le CCU pour la zone registre, notamment les données d’incidence des lésions précancéreuses et les données sur le type histologique de CCU.
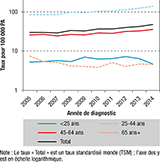
Le taux de lésions précancéreuses du col de l’utérus diagnostiquées a été calculé pour la période 2005-2014 (figure 4). Celui-ci a augmenté de manière importante, à un taux annuel moyen de 5,5% (intervalle de confiance à 95%, IC95%: [4,4%-6,6%]). Les taux les plus élevés sont retrouvés chez les femmes âgées de 25-44 ans (140 pour 100 000 PA en 2014) chez qui le taux d’incidence a augmenté de 5,7% [4,4%-7,0%] en moyenne par an. Chez les femmes âgées de 45-65 ans l’augmentation annuelle moyenne était de 3,6% [1,9%-5,3%]. Chez les femmes les plus jeunes (<25 ans) et chez celles les plus âgées (≥65 ans), aucune évolution temporelle significative n’a été retrouvée.
 Agrandir l'image
Agrandir l'imageComme pour les estimations nationales, les données de la zone registre montrent une diminution du taux d’incidence du CCU depuis 1990. En 2014, le taux d’incidence des lésions précancéreuses du CCU était de 47,1 pour 100 000 PA, soit 7 fois plus élevé que celui du CCU (6,4 pour 100 000 PA).
En 2014, 75% des CCU étaient des carcinomes épidermoïdes et 18% des adénocarcinomes. L’évolution de l’incidence du CCU révèle des tendances divergentes selon le type histologique (figure 5). Alors que l’incidence des carcinomes épidermoïdes a diminué de 2,6% (IC95%: [-3,0% ;-2,2%]) par an en moyenne au cours de la période 1990-2014, l’incidence des adénocarcinomes a augmenté de 1,2% [0,4%-2,1%] par an au cours de cette même période. La proportion des adénocarcinomes parmi l’ensemble des CCU est passée de 10% à 18% entre 1990 et 2014.
pour 100 000 personnes-années (PA), selon le type histologique, zone registre, 1990-2014
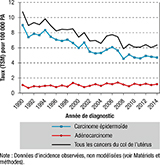 Agrandir l'image
Agrandir l'imageDiscussion
La diminution de la mortalité, observée depuis le début des années 1960 6, et de l’incidence du CCU, déjà documentée depuis que les premières estimations nationales ont été produites en France 8,19, se poursuit mais à un rythme décroissant. Malgré des tendances globales favorables, l’analyse par groupe d’âge indique un effet de cohorte, avec une diminution importante de l’incidence au cours des générations successives les plus âgées et une augmentation progressive du risque de CCU chez les femmes nées après la seconde guerre mondiale. Un tel effet de cohorte a été précédemment décrit en France (pour la mortalité) et ailleurs 6,20,21. Le ralentissement de la baisse de l’incidence et de la mortalité et l’effet de cohorte sont probablement dus à une augmentation de l’exposition aux HPV-HR et à une exposition à un âge plus précoce à ces virus, résultant de modifications dans les comportements sexuels des générations de femmes nées après la seconde guerre mondiale (libération sexuelle dans les années 1960-1970). Des études finlandaises réalisées à partir de biobanques de sérum de femmes enceintes indiquent que les HPV-HR se sont propagés de façon épidémique au cours des années 1980 et 1990, parallèlement à l’augmentation de l’activité sexuelle des femmes 22,23. En France, les enquêtes répétées entre 1970 et 2006 montrent des évolutions des comportements sexuels avec une diminution de l’âge aux premiers rapports sexuels, une augmentation du nombre de partenaires sexuels au cours de la vie et des modifications des pratiques 24, avec pour conséquences une augmentation de l’exposition aux HPV. L’augmentation de l’incidence d’autres cancers attribuables aux HPV-HR et en particulier du cancer de l’anus chez les femmes 14,25 est un autre argument indiquant une augmentation du risque d’exposition à ces virus.
Les lésions précancéreuses du col de l’utérus sont généralement asymptomatiques et leur diagnostic dépend de l’intensité et de la qualité du dépistage. L’augmentation de l’incidence de ces lésions observée dans les groupes d’âge ciblés par le dépistage pendant la période 2005-2014 est vraisemblablement due essentiellement à une augmentation de la circulation des HPV-HR et non à des modifications d’intensité ou de qualité de dépistage. En effet, au cours la période examinée, il n’y a pas eu de changement de modalités du dépistage en France et la couverture du dépistage dans la population cible n’a pas varié de manière importante 26. Les taux de lésions précancéreuses diagnostiquées chez les adolescentes et les jeunes femmes de moins de 25 ans doivent être interprétées avec prudence car le recours au dépistage dans cette tranche d’âge a diminué de manière importante, passant de 45% en 2006-2008 à 33% en 2012-2014 (estimations Santé publique France à partir de l’échantillon généraliste des bénéficiaires – EGB, non publiées), reflétant une amélioration progressive du respect des recommandations concernant l’âge du dépistage. Ces taux ne permettent pas d’estimer l’impact de la vaccination anti-HPV sur les lésions précancéreuses chez les jeunes filles, vaccinées à 14-17 ans lors de la mise sur le marché du vaccin en 2007, qui n’avaient que 21-24 ans en 2014 et par conséquent n’avaient pas encore atteint l’âge d’entrée dans le dépistage. Par ailleurs et en tout état de cause, il n’est pas certain qu’un impact de la vaccination sur les lésions précancéreuses puisse être décelé en France étant donné la faible couverture vaccinale (<25%).
La diminution de l’incidence du CCU reflète largement la diminution de l’incidence des carcinomes épidermoïdes, type histologique qui représente les trois quarts des CCU. Cette tendance générale masque l’augmentation de l’incidence des adénocarcinomes. Les données observées dans la zone registre montrent que l’incidence des adénocarcinomes a augmenté progressivement depuis 1990, avec un quasi doublement de la part relative des adénocarcinomes entre 1990 et 2014. Des tendances similaires sont observées dans la plupart des pays industrialisés 10.
Les données présentées ici suggèrent que l’impact de l’augmentation de la transmission du HPV sur l’incidence et la mortalité du CCU a été contrebalancé par l’effet du dépistage, mais que cet effet s’essouffle et qu’il existe un risque d’inversion des tendances. Le dépistage individuel (opportuniste), tel qu’il a existé en France jusqu’en 2018, n’était pas optimal. Un programme national de dépistage organisé du CCU est en cours de déploiement sur l’ensemble du territoire. À terme, il est prévu que ce dépistage soit fondé sur le test HPV pour les femmes de 30 ans et plus 27. En effet, il existe maintenant de nombreuses données probantes montrant que le dépistage par test HPV offre une meilleure protection contre le CCU que le dépistage par cytologie chez ces femmes 28. Ce gain en efficacité serait en outre supérieur contre l’adénocarcinome que contre le carcinome épidermoïde 29.
L’obtention d’une meilleure couverture vaccinale, jusqu’ici très insuffisante et une des plus faibles d’Europe, combinée à un programme de dépistage organisé fondé sur le test HPV sont indispensables à l’élimination du cancer du col de l’utérus, déclarée priorité de santé publique mondiale par l’Organisation mondiale de la santé (OMS). L’impact de la vaccination sur le CCU ne pourra commencer à être visible que plus de 10 ans après l’introduction des vaccins en raison du délai long entre l’infection par les HPV-HR et la survenue d’un cancer.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.
Références
articles/estimations-regionales-et-departementales-de-l-incidence-et-de-la-mortalite-par-cancer-en-france-2007-2016
estimations-regionales-et-departementales-de-l-incidence-et-de-la-mortalite-par-cancer-en-france-2007-2016
recueils-ouvrages-et-rapports/recueils-annuels/l-etat-de-sante-de-la-population/article/l-etat-de-sante-de-la-population-en-france-rapport-2017




