Sensibilité du test immunologique dans la détection des cancers invasifs dans le cadre du programme de dépistage du cancer colorectal en Isère (2015‑2018)
// Sensitivity of the immunochemical test for detecting invasive cancers within the colorectal cancer screening program in French department of Isère (2015-2018)
Résumé
Le test immunologique fécal (FIT) est utilisé dans le cadre du dépistage organisé du cancer colorectal (DOCCR) en France depuis 2015 afin de réduire l’incidence et la mortalité liées à ce cancer. Cependant, certains cancers, appelés cancers d’intervalle, peuvent survenir dans les deux années qui suivent un test négatif. Les objectifs de cette étude étaient d’évaluer la sensibilité du FIT et de décrire les caractéristiques des cancers d’intervalle.
Une étude rétrospective a été menée chez les participants au DOCCR dans le département de l’Isère entre 2015 et 2018. Les données du dépistage ont été croisées avec celles du registre du cancer pour identifier les cancers d’intervalle. La sensibilité du FIT a été calculée, et une régression logistique multivariée a identifié les facteurs associés à ces cancers particuliers.
Parmi 233 202 tests réalisés, 516 cancers ont été dépistés après un FIT positif, 118 cancers d’intervalle ont été diagnostiqués dans les deux années suivant un FIT négatif, et 5 après un FIT non analysable non refait. La sensibilité globale du FIT était de 80,8%. Elle était plus élevée pour les tumeurs coliques distales (91,8%) que pour les tumeurs proximales (70,7%) et les localisations rectales (78,0%). Les cancers d’intervalle étaient plus souvent diagnostiqués à un stade avancé. En analyse multivariée, une localisation proximale (odds ratio, OR=4,3) ou rectale (OR=3,3) était significativement associée à un risque accru de cancer d’intervalle.
Le FIT montre une bonne sensibilité globale, mais il est moins performant pour les localisations coliques proximales et rectales.
Abstract
The fecal immunological test (FIT) has been used in organized colorectal cancer screening (DOCCR) in France since 2015 in order to reduce the incidence and mortality associated with this cancer. However, some cancers can occur within two years after a negative FIT, known as interval cancers. The objectives of this study were to evaluate the sensitivity of the FIT and to describe the characteristics of interval cancers.
A retrospective study was realized among DOCCR participants in the Isère department between 2015 and 2018. Screening data were matched with cancer registry data to identify interval cancers. FIT sensitivity was calculated, and a multivariate logistic regression identified factors associated with interval cancers.
Among 233,202 tests performed, 516 colorectal cancers were detected after a positive FIT, 118 interval cancers were diagnosed within two years of a negative FIT, and 5 with cancers following an unprocessed FIT that was not repeated. The overall sensitivity of FIT was 80.8%. Sensitivity was higher for distal tumors (91.8%) compared to proximal colon tumors (70.7%) and rectal cancers (78.0%). Interval cancers were more frequently diagnosed at an advanced stage. In multivariate analysis, proximal location (odds ratio=4.3) and rectal location (OR=3.3) were significantly associated with an increased risk of interval cancer.
FIT demonstrates good overall sensitivity but remains less effective for proximal and rectal locations.
Introduction
Le cancer colorectal (CCR) est un problème de santé publique majeur. En France, en 2023, le nombre de nouveaux cas est estimé à 47 582 dont 26 212 chez les hommes et 21 370 chez les femmes. Il s’agit du troisième cancer le plus fréquent chez l’homme, après ceux de la prostate et du poumon, et du deuxième chez la femme, après le cancer du sein 1. Chaque année, ce cancer est responsable de plus de 17 000 décès soit environ 9 000 chez les hommes et 8 000 chez les femmes. Il représente ainsi la deuxième cause de mortalité par cancer chez les hommes, et la troisième chez les femmes 2.
Afin de réduire l’incidence et la mortalité liées à ce cancer, un programme national de dépistage (DOCCR) a été mis en place. Il s’adresse aux personnes âgées de 50 à 74 ans considérées comme à risque moyen de développer un CCR. Les personnes à risque moyen de développer un cancer colorectal sont les personnes ne présentant ni symptômes, ni antécédents personnels ou familiaux d’adénome, de cancer ou de maladie touchant le côlon ou le rectum, ni facteurs de risques particuliers. Le DOCCR consiste à effectuer, tous les deux ans, un test de recherche de sang occulte dans les selles. En cas de test positif, une coloscopie doit être réalisée 3. Jusqu’en 2015, un test au gaïac était utilisé, puis il a été remplacé par un test immunologique fécal (FIT) reposant sur des anticorps spécifiques à l’hémoglobine humaine plus performant et plus simple à réaliser. Ce changement de test a été motivé par des études démontrant la supériorité du FIT en termes de détection des cancers et des lésions précancéreuses, ainsi que par son impact sur la réduction de la mortalité liée au CCR 4,5,6. Néanmoins, certains cancers échappent encore à la détection et surviennent entre deux tests de dépistage. Ces cancers d’intervalle sont diagnostiqués après un test de dépistage négatif et avant la réalisation du test suivant, soit dans l’intervalle des deux ans.
La fréquence de ces cancers d’intervalle permet d’évaluer la sensibilité du FIT, un indicateur important de sa performance diagnostique.
Les objectifs de cette étude étaient d’évaluer la sensibilité du FIT utilisé dans le cadre du DOCCR et de décrire les caractéristiques des cancers d’intervalle dans le département de l’Isère. Ce département a été l’un des premiers à mettre en place le dépistage organisé des cancers colorectaux (depuis 1991 pour les femmes et en 2002 pour l’ensemble de la population).
Matériel et méthode
Population étudiée
Cette étude rétrospective a porté sur les personnes ayant participé au DOCCR dans le département de l’Isère entre le 1er mai 2015 (date de remplacement du test Hémoccult par le FIT) et le 31 décembre 2018, âgées de 50 à 74 ans lors de la réalisation du FIT, quel que soit le résultat, et pour lesquelles un CCR a été diagnostiqué dans les deux années suivant la participation au dépistage.
En cas de FIT positif, une coloscopie diagnostique devait être réalisée et toute lésion identifiée faisait l’objet d’une analyse anatomopathologique. En cas de FIT négatif, un diagnostic de CCR pouvait être posé secondairement, à la suite le plus souvent de la présence de symptômes conduisant à une prise en charge suivie d’une confirmation histologique.
Recueil des données
Les données relatives au dépistage étaient issues du Centre régional de coordination du dépistage des cancers d’Auvergne-Rhône-Alpes (CRCDC-Aura). Elles comprenaient la date de réalisation du FIT, son résultat (positif, négatif ou non analysable), sa valeur en microgramme d'hémoglobine/g de selles (µg Hb/g de selles) ainsi que le rang de participation au DOCCR (1re participation ou ultérieure).
Le FIT utilisé en France est l’OC-Sensor et le seuil de positivité a été fixé à 30 µg d’hémoglobine/g de selles.
Les données concernant les tumeurs ont été obtenues à partir du Registre du cancer de l’Isère. Elles incluaient la date de diagnostic du CCR, la localisation de la tumeur et le stade au diagnostic selon la classification TNM.
La localisation tumorale a été classée en trois catégories : proximale (tumeurs situées entre le caecum et l’angle splénique inclus), distale (tumeurs localisées entre le côlon descendant et la jonction recto-sigmoïdienne) et rectale.
Les données du CRCDC-Aura et du Registre du cancer de l’Isère ont été appariées à l’aide du package R « Concordant Search » développé par Francim à partir des variables suivantes : nom, prénom, nom de jeune fille, date et lieu de naissance. Les appariements incertains ont été revus et validés manuellement.
Un CCR était considéré comme dépisté lorsque son diagnostic faisait suite aux investigations réalisées dans les deux ans après un test FIT positif. Les CCR diagnostiqués dans les deux années après la réalisation d’un test négatif ou non analysable non refait étaient qualifiés de cancers d’intervalle. Les cancers survenus après un test positif et une coloscopie négative n’ont pas été inclus dans l’analyse.
Seuls les carcinomes invasifs ont été inclus dans l’étude, les types histologiques rares (sarcomes, lymphomes, tumeurs neuroendocrines) ont été exclus.
Critère de jugement
Le critère de jugement principal était la sensibilité du programme de dépistage, calculée selon la formule suivante :
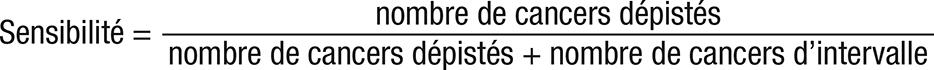
Analyses statistiques
Les variables catégorielles ont été décrites en effectifs et pourcentages et les variables continues en moyennes (± écart-type) ou médiane selon la distribution des variables. Les comparaisons entre les groupes ont été effectuées à l’aide du test du Chi2 ou du test exact de Fisher pour les variables catégorielles et un test t de Student ou un test de Mann-Whitney pour les variables quantitatives.
Une analyse multivariée par régression logistique a été réalisée afin d’identifier les facteurs associés à la survenue d’un cancer d’intervalle. Les variables incluses dans le modèle étaient l’âge lors de la réalisation du test (en classes de 5 ans), le sexe, le rang de participation et la localisation tumorale. Le stade au diagnostic n’a pas été inclus dans l’analyse multivariée car il ne constitue pas un facteur explicatif de la survenue d’un cancer d’intervalle. Il reflète l’avance au diagnostic des cancers dépistés par rapport aux cancers d’intervalle et correspond à une conséquence du mode de détection plutôt qu’à une cause. La sélection des variables dans le modèle final a été effectuée selon une procédure ascendante et la comparaison des modèles a été réalisée à l’aide du test du rapport de vraisemblance. Les résultats sont présentés sous forme d’odds ratio (OR) avec leurs intervalles de confiance à 95% (IC95%).
Un seuil de significativité statistique de p<0,05 a été retenu pour l’ensemble des analyses.
Les données ont été analysées à l’aide du logiciel Stata version 16.1® (StataCorp LP, Texas, USA).
Éthique et protection des données
Les données nominatives utilisées pour l’appariement ont été traitées dans le strict respect de la confidentialité. Elles ont été stockées de manière sécurisée et pseudonymisées après l’appariement.
Les travaux d’évaluation du dépistage font partie des missions déclarées du Registre du cancer de l’Isère CNIL n°982002 V 5.
Résultats
Population étudiée
Entre le 1er mai 2015 et le 31 décembre 2018, un total de 233 202 FIT ont été réalisés. Le taux de positivité du FIT était de 3,9%. Les femmes représentaient 53,9% des participants et l’âge moyen des personnes ayant effectué le test était de 61,5 ans (±7,1 ans ; 61,4 ans ; ±7,2 ans pour les hommes et 61,6 ans ; ±7,1 ans pour les femmes).
Parmi l’ensemble des participants, 516 cancers invasifs colorectaux ont été détectés à la suite d’un FIT positif, 118 cancers d’intervalle ont été diagnostiqués dans les deux années suivant un FIT négatif, et 5 avec un test non analysable non refait.
Sensibilité et cancers d’intervalle
Les cancers d’intervalle représentaient 0,05% des tests négatifs ou non analysables non refaits et 19,2% des CCR identifiés au sein de la population dépistée.
Le tableau 1 décrit les caractéristiques des cancers dépistés et des cancers d’intervalle et le tableau 2 la sensibilité du FIT.
La sensibilité globale du FIT était de 80,8%. Une tendance à une sensibilité plus élevée était observée chez les hommes, 82,6% pour 77,8% (p=0,13) chez les femmes.
Elle ne variait pas de manière significative en fonction de l’âge (p=0,12) bien qu’elle tende à diminuer chez les personnes plus âgées.
Aucune différence statistiquement significative de sensibilité n’a été observée entre les personnes participant pour la première fois au DOCCR et celles ayant déjà participé (p=0,07).
La localisation tumorale influençait la sensibilité. Les cancers du côlon distal présentaient une meilleure sensibilité (91,8%), suivis du rectum (78,0%) et du côlon proximal (70,7%, p<0,001).
Les cancers d’intervalle étaient diagnostiqués à un stade plus avancé, avec plus de stades IV (18,7% versus 11,2%) et moins de stades I (33,3% vs 43,0%).
Délai diagnostic
Le délai médian entre le test et le diagnostic était de 2,4 mois pour les cancers dépistés et de 16,3 mois pour les cancers d’intervalle et deux tiers (66,7%) des cancers d’intervalle étaient diagnostiqués plus d’un an après la réalisation du FIT.
Valeur du FIT pour les cancers d’intervalle
Un taux de sang dans les selles inférieur à 10 μg/g de selles était observé dans 61,0% des cas, tandis que 23,7% avaient un taux entre 10 et 20 μg/g de selles et 15,3% entre 20 et 30 μg/g de selles. Aucune différence statistiquement significative de concentration n’a été observée selon le sexe (p=0,28), l’âge (p=0,55), la localisation (p=0,83) et le stade au diagnostic (p=0,94).
L’impact d’une modification du seuil de positivité du FIT sur les performances du test a été évalué (tableau 3). L’abaissement du seuil de 30 µg Hb/g à 20 µg Hb/g permettrait une augmentation modérée de la sensibilité (+2,8%), se traduisant par 18 cancers supplémentaires dépistés. Cette amélioration s’accompagnerait d’une hausse de 32% du nombre de coloscopies.
La réduction plus importante du seuil à 10 µg Hb/g augmenterait la sensibilité à 87,9%, mais s’accompagnerait d’une diminution de la spécificité à 91,9%. Ce seuil permettrait d’éviter 46 cancers. Cependant, cette baisse du seuil de positivité entraînerait plus de 10 000 coloscopies supplémentaires soit une augmentation de 113%.
Facteurs associés au risque de cancer d’intervalle
En analyse multivariée (tableau 4), le sexe (OR=1,4 ; IC95%: [0,9-2,1] ; p=0,21) et l’âge au diagnostic (p>0,3 pour toutes les classes d’âge) n’étaient pas significativement associés à la survenue d’un cancer d’intervalle. Par contre, une localisation proximale du cancer (OR=4,3 ; IC95%: [2,5-7,5] ; p<0,001) ou rectale (OR=3,3 ; IC95%: [1,8-5,9] ; p<0,001), comparée à une localisation distale, était significativement associée à un cancer d’intervalle plutôt qu’à un cancer détecté par le dépistage. Le rang de participation n’a pas été retenu dans le modèle final, son inclusion dans le modèle multivarié n’améliorait pas significativement l’ajustement.
 Agrandir l'image
Agrandir l'imageDiscussion
Cette étude en population générale a permis d’évaluer la sensibilité du FIT dans le département de l’Isère. Elle confirme la bonne sensibilité globale du FIT de 80,8%.
Ces résultats sont conformes à ceux rapportés dans d’autres études 7, notamment celle réalisée récemment dans le département du Finistère qui indiquait une sensibilité à 80,5% 8.
Le FIT a montré une sensibilité nettement supérieure à celle du test au gaïac utilisé auparavant 9. Une étude antérieure menée sur la période 2002-2006 dans le département de l’Isère avait montré une sensibilité de 48,4% 10.
Certaines études suggèrent une meilleure sensibilité du FIT chez les hommes 11,12. Cette tendance se retrouve dans notre étude, mais n’était pas significative (82,6% vs 77,8%). Ce résultat était également observé dans l’étude réalisée dans le département du Finistère 8.
La localisation tumorale joue un rôle majeur dans la non-détection des cancers par le FIT. Dans notre étude, les tumeurs situées dans le côlon proximal présentaient un risque quatre fois plus élevé d’être des cancers d’intervalle et les cancers rectaux étaient environ trois fois plus susceptibles d’échapper à la détection du FIT par rapport aux cancers distaux.
Ces résultats sont cohérents avec la littérature, qui suggère plusieurs facteurs pouvant expliquer la moindre sensibilité du FIT. Pour les tumeurs proximales un saignement plus faible ou intermittent, une dégradation de l’hémoglobine liée au temps de transit, une croissance tumorale plus rapide, ainsi que des caractéristiques moléculaires spécifiques 13,14,15,16,17. Quant aux tumeurs rectales, le sang pourrait ne pas être suffisamment dégradé lors du passage rapide dans le rectum, limitant la libération d’hémoglobine et réduisant ainsi la sensibilité du test, ou une croissance tumorale rapide 15,18.
Nos résultats montrant que les cancers d’intervalle étaient plus fréquemment diagnostiqués à des stades avancés sont en accord avec la littérature 15,19.
Les cancers d’intervalle présentent généralement des concentrations très faibles d’hémoglobine fécale, ce qui a également été observé dans notre étude où 61% des cancers d’intervalle avaient une concentration inférieure à 10 μg Hb/g de selles 7,18.
Plusieurs programmes de dépistage européens ont adopté un seuil de positivité du FIT inférieur à celui utilisé en France. Bien qu’un abaissement du seuil améliore la détection des tumeurs, nos résultats montrent que cette baisse entraîne une augmentation conséquente du nombre de coloscopies (32% pour un seuil à 20 µg Hb/g, 113% pour un seuil à 10 µg Hb/g). La décision de modifier le seuil de positivité doit s’appuyer sur une évaluation du rapport coût- efficacité, tout en tenant compte des ressources disponibles pour la réalisation des coloscopies. Il convient également de considérer les difficultés d’accès à la coloscopie déjà observées avec le seuil actuel chez certains participants présentant un FIT positif.
Une limite de cette étude concerne la zone géographique des données du Registre du cancer de l’Isère. En cas de déménagement vers un autre département d’un participant au dépistage en Isère, la survenue d’un cancer chez ce patient ne serait pas identifiée par le registre, pouvant entraîner ainsi une sous-estimation du nombre de cancers d’intervalle.
Enfin, le taux de participation au programme de dépistage en Isère de 42,5% (1) reste inférieur aux recommandations européennes, qui fixent un seuil optimal de 65% 20. Ce niveau de participation insuffisant limite l’impact global du dépistage sur la réduction de la mortalité par cancer colorectal, même si la performance du test est bonne 21.
Conclusion
En conclusion, cette étude confirme la bonne sensibilité du FIT dans le DOCCR, avec une bonne détection des tumeurs invasives à un stade précoce et de localisation distale, mais il reste moins performant pour les tumeurs proximales et rectales.
Il semble important de consolider ces résultats sur un plus grand nombre de départements disposant de registres de cancer, de mener des enquêtes complémentaires sur les modalités diagnostiques des cancers d’intervalle et de communiquer sur l’importance d’investiguer tout symptôme même en présence d’un test FIT négatif récent.
La biologie moléculaire représente une technique d’avenir prometteuse, susceptible de faciliter et de simplifier le dépistage du cancer colorectal 22, mais l’enjeu actuel reste l’augmentation de la participation au DOCCR.
Les résultats de cette étude pourraient servir à améliorer l’adhésion au programme de dépistage auprès de la population et des professionnels de santé, afin que ce test performant puisse bénéficier à un plus grand nombre de personnes.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.
Références
Citer cet article








