Dix années de dépistage du cancer colorectal avec le test fécal immunochimique en Île-de-France, 2015-2024 : dynamiques, équité et leçons pour l’avenir
// Ten years of FIT-based colorectal cancer screening in Île-de-France, 2015-2024: Trends, equity and implications for policy
Résumé
Introduction –
Malgré son principe universel, le Programme national de dépistage organisé du cancer colorectal (PNDOCCR) pourrait ne pas garantir une équité réelle d’accès en Île-de-France. L’étude vise à dresser un bilan régional sur la période 2015-2024 en décrivant la dynamique des indicateurs de performance (I_performance) et explorer les inégalités territoriales.
Méthodes –
Cette étude rétrospective et analytique décrit et compare l’évolution (2015-2024) des I_performance (Taux d’exclusion médicale – Tx-exclusion ; Taux de participation ; Proportion de coloscopies réalisées dans un délai ≤31 jours – Tx_colo_mois ; Taux de détection de la coloscopie – Tx_détection) en croisement avec deux ratios d’offre de dépistage (médecin généraliste prescripteur, gastro-entérologue) et l’indice de défavorisation sociale, en Île-de-France. Une régression segmentée et une matrice de corrélation ont été interprétées.
Résultats –
Entre 2015 et 2024, la Tx_colo_mois (de 16,4% à 10,7%), le Tx_détection (de 64,4% à 42,7%) ont significativement baissé (p<0,05). De fortes disparités interdépartementales existent (Tx_exclusion 2015 : 7,3% en Hauts-de-Seine, 13,0% en Seine-et-Marne ; en 2024 : 4,1% en Seine-Saint-Denis, 11,3% dans l’Essonne). Le Val-de-Marne avait atteint en 2021 une Tx_colo_mois de 32,2% quand les autres départements avaient des Tx_colo_mois de moins de 20%. Chaque indicateur avait ≥1 point de rupture significative (p<0,05) et des épisodes de brutale décrue post-rupture, coïncidant temporellement avec des évènements organisationnels majeurs (interruption d’approvisionnement en kits de tests, crise Covid-19,...).
Conclusion –
Le programme couvre largement l’Île-de-France, avec des inégalités spatiales persistantes et des ruptures temporelles potentiellement liées aux événements organisationnels. Pour améliorer l’équité, il faut combiner actions universelles et interventions ciblées (renforcement du rattrapage des tests non analysables, renforcement de l’offre locale, médiation territoriale) et en surveiller les effets.
Abstract
Introduction –
Despite its universal principle, the Population-based Colorectal Cancer Screening program (CRCSP) may not ensure true equitable access in Île-de-France region (France). This study provides a regional assessment for 2015-2024 by describing trends in performance indicators (I_performance) and exploring territorial inequalities.
Methods –
This retrospective analytical study describes and compares the 2015-2024 evolution of I_performance – medical exclusion rate (Exclusion_rate), participation rate, proportion of colonoscopies performed within ≤31 days (Month_colo_rate), and colonoscopy detection rate (Detection_rate) – in relation to two screening-supply ratios (prescribing general practitioners, gastro-enterologists) and a social deprivation index in Île-de-France region. Segmented regression (joinpoint) and a correlation matrix were used for inference.
Results –
Between 2015 and 2024, the proportion of colonoscopies within 31 days decreased from 16.4% to 10.7%, and the colonoscopy detection rate from 64.4% to 42.7% (significant, p<0.05). Marked inter-departmental disparities were observed (Exclusion_rate 2015: 7.3% [Hauts-de-Seine], 13.0% [Seine-et-Marne], 2024: 4.1% [Seine-Saint-Denis], 11.3% [Essonne]). In 2021 Val-de-Marne reached a Month_colo_rate of 32.2% while other departments remained below 20%. Each indicator shows evidence of at least one statistically significant breakpoint (p<0.05), with some showing abrupt post-break declines, coinciding temporally with major organizational events (supply disruption in test kits, COVID-19 crisis, etc.).
Conclusion –
CRCSP achieves wide regional coverage but persistent spatial inequalities and temporal breakpoints—some likely related to organizational changes—remain. Improving equity requires combining universal measures with targeted actions (catch-up for non-analyzable tests, strengthening local service supply, territorial mediation) and monitoring their impact.
Introduction
Le cancer colorectal (CCR) demeure une priorité majeure de santé publique dans le monde, représentant la deuxième cause de mortalité par cancer 1. En France, le Programme national de dépistage organisé du cancer colorectal (PNDOCCR), généralisé depuis 2009, propose à toutes les personnes âgées de 50 à 74 ans, asymptomatiques et sans antécédent personnel ou familial, de réaliser un test de dépistage tous les deux ans, suivi d’une coloscopie en cas de test positif 2. Le test repose sur une recherche de sang occulte dans les selles, réalisé initialement par un test au gaïac qui a été remplacé en 2015, par le test fécal immunochimique (FIT) plus sensible et mieux accepté 3.
Mis en œuvre à l’échelle départementale via des structures locales le plus souvent associatives, le programme reposait sur une coordination hétérogène au sein d’une même région. En 2019, une instruction ministérielle instaurait la régionalisation des structures de gestion donnant naissance au Centre régional de coordination des dépistages des cancers d’Île-de-France (CRCDC-IDF) 4. Cette restructuration visait à harmoniser l’organisation, professionnaliser les équipes et mutualiser les moyens.
En plus du changement de test, divers événements structurants ou non, ont vraisemblablement impacté les performances du programme à partir de 2015, notamment :
–l’amélioration de la détection précoce, la hausse des demandes de coloscopie et l’allongement des délais d’accès à la coloscopie ont été observés après l’introduction du FIT 3,5 ;
–une chute brutale de l’activité en 2019 a été la conséquence immédiate de l’interruption de la fourniture des kits de test suite à un contentieux administratif 6 ;
–la crise sanitaire liée à la Covid-19 en 2020 5 entrainant une baisse de l’activité endoscopique avec pour corollaire la majoration des délais d’accès à la coloscopie (notamment dans les hôpitaux publics) et l’augmentation des tests non analysables non refaits (Test-NA) 5 ;
–en 2022, l’élargissement des modalités d’accès au dépistage (commande en ligne du kit de dépistage et délivrance du kit de test par les pharmaciens d’officine) ;
–enfin en 2024, le transfert du pilotage des invitations/relances à l’Assurance maladie dès le mois de janvier.
Ces évolutions récentes, tout comme les précédentes, ont profondément transformé la chaîne de dépistage, notamment en Île-de-France, région densément peuplée, socialement contrastée et inégalement dotée en offre de soins 7. Si elles visent à améliorer l’accessibilité et la fluidité du parcours des personnes dans le programme, l’impact réel de ces évolutions sur la participation, les délais de prise en charge et l’équité territoriale restent à documenter. En Île-de-France, où la mobilisation des acteurs locaux a longtemps été un levier du programme, ces transformations suscitent à la fois des espoirs de modernisation et des interrogations quant à la capacité du système à maintenir un accompagnement territorialisé des publics les plus éloignés du dépistage. Malgré sa couverture théorique universelle, l’hypothèse serait que le PNDOCCR ne garantit pas en Île-de-France, une équité réelle d’accès, de participation et de suivi, notamment dans les territoires à forte vulnérabilité sociale et/ou à faible densité médicale. L’étude vise à dresser un bilan régional du PNDOCCR en Île-de-France sur la période 2015-2024. En décrivant la dynamique des indicateurs de performance du programme (I_performance) et les éventuelles inégalités territoriales, elle ambitionne d’identifier les tendances structurelles, les facteurs de rupture et les leviers d’amélioration pour un dépistage plus équitable et mieux adapté aux réalités locales.
Méthodes
Type d’étude
Il s’agit d’une étude rétrospective, descriptive et analytique portant sur la mise en œuvre du PNDOCCR entre 2015 et 2024. L’analyse couvre l’ensemble de la population francilienne âgée de 50-74 ans, éligible au PNDOCCR, domiciliée dans les huit départements de l’Île-de-France (Paris–75, Seine-et-Marne–77, Yvelines–78, Essonne–91, Hauts-de-Seine–92, Seine-Saint-Denis–93, Val-de-Marne–94 et Val-d’Oise–95). Dans un premier temps, l’évolution des I_performance pour chaque territoire (commune, département et région) a été décrite entre 2015 et 2024. Puis, un indicateur de précarité sociale et deux indicateurs d’offre du dépistage (I_offre_depistage) ont été construits et leurs impacts potentiels sur les I_performance ont été décrits.
Sources de données
Les données d’invitation/relance (date d’invitation/relance), de participation (date de réalisation et résultat du test FIT) et de suivi des résultats positifs (date de réalisation et résultat de la coloscopie, résultat de l’analyse anatomopathologique), couvrant les années 2015 à 2024, ont été extraites de la base de données (E-SIS-DOCCR®) du CRCDC-IDF le 27 mai 2025. Les données contextuelles mobilisées à des fins d’analyse écologique de l’équité sont celles publiées par l’Insee : la population cible ; l’indice de défavorisation sociale de 2015 (FDep15) ou de 2020 (FDep20) par commune 8. Les données de démographie médicale ont été extraites des atlas publiés par le Conseil national de l’ordre des médecins (Cnom) 7.
Définition des indicateurs analysés
Pour l’analyse de la dynamique, les I_performance suivants ont été définis :
–le taux d’exclusion médicale (Tx_exclusion : rapport entre le nombre de personnes exclues pour raison médicale et la taille de la population cible) ;
–le taux de participation (Tx_brut_participation : il s’agit d’un taux brut, exprimé par le rapport entre le nombre de personnes testées et la moitié de la taille de la population cible sans aucune soustraction du nombre de personnes exclues pour raison médicale) ;
–le taux de positivité des tests (Tx_positif : proportion de tests positifs parmi les tests réalisés) ;
–le taux de test-NA (Tx_na) : proportion de test-NA parmi les tests réalisés ;
–le taux de réalisation de la coloscopie (Tx_colo : proportion de personnes ayant réalisé une coloscopie parmi les personnes ayant un test positif) ;
–le délai moyen de réalisation de la coloscopie en jours (Délai_colo) et la proportion de coloscopies réalisées dans un délai de 31 jours suivant un test positif (Tx_colo_mois) ;
–le taux de détection de la coloscopie (Tx_détection : proportion de personnes ayant un résultat positif de la coloscopie parmi les personnes ayant réalisé une coloscopie après un test positif). Le résultat de la coloscopie a été classé positif si le gastro-entérologue a diagnostiqué un polype (adénomateux ou non), un adénome (tout grade, avancés ou non) ou un cancer.
L’équité a été explorée sous deux dimensions :
–l’équité territoriale a été décrite à travers deux I_offre_depistage (Ratio_MG_pop_cible et Ratio_GE_Pop_cible). Ratio_MG_Pop_cible correspond au ratio « Nombre de médecins généralistes ayant prescrit un test de dépistage / Taille de la population cible » par territoire (commune, département, région), pour chaque année de campagne. De même, Ratio_GE_pop_cible correspond au ratio « Nombre de gastro-entérologues ayant réalisé une coloscopie de dépistage / Taille de la population cible » par territoire (commune, département, région), pour chaque année de campagne ;
–l’équité sociale (écologique) a été décrite en termes de corrélation entre un indicateur de précarité (FDep15 et FDep20) et chaque I_performance ou I_offre_depistage. Les disparités intra– et interdépartementales mises en évidence par cette analyse écologique ont été visualisées à l’aide d’une carte choroplèthe de la répartition du taux moyen (Tx_participation, Tx_colo et Tx_colo_mois) en fonction du FDep20.
Analyses statistiques
Par l’interface RStudio®, les analyses statistiques ont été conduites sous le logiciel R (version 4.4.3 du 28 février 2025)® au seuil de positivité de 5%.
Chaque indicateur a d’abord été décrit en termes de moyenne annuelle régionale. Afin de détecter d’éventuels changements structurels dans la tendance, liés à des événements majeurs (rupture d’approvisionnement en 2019, Covid-19, réformes de 2023-2024…), une régression segmentée a été conduite (Package segmented). L’estimation des points de rupture (joinpoints) a été faite à partir de la série temporelle et l’ajustement des pentes distinctes avant et après chaque rupture. L’analyse a été réalisée sur le même modèle segmenté, avec la variable année comme terme segmenté. Le nombre de points de rupture a été limité à un maximum de deux (NPSI=2), compte tenu du nombre d’observations disponibles. La significativité des ruptures détectées a été évaluée par le test de la pente (Davies-test), et les résultats ont été annotés. Cette double approche permet de quantifier la tendance globale tout en détectant des ruptures potentielles dans la dynamique du programme sur la période étudiée.
Les moyennes sur la période 2015-2024 (désignées comme moyenne-globale et exprimées en moyenne ± écart-type) ont été estimées soit par pondération (Tx_participation, Ratio_MG_Pop_cible, Ratio_GE_Pop_cible), soit par le rapport entre la somme des numérateurs et la somme des dénominateurs sur l’ensemble de la période (somme des numérateurs de 2015 à 2024 / somme des dénominateurs de 2015 à 2024). Pour chaque territoire (commune/département), l’écart à la moyenne-globale régionale a été exprimé en pourcentage relatif de cette dernière, afin de comparer les performances locales à la tendance régionale de référence. Une illustration de la variation spatiale des indicateurs par rapport à la moyenne régionale a été faite par cartes choroplèthes.
Une matrice de corrélation (chart.Correlation) a été utilisée comme outil descriptif afin d’explorer les relations linéaires entre indicateurs ou identifier d’éventuelles colinéarités.
Mention légale
Les données ont été anonymisées avant toute analyse. La base de données du PNDOCCR bénéficie d’un avis favorable de la Commission nationale de l’informatique et des libertés (Cnil) 9. Conformément à la législation française, une étude qui ne change pas la prise en charge des patients ne nécessite pas l’avis d’un comité d’éthique.
Résultats
Sur la période étudiée, le taux de participation au PNDOCCR en Île-de-France est de 24,2% et présente une hétérogénéité territoriale, variant de 20,2% (Paris) à 27,4% (Seine-et-Marne). Les indicateurs régionaux montrent une diminution de la rapidité de prise en charge après un FIT positif et une variabilité interdépartementale marquée. La moyenne régionale de Tx_colo_mois passe de 16,4% (2015 ; intervalle départemental [12,5-19,1]) à 10,7% (2024 ; [6,6-13,9]). Le Délai_colo reste élevé (de 92,1 jours en 2015 [84,7-100,4] à 87,3 jours en 2024 [83,3-97,0]). Le Tx_détection diminue (de 64,4% en 2015 à 42,7% en 2024), alors que le Tx_positif oscille autour de 4% (de 4,6% en 2015 à environ 3,3% en 2024). Les extrêmes départementaux sont importants : en 2015, le taux d’exclusion varie de 7,3% (Hauts-de-Seine) à 13,0% (Seine-et-Marne), et en 2024 de 4,1% (Seine-Saint-Denis) à 11,3% (Essonne). De même, Tx_colo_mois a atteint 30,9% dans certains départements (Val-de-Marne en 2019), mais descend à 5,1% dans d’autres (Seine-et-Marne en 2019) (tableau 1).
 Agrandir l'image
Agrandir l'imageLe « joinpoint-analysis » met en évidence des ruptures temporelles significatives (Davies_p<0,05) avec un (Tx_brut_participation, Tx_positif, Tx_détection, Ratio_GE_pop_cible) et deux (Tx_exclusion, Tx_na, Tx_colo, Délai_colo, Tx_colo_mois, Ratio_MG_pop_cible) points de rupture. Tx_colo présente trois segments (amorce en 2015 avec une pente de -5,42 ; puis rupture en 2018 avec une pente de -0,78 et -33,56 en 2023 ; p<0,001), traduisant une décrue suivie d’une chute rude. Tx_positif diminue de façon soutenue (-0,28 puis -0,101 en 2017 ; p<0,001). Tx_colo_mois oscille (-0,55 puis +0,67 en 2018, puis -1,93 en 2021 ; p≤0,01). Tx_exclusion (+0,30 puis -0,17 en 2018, puis -3,5 en 2023). Tx_brut_participation (+14,88 puis +0,26 en 2016). Tx_na (+0,08 puis +0,81 en 2017, puis -0,23 en 2020). Délai_colo (+2,5 puis +0,67 en 2017, puis -17,26 en 2023). Tx_détection (-0,53 puis -12,60 en 2023). Ratio_MG_pop_cible (-5,8 puis +3,8 en 2016, puis +0,52 en 2018). Ratio_GE_pop_cible (+0,10 puis -0,65 en 2022).
Sur la période 2015-2024, la variabilité départementale est nette, le taux d’exclusion oscille de 6,1% (Paris) à 15,1% (Essonne). Le Tx_brut_participation va de 20,2% (Paris) à 27,6% (Seine-et-Marne). Le Tx_na varie de 2,1 à 3,4%. Le Tx_colo se situe entre 68,2% (Paris) et 78,5% (Seine-et-Marne) ; le Délai_colo entre 92,7 et 109 jours. Le Ratio_MG_pop_cible s’étend de 46,1 à 64,2 pour 10 000 personnes âgées de 54 à 74 ans (tableau 2).
 Agrandir l'image
Agrandir l'imageLa carte met en évidence une forte hétérogénéité spatiale en termes de participation (figure 1) : certaines zones concentrent simultanément forte précarité (FDep élevée) et participation plus faible que la moyenne régionale (c’est l’exemple de plus des 3/4 du département de Seine-Saint-Denis et de l’est de la Seine-et-Marne), tandis que d’autres présentent l’inverse (FDep faible et participation supérieure). La cartographie (figure 2) associe le FDep20 à l’écart du taux régional de réalisation de la coloscopie (moyenne pondérée=75,9%). Les teintes chaudes signalent des taux supérieurs à la moyenne et les teintes froides des taux inférieurs ; la distribution spatiale révèle des poches de forte réalisation à l’est/sud-est et une grande hétérogénéité au sein des communes défavorisées, suggérant que la précarité territoriale n’explique pas à elle seule les variations observées. Avec un taux maximal 32,2% en 2021 (tableau 1), le Val-de-Marne se distingue par sa forte Tx_colo_mois et par la forte concentration de communes défavorisées ayant une forte Tx_colo_mois (figure 3).
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'image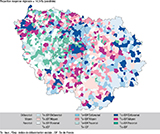 Agrandir l'image
Agrandir l'imageLe nuage de points met en lumière une structure de corrélations cohérente, mais contrastée (figure 4). Les FDep15 et FDep20 sont presque superposables (r≈0,93), ce qui confirme leur redondance et la robustesse de l’indicateur territorial. Les Ratio_MG_pop_cible et Ratio_GE_pop_cible montrent une corrélation négative avec deux I_performance majeur (Tx_brut_participation et Tx_colo) et une corrélation positive avec la population cible (r≈0,52) et la Tx_colo_mois (r≈0,1), suggérant que les communes les plus « fournies » en effectifs médicaux ont une facilité d’accès à la coloscopie (court délai), mais n’y sont pas encouragées (faibles taux de réalisation). Les distributions univariées (diagonales) révèlent des asymétries marquées – la population cible et plusieurs ratios sont fortement dissymétriques tandis que l’indice FDep20 suit une distribution gaussienne –. Au total, la matrice signale une forte cohérence entre indices territoriaux et des relations plus discrètes, mais statistiquement pertinentes, entre caractéristiques de l’offre médicale et indicateurs de performance.
 Agrandir l'image
Agrandir l'imageDiscussion
Les analyses spatiales et temporelles du PNDOCCR en Île-de-France montrent une inégale mise en œuvre de l’accès au dépistage et au suivi. Bien que le programme soit universel, la participation au dépistage, la réalisation de la coloscopie après un test positif et les délais associés varient significativement selon le territoire et coïncident en grande partie avec l’indice de défavorisation sociale. Les communes et départements défavorisés présentent globalement des taux de participation et de réalisation inférieurs à la moyenne régionale, tandis que plusieurs territoires plus favorisés affichent des performances supérieures. Ces profils territoriaux s’accompagnent d’une répartition inégale de l’offre : densité plus faible de médecins prescripteurs et de gastro-entérologues dans les zones défavorisées, ce qui contribue à des ruptures de parcours et à des délais de prise en charge allongés.
Nos résultats confirment que l’universalité formelle du PNDOCCR en Île-de-France n’entraîne pas une réelle équité. Ce schéma — reproduction des inégalités sociales au sein d’un programme universel — est documenté dans la littérature sur les dépistages populationnels. Les programmes universels peuvent, sans mesures ciblées, creuser les écarts si l’accès et l’appropriation des mesures varient selon le statut socio-économique 10,11. Nos résultats plaident pour une stratégie d’universalisme proportionné : maintenir un accès universel tout en augmentant l’effort et les ressources dans les territoires les plus fragiles (médiation, actions aller-vers, facilitation logistique, renforcement de l’offre de coloscopie).
L’inégale répartition de l’offre de dépistage (ratios de prescripteurs et gastro-entérologues) influe sur l’accès réel au test et à la coloscopie. Les communes avec peu ou pas de prescripteurs actifs voient moins de participation et plus de ruptures de parcours : la mise à disposition d’un test de dépistage ne suffit pas si la prescription et le parcours de prise en charge manquent localement dans un territoire touché par d’autres facteurs de faibles accès au dépistage et aux soins (barrières socio-comportementales et matérielles 12, littératie en santé 13, difficulté d’accès numérique 14, contraintes de temps, crainte des examens 12,15…). Ces autres facteurs de faible accès expliqueraient la corrélation paradoxalement négative entre les indicateurs d’offre de dépistage et deux I_performance majeurs (Tx_brut_participation et Tx_colo).
Les récentes innovations (commande en ligne, dispensation en pharmacie, transfert pilotage des invitations) peuvent améliorer l’accès pour certains groupes, mais risquent d’accentuer les inégalités en l’absence de mesures non-numériques ciblées territorialement. Il est indispensable d’intégrer systématiquement des indicateurs d’équité territorialisés (taux de participation, Tx_colo_mois, Ratio_MG_pop_cible) dans le suivi régional, afin d’orienter les priorités d’action et d’évaluer l’impact différentiel des mesures en place.
Les délais de réalisation des coloscopies après un test positif constituent un indicateur majeur : des études montrent qu’un retard prolongé est associé à des conséquences cliniques (retard de diagnostic, stade plus avancé) et à une moins bonne performance globale du programme. Nos résultats indiquent que des territoires (en particulier en Seine-et-Marne) enregistrent des délais plus longs, ce qui est un signal d’alerte pour la qualité du parcours. L’importance d’objectifs temporels (exemple : proportion de coloscopies réalisées dans un délai court) est soulignée dans les recommandations et évaluations nationales/européennes 10,16.
L’analyse souligne qu’une part non négligeable de tests non analysables n’est jamais rattrapée en Île-de-France, ce qui réduit la population effectivement évaluée et peut fausser autant les taux de détection que la valeur prédictive positive du FIT. Ce constat renforce la nécessité d’actions ciblées – amélioration du circuit de distribution, relance systématique des sujets NA – pour restaurer la validité du parcours diagnostique. Parallèlement, l’étude des ruptures temporelles dévoile des changements de tendance coïncidant avec des événements organisationnels (introduction de la commande en ligne, dispensation en pharmacie, transfert des invitations) et la période pandémique ou celle de la rupture d’approvisionnement en 2019 5,6. L’analyse n’ayant pas été approfondie dans cette étude, il est essentiel de rapporter pour chaque rupture la date estimée, la pente avant/après, et d’interpréter ces changements à la lumière des réformes locales et des limites méthodologiques. En effet, la baisse progressive des Tx_positif et Tx_détection doit être investiguée dans d’autres schémas d’étude. La baisse du Tx_exclusion observée entre 2023 et 2024 est quant à elle attribuable à l’absence d’alternative aux réponses postales (stoppées avec le transfert des invitations à l’Assurance maladie) pour la collecte d’information. Les données de coloscopies réalisées de 2024 n’étaient pas consolidées au moment de l’étude, la chute brutale de Tx_colo entre 2023 et 2024 est donc attribuable au retard dans la collecte des comptes-rendus de coloscopies par le CRCDC-IDF et au long délai de réalisation. À propos du délai, le guide européen pour l’assurance qualité du dépistage du cancer colorectal préconisait la réalisation de la coloscopie dans les 31 jours suivant un résultat de test positif 17. En effet, comparativement à ce délai recommandé, il existe un risque de cancer colorectal augmenté d’environ 40% pour toute coloscopie réalisée après un délai d’attente de 7 à 12 mois 18.
La répartition spatiale des médecins généralistes prescripteurs et des gastro-entérologues est, quant à elle, un déterminant fondamental de l’équité. Là où l’offre est concentrée (agglomérations, départements favorisés), les parcours sont plus complets ; là où elle est rare, les retards et abandons augmentent 19. Une politique d’équité devrait donc combiner : le renforcement de l’offre (soutien aux acteurs libéraux en zone fragile, facilité d’accès à la coloscopie dans les hôpitaux), la médiation locale (agents de terrain – aller-vers –, traduction, horaires adaptés), les mesures incitatives et logistiques (pharmacies relais, transports facilités). Des expériences de distribution via pharmacies ou interventions ciblées montrent que ces leviers peuvent améliorer l’accès, si elles sont intégrées dans une stratégie territorialisée 20.
Pour être efficace, cette stratégie territorialisée devrait être complétée par une surveillance continue des indicateurs d’équité systématisés dans les tableaux de bord, des indicateurs par commune et par département, tels que ceux décrits dans cette étude. Les tableaux doivent signaler les zones prioritaires pour permettre : un ciblage proportionné dans l’objectif d’augmenter les ressources humaines et de médiation dans les communes les plus défavorisées (campagnes locales multilingues, médiateurs, actions d’aller-vers) ; une adaptation de l’offre de soins pour une facilitation d’accès à la coloscopie en ambulatoire (soutien aux cabinets privés, plages dédiées en établissements publics), des incitations pour les prescripteurs en zones déficitaires ; un renforcement de la coordination entre prescripteurs et effecteurs ; une évaluation des innovations qui a pour but de mesurer l’impact différentiel des mesures avant et après une innovation (exemples : commande en ligne, dispensation en pharmacie…) sur la participation globale et sur les inégalités — vérifier si elles réduisent ou creusent les écarts. Pour Bygrave, Whittaker et Aranda Am 10, les interventions numériques doivent être accompagnées de solutions non numériques (kits envoyés par courrier, aide téléphonique, actions de proximité).
Limites
Les données agrégées par commune et département peuvent masquer des inégalités intra-communales ; la qualité des variables (notamment dates et imputations manquantes) peut biaiser les délais et l’effet des réformes 2022-2024 nécessite un suivi prospectif plus long pour être correctement évalué.
Conclusion
L’analyse régionale du PNDOCCR en Île-de-France montre que, malgré son principe universel, l’accès au dépistage et au suivi post-FIT reste inégalement réparti sur le territoire. Les différences persistantes de participation, la variabilité des délais et des taux de coloscopie, ainsi que la part non rattrapée des tests non analysables, indiquent que l’universalité n’a pas suffi à garantir l’équité. Les ruptures de tendance observées coïncident avec des changements organisationnels récents et appellent à une évaluation attentive de leurs effets différenciés selon les territoires.
Pour améliorer l’équité, il est nécessaire de combiner mesures universelles et actions proportionnées ciblées :
–renforcer le rattrapage systématique des tests NA et la qualité pré-analytique ;
–développer des interventions d’aller-vers dans les communes sous-dotées (médiation, dispensation locale, campagnes multilingues) ;
–surveiller en continu les indicateurs d’équité (par commune, âge, statut socio-économique) ;
–évaluer l’impact des réformes (commande en ligne, dispensation en pharmacie, transfert d’invitations) via des analyses avant-après.
Ces mesures sont indispensables pour transformer l’universalité normative en équité réelle.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.
Remerciements
Les auteurs remercient toute l’équipe du CRCDC-IDF et tous ceux qui ont contribué à la qualité de ce travail.
Références
Citer cet article





