Cartographie du dépistage de l’hépatite Delta en France métropolitaine de 2016 à 2022 à partir des données du Système national des données de santé (SNDS)
// Mapping hepatitis Delta screening from 2016 to 2022 in metropolitan France using the French National Health Data System
Résumé
Parmi les patients porteurs du virus de l’hépatite B (VHB), 5% sont infectés par le virus Delta (VHD) avec un risque de cirrhose et de carcinome hépatocellulaire (CHC) particulièrement élevé. Nos objectifs ont été d’estimer, à partir du Système national des données de santé (SNDS), le nombre de tests de dépistage du VHD (anticorps (Ac) anti-VHD et ARN VHD), de comparer le nombre de tests Ac anti-VHD au nombre attendu calculé à partir de l’estimation de la positivité des tests antigène HBs (AgHBs) et de décrire les caractéristiques des patients testés et des prescripteurs. Sur la période 2016-2022, 28 898 177 tests AgHBs, 162 055 Ac anti-VHD et 21 963 ARN VHD ont été effectués. Le nombre de tests AgHBs est en progression de 45%, les Ac anti-VHD de 130% et les ARN VHD de 206%. En 2016, 55% des tests Ac anti-VHD attendus ont été réalisés, 69% en 2020 et 94,7% en 2022. Cependant, en ciblant en 2022 deux populations, les femmes enceintes et les patients suivis pour une hépatite chronique VHB, 0,26% et 26% respectivement ont bénéficié d’Ac anti-VHD. Les patients dépistés AgHBs et Ac anti-VHD séjournaient principalement en région parisienne et en Provence-Alpes-Côte d’Azur. De plus, 41,7% des patients testés pour les Ac anti-VHD et 51,8% pour l’ARN VHD avaient un statut précaire. Les prescripteurs étaient majoritairement des médecins libéraux pour le VHB et salariés pour le VHD. Au total, le dépistage du VHD a été multiplié par 2,3 de 2016 à 2022, mais reste insuffisant dans certaines populations.
Abstract
Delta infection (HDV) affects 5% of patients with hepatitis B (HBV). Patients with HDV are particularly vulnerable to Delta cirrhosis and Hepatocellular Carcinoma (HCC). The real-life prevalence of HDV in mainland France has been little studied. Our objectives were to establish, using the French National Health Data System (SNDS), the number of HDV tests performed, to compare this number to the expected number of tests calculated from the estimated positivity of HBsAg tests (0.7%), and to describe the characteristics of patients and prescribers. Between 2016 and 2022, 28,898,177 HBsAg, 162,055 anti-HDV Ab and 21,963 HDV RNA tests were performed. We note that screening increased by 45% for HBV, 130% for anti-HDV Ab, and 206% for HDV RNA. In 2016, 55% of the expected number of anti-HDV Ab tests were carried out, rising to 69% in 2020 and 94.7% in 2022. However, by targeting two populations in 2022 (pregnant women and patients followed for chronic HBV infection), 0.26% and 26% benefited from anti-HDV Ab testing, respectively. The patients screened for HBsAg and anti-HDV Ab were mainly located in the regions of Paris and Provence-Alpes-Côte d’Azur; 41.7% of the patients tested for anti-HDV Ab and 51.8% for HDV RNA had a precarious profile. The prescribers were mainly independent general practitioners for HBV and employees working within healthcare facilities for HDV. In total, HDV screening multiplied by 2.3 from 2016 to 2022, but remains insufficient in some populations.
Introduction
Les hépatites virales, dont l’infection Delta, sont responsables d’une augmentation inquiétante de la mortalité au cours des dernières années selon le dernier rapport de l’Organisation mondiale de la santé (OMS) 1. Le virus de l’hépatite Delta (VHD) est un petit virus à ARN défectif dépendant de l’expression de l’antigène HBs (AgHBs) du VHB pour sa structure et son assemblage. Il utilise le même mécanisme d’entrée que le VHB pour infecter les hépatocytes en se liant au polypeptide cotransporteur du taurocholate de sodium 2.
L’infection chronique Delta est la plus grave des hépatites avec un risque de cirrhose de 57% et de carcinome hépatocellulaire (CHC) de 15% à 10 ans, soit 3 à 5 fois plus élevé que dans la mono-infection par le virus de l’hépatite B (VHB) 3. En Europe, la prévalence estimée des anticorps anti-VHD (Ac anti-VHD) dans la population générale présentant un AgHBs positif est de 3% (intervalle de confiance à 95%, IC95%: [2,09-4,21]) avec parmi eux 64% d’ARN VHD positifs 4. En France, très peu d’études sur la prévalence et le profil des patients VHD sont disponibles. Une enquête déjà ancienne chez les donneurs de sang sur la période 1997-2011 montrait une prévalence de 1,98%, avec 22,9% d’ARN positifs 5. Les données issues de l’enquête menée par Santé publique France sur les personnes diagnostiquées VHB entre 2008 et 2012 a montré un taux de co-infection VHD de 6%, dont 62,5% avec un profil réplicatif et pour un quart d’entre eux originaire d’un pays à forte endémicité pour le VHD 6.
Les sociétés savantes européennes et la Haute Autorité de santé (HAS) recommandent un dépistage systématique des Ac anti-VHD devant tout nouvel AgHBs positif 7,8. Par conséquent, le dépistage du VHD requiert un dépistage adéquat du VHB.
En 2023, deux études ont permis de réévaluer le taux de positivité du VHB sur le territoire français : l’enquête LaboHEP 2021 9 a montré une augmentation de 25% du nombre de tests AgHBs réalisés par rapport à 2016 avec un taux de positivité cependant plus faible qu’en 2016 à 0,69% ; l’enquête CeGIDD (centres gratuits d’information de dépistage et de diagnostic) 2021 sur 454 099 consultations décrit un taux de dépistage du VHB de 28,4% et un taux de positivité global de 0,83%, supérieur à celui de l’enquête LaboHEP mais celle-ci concerne une population spécifique, plus souvent masculine et née à l’étranger, que la population générale 10.
De nouvelles perspectives thérapeutiques, notamment le bulévirtide contre le VHD changent la prise en charge de ces pathologies 11 et vont limiter l’incidence des complications comme la cirrhose et le CHC.
Les objectifs de cette étude ont été d’évaluer, à partir des données issues du Système national des données de santé (SNDS) de 2016 à 2022, le nombre de tests VHD réalisés, de le comparer à celui attendu à partir de l’estimation de la positivité des tests AgHBs (0,7%) 9 et de décrire les caractéristiques des patients testés ainsi que le profil des prescripteurs.
Matériel et méthodes
Sources des données
Le SNDS regroupe les données du Programme de médicalisation des systèmes d’information (PMSI), le Système national d’information inter-régimes de l’Assurance maladie (Sniiram) et les données relatives aux causes de décès 12.
Les données de dépistage VHB (AgHBs) et VHD (Ac anti-VHD et ARN VHD) de 2016 à 2022 en France métropolitaine sont issues de la base de consommation inter-régimes (DCIR), qui contient les actes de biologie réalisés en laboratoires de ville ainsi que dans les établissements privés, et de la base des hospitalisations en médecine, chirurgie et obstétrique (PMSI-MCO) qui contient les actes et consultations externes des établissements publics. Un traitement supplémentaire est appliqué pour supprimer les consultations externes des établissements publics versées au DCIR pour information (filtre DPN_QLF≠71).
Les codes de la Nomenclature des actes de biologie médicale (NABM) utilisés pour les tests VHB et VHD sont décrits dans le tableau 1.
Population étudiée
Le profil des patients testés a été décrit en utilisant les variables SNDS (tableau 2). Les populations précaires sont définies comme les patients bénéficiant soit de la couverture maladie universelle complémentaire (CMU-C), de l’aide au paiement d’une complémentaire santé (ACS) ou de la complémentaire santé solidaire (CSS), et les analyses sont effectuées chez les personnes de moins de 60 ans (d’autres aides peuvent être allouées aux personnes âgées avec peu de ressources). Les populations bénéficiant de l’aide médicale de l’État (AME) ou d’un numéro d’inscription au répertoire de la sécurité sociale (NIR) provisoire sont considérées comme récemment arrivées sur le territoire (population immigrée) et nouvellement affiliées au système de santé français.
Dans deux populations d’intérêt, celle des femmes enceintes (code NAMB 4715) et celles des patients suivis pour hépatite chronique B (code NABM 4711), nous avons compté les tests AgHBs associés à un dépistage des Ac anti-VHD (code NABM 1740) (tableau 1). Les patients sous traitement sont définis comme ayant eu au moins une délivrance durant la période 2016-2022.
Les profils des prescripteurs (spécialités, statuts et structures de rattachement) pour les trois tests ont été décrits à partir de la table ER_PRS_F du DCIR (PSP_STJ_COD ; PSP_SPE_COD) et des tables T_MCO_AAFL et T_MCO AAFLSTC du PMSI.
Aspect éthico-légal
Le centre hospitalier universitaire (CHU) de Limoges a un accès permanent au SNDS selon le décret n°2021-848 du 29 juin 2021 13. L’accès et l’utilisation de ces données se fait dans le respect du référentiel de sécurité du SNDS, les personnels concernés ont suivi les formations obligatoires et ont été habilités pour l’extraction des données SNDS. Ce projet a été évalué et validé par le CHU de Limoges puis enregistré au répertoire du Health Data Hub (N° F20231116101028).
Analyses
Les données sont exprimées en nombre, pourcentage ou taux. Les doublons (patients ayant eu plusieurs tests dans l’année), ont été supprimés grâce à l’identifiant bénéficiaire anonymisé unique de chaque patient. Pour chaque test de dépistage, nous avons décrit la répartition par âge et par sexe.
Le nombre de tests Ac anti-VHD attendu a été calculé à partir des taux de positivité de l’AgHBs des enquêtes LaboHEP 2013 14 et LaboHEP 2021 9 (0,8% et 0,7% respectivement) et du nombre de tests AgHBs extraits du SNDS. Pour les femmes en suivi de grossesse, le nombre de tests Ac VHD attendus a été calculé avec la prévalence de VHB chronique estimée à 0,8% de l’Enquête nationale périnatale de 2016 15.
Pour décrire la répartition géographique des tests de dépistage, le nombre a été rapporté à la population vivant par région administrative en France métropolitaine (source : Institut national de la statistique et des études économiques – Insee).
Les données ont été extraites et analysées sous SAS guide v8.0.
Résultats
Nombre de tests réalisés et nombre de tests attendus
Au cours de la période 2016-2022, 28 898 177 tests AgHBs, 162 055 Ac anti-VHD et 21 963 ARN VHD ont été effectués en France métropolitaine, correspondant à 16 355 991 patients testés pour l’AgHBs (1,7 test par patient), 150 165 patients pour l’Ac anti-VHD (1,08 test par patient) et 14 529 patients pour l’ARN VHD (1,5 test par patient).
Entre 2016 et 2022, on observe une augmentation de 45% du nombre d’AgHBs réalisés, de 130% des Ac anti-VHD et de 206% des ARN VHD. Toutefois, durant l’année 2020, on constate un fléchissement des dépistages de l’AgHBs et des Ac anti-VHD lors de la pandémie de Covid-19 (-5,9% et -4,9% respectivement par rapport à l’année précédente), alors que l’augmentation progressive des tests ARN VHD reste constante (figure 1).
Le nombre de tests Ac anti-VHD attendus a été calculé à partir des taux de positivité de l’AgHBs des enquêtes LaboHEP 2013 14 et LaboHEP 2021 9 et du nombre de tests AgHBs extraits du SNDS. Nous constatons que 55% ont été réalisés en 2016 (14 280 réalisés pour 25 887 attendus), 69% en 2020 et enfin 94,7% en 2022 (32 871 réalisés pour 34 714 attendus).
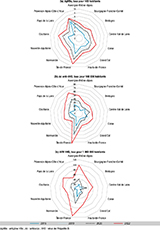
Le rapport entre le nombre de tests AgHBs et le nombre d’habitants de la région est le plus élevé en Île-de-France (IDF), puis en Provence-Alpes-Côte d’Azur (PACA) et en Occitanie sans modification de tendance depuis 2016 ; pour les Ac anti-VHD, l’IDF est suivie par PACA et Auvergne-Rhône-Alpes ; et enfin pour l’ARN VHD, l’IDF et la région Auvergne-Rhône-Alpes ont les taux les plus élevés suivis par les Pays de la Loire et le Centre-Val de Loire (figure 2).
En utilisant les taux de positivité régionaux de l’AgHBs estimés à partir de l’enquête LaboHEP 2021 9 pour calculer le nombre de tests Ac anti-VHD attendus, la quasi-totalité des régions (excepté la Bretagne, la Corse et les Hauts-de-France) n’atteignait pas l’objectif de 100% des tests attendus en 2016 (tableau 3). En 2021, la majorité des régions a progressé, mais certaines comme le Centre-Val de Loire, l’IDF, et le Grand Est n’atteignent pas encore les objectifs. Enfin, Les Hauts-de-France, dans les objectifs en 2016, ne l’étaient plus en 2021.
 Agrandir l'image
Agrandir l'image2016-2022
 Agrandir l'image
Agrandir l'imageDescription des personnes dépistées
Entre 2016 et 2022, la majorité des personnes dépistées pour le VHB sont des femmes entre 21 et 40 ans (sex-ratio=0,54) avec une médiane d’âge de 34 ans. Pour les Ac anti-VHD, le sex-ratio est de 1,4 et pour les ARN VHD de 1,6 avec des médianes d’âge de 40 ans et de 41 ans respectivement (figure 3).
Parmi les patients testés pour les Ac anti-VHD, tous sexes confondus, 41,7% ont un profil précaire, 14,5% ont reçu un NIR provisoire et 8,3% sont bénéficiaires de l’AME. Pour les ARN VHD, 51,8% ont un profil de précarité, 18,7% une affiliation avec NIR provisoire et 12,9% bénéficient de l’AME. Les taux de patients détenus (presque exclusivement des hommes) dépistés pour l’Ac anti-VHD et pour l’ARN VHD étaient de 2,2% et 2,8% respectivement (figure 4).
Chez les patients dépistés pour l’ARN VHD, on observe 4 fois plus de consommation de traitements substitutifs des opiacés par rapport aux tests de dépistage Ac anti-VHD (2,9% vs 0,7%) avec une majorité d’hommes (sex-ratio=11), et un usage d’antidépresseurs 2 fois plus important (28,5% vs 11,5%). De même, la co-infection VIH est plus fréquente (7,7% vs 4,1%) avec un sex-ratio de 1,9.
Les patients ayant bénéficié d’un test ARN VHD sont plus souvent bénéficiaires de traitements VHB et/ou VHD que les patients dépistés pour les Ac anti-VHD (9,8% vs 0,3% pour l’interféron et 39,1% vs 15,8% pour les traitements par analogues nucléos(t)ides – NUC). Parmi les patients ayant bénéficié d’un ARN VHD (N=6 619) sur la période 2019-2022, 9,7% sont traités par bulévirtide.
Enfin, les affections longue durée (ALD) VHB sont deux fois plus fréquentes pour les personnes ayant eu un test ARN VHD que pour celles dépistées pour les Ac anti-VHD (figure 4).
 Agrandir l'image
Agrandir l'image2016-2022
 Agrandir l'image
Agrandir l'imageÉvolution du dépistage du VHD dans deux populations d’intérêt
À partir du codage pour le suivi de grossesse, en 2016, 0,05% des dépistages VHB ont été suivis d’un test VHD et 0,26% en 2022. En calculant le nombre de tests Ac anti-VHD attendus avec la prévalence de VHB chronique estimée à 0,8% de l’Enquête nationale périnatale de 2016 15, seuls 7,1% des tests Ac anti-VHD attendus étaient réalisés et en 2022, on observe cependant une nette progression à 37,4% par rapport à 2016.
Chez les patients suivis en 2022 pour une hépatite chronique B, 26% avaient bénéficié d’un test VHD contre 17,2% en 2016.
Profil des prescripteurs
Si les codages disponibles dans le SNDS permettent de différencier les salariés des établissements publics des libéraux, seules les spécialités ont pu être correctement extraites pour les libéraux, les spécialités des salariés publics étant codées à tort et par défaut, aux deux tiers en médecine générale.
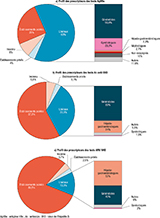
Les prescripteurs des tests AgHBs sont majoritairement des médecins libéraux (63%) suivis des praticiens salariés d’établissements publics (25%) et enfin seulement 4% pour les établissements privés. Dans 8% des cas, les prescripteurs ne sont pas renseignés.
Les médecins libéraux sont composés à 56,6% de généralistes (37% des prescripteurs totaux), suivis par les gynécologues (20,3% des libéraux, 13,4% du total), les hépato-gastro-entérologues (2,3% des libéraux, 1,4% du total), les néphrologues (2,1% des libéraux, 1,3% du total) et par diverses spécialités à hauteur de 11,6%. Dans 10% des cas les spécialités n’étaient pas renseignées.
La tendance s’inverse pour l’Ac anti-VHD, avec 57,8% de salariés d’établissements publics et 33,5% de libéraux. Les salariés des établissements privés ne représentent que 3,1% des Ac anti-VHD prescrits et pour 5,6% les prescripteurs ne sont pas renseignés. Les médecins libéraux sont composés à 69% de généralistes (23,1% de tous les prescripteurs), suivis par les hépato-gastro-entérologues à hauteur de 24% (8% de tous les prescripteurs). Les gynécologues ne représentent que 1,5% des libéraux (0,51% du total). Les autres spécialités représentent 5,5% des médecins libéraux.
Les salariés d’établissements publics génèrent 80,5% des prescriptions des ARN VHD et les libéraux 13,3%. Les salariés des établissements privés ne représentent que 2,5% du total des ARN VHD prescrits et pour 3,7% les prescripteurs ne sont pas renseignés. Les médecins libéraux sont composés de 52% d’hépato-gastro-entérologues (soit 7% des prescripteurs totaux), suivis par 40% de généralistes (5% du total). Les gynécologues ne représentent que 2% des libéraux (0,3% du total). Enfin, 6% des médecins libéraux appartiennent à d’autres spécialités (figure 5).
 Agrandir l'image
Agrandir l'imageDiscussion
Le dépistage de l’hépatite Delta est-il suffisant ?
On constate une nette augmentation des dépistages VHB et VHD en 2022 comparativement à 2016, malgré un fléchissement du dépistage VHB en 2020 en lien avec la pandémie de Covid-19.
La mise à disposition en France du bulévirtide dans l’infection VHD, d’abord sous autorisation temporaire d’utilisation (ATU) nominative (début 2019), puis de cohorte (septembre 2019), puis sous autorisation de mise sur le marché (AMM) (juillet 2020), a incité clairement les professionnels de santé au dépistage du VHD avec un taux multiplié par 1,8 entre 2016 et 2022. Cependant, des populations spécifiques comme les femmes enceintes et les patients suivis pour une hépatite chronique B restent largement sous-dépistées.
Répartition régionale
En rapportant les tests réalisés au nombre d’habitants, la région IDF puis les régions Auvergne-Rhône-Alpes et PACA dépistaient le plus le VHB, le VHD et pratiquaient le plus l’ARN VHD. La densité de population dans ces régions, la proportion élevée de patients migrants, mais aussi d’usagers de drogues peuvent expliquer un renforcement du dépistage qui a été plus précoce que dans les autres régions de France (développement de nombreux centres d’accueil de migrants ou d’accueil d’usagers de drogues, du dépistage hors les murs…). Cependant, certaines régions comme l’IDF, le Centre-Val de Loire, le Grand Est et les Hauts-de-France, restent encore à un nombre de dépistages VHD attendus insuffisant.
Profil des personnes dépistées
Les personnes dépistées pour le VHB sont majoritairement des femmes entre 21 et 40 ans tel que déjà décrit par Tamandjou et coll. 10. Concernant le VHD, les hommes sont plus souvent dépistés avec un pic entre 31 et 40 ans. La majorité des patients dépistés pour l’Ac anti-VHD et l’ARN VHD sont précaires (41,7% et 51,8% respectivement) ou affiliés récemment à la Caisse primaire d’assurance maladie (CPAM) par un NIR provisoire (14,5% et 18,7%), ou bénéficient de l’AME (8,3% et 12,9%). Une co-infection VIH est identifiée dans 4,1% et 7,7% des cas respectivement.
Profil des prescripteurs
Les généralistes sont les premiers acteurs dans le dépistage du VHB, mais s’impliquent également dans le dépistage des Ac anti-VHD. Cependant, une importante proportion de ces praticiens est rattachée à un établissement public.
Les spécialistes rattachés à un établissement public sont les principaux prescripteurs des tests ARN VHD. En effet, en raison de la complexité de la prise en charge de l’hépatite Delta, les patients sont prioritairement adressés à des structures hospitalières. Par ailleurs, la prise en charge de l’hépatite Delta en milieu spécialisé favorise alors la déclaration des ALD VHB par les généralistes.
Les gynécologues-obstétriciens ont une implication très faible dans le dépistage du VHD, alors que le dépistage du VHB est recommandé chez la femme enceinte : 0,26% des tests AgHBs prescrits ont été suivis d’un test Ac anti-VHD (soit 7,1% des tests attendus en 2022 avec une progression cependant de 37,4% par rapport à 2016). Il n’existe pas de code de suivi de grossesse pour le VHD. Ainsi, on peut supposer que les femmes enceintes dépistées positives pour l’AgHBs n’ont, soit pas été orientées systématiquement vers un spécialiste, soit ont été orientées mais le test prescrit par le spécialiste n’a pas été codé dans un suivi de grossesse. Une enquête spécifique serait souhaitable.
Par ailleurs, seulement un quart des patients suivis pour une hépatite chronique B ont bénéficié d’un dépistage du VHD. On peut ainsi supposer une insuffisance de répétition des tests VHD chez les patients VHB chroniques, qui sont à risque de surinfection Delta (séjours répétés dans le pays d’origine notamment).
Des solutions pour renforcer le dépistage
Une première solution serait de renforcer le « reflex testing » (RT) VHD dans les laboratoires avec mise à la nomenclature officielle des tests de RT en cas de dépistage d’un premier test AgHBs positif. Cette pratique existe déjà dans de nombreux centres universitaires dont le centre national de référence (CNR), mais n’est pas applicable aujourd’hui au secteur privé. Plusieurs publications ont émergé sur le RT dans la littérature 16,17,18. Une étude espagnole récente a démontré par modélisation que le RT pratiqué à 100% réduisait de 35% les événements liés au foie et la mortalité, et était coût-efficace 19. Cependant, dans la modélisation en population espagnole, le nombre de tests VHD prescrits spontanément chez les patients AgHBs était très bas (<10%), ce qui a contribué à démontrer le ratio coût-efficacité du RT. Enfin, des études coût-efficacité dans les pays à faible prévalence du VHD restent encore indispensables 20.
Développer de nouvelles solutions pour le dépistage hors les murs
Dans l’attente de tests rapides d’orientation diagnostique (Trod) VHD, des détections d’ADN ou d’ARN viraux seraient réalisables à partir d’un même prélèvement de papier buvard (DBS) en cas de positivité d’un test AgHBs ou Ac anti-VIH, Ac anti-VHC et Ac anti-VHD. Ces types de DBS sont développés 21 et en cours de validation actuellement par le CNR, et sont particulièrement adaptés aux patients migrants 22.
Sensibiliser certaines spécialités au dépistage du VHD
L’optimisation du dépistage passe par la sensibilisation de certaines spécialités au dépistage du VHD, comme par exemple les gynécologues-obstétriciens, et par la répétition du dépistage ciblé chez les patientes suivies pour hépatite B (avec ou sans traitement par NUC).
Limites
La principale limite de cette étude est que nous ne disposons pas dans le SNDS des résultats des tests VHB prescrits. Nous avons donc été amenées à estimer un nombre de tests VHB positifs à partir des taux de positivité du VHB sur le territoire français 9,14,15 pour calculer le nombre de tests VHD attendus.
Par ailleurs, certaines données telles que celles issues des CeGIDD ne sont pas versées au SNDS du fait de l’anonymisation des personnes dépistées. En 2022, le nombre de tests d’AgHBs en CeGIDD était de 142 000, d’après Tamandjou et coll. 10. Il est donc impossible d’évaluer les pratiques de dépistage VHD qui en découleraient. De même dans le SNDS, il n’est pas possible d’extraire les actes de biologie effectués durant les séjours hospitaliers des établissements publics. Enfin, il serait utile d’améliorer le codage des spécialités des prescripteurs, notamment dans le domaine public, afin de mieux cartographier les pratiques de dépistage à partir du SNDS et du futur Entrepôt national des données de biologie, LABOé-SI 23.
Conclusion
Au total, le dépistage du VHB, clé du dépistage du VHD, a augmenté entre 2016 et 2022 et le nombre de tests Ac anti-VHD prescrits a été multiplié par 2,4 sur la période. La mise à disposition du bulévirtide fin 2019 a clairement dynamisé le dépistage. Cependant un travail important reste à faire pour lequel quelques solutions peuvent être proposées, comme le « reflex testing » VHD et la diffusion des techniques buvards (autorisant dépistage puis PCR) notamment dans les populations migrantes. La sensibilisation des prescripteurs au bon ciblage des populations à risque Delta reste indispensable.
Remerciements
Nous remercions madame Magali Lemaitre (épidémiologiste, société Horiana) pour ses précieux conseils. Nous remercions madame Marie Bosselut pour la relecture du manuscrit.
Liens d’intérêt
Les autrices déclarent ne pas voir de liens d’intérêt au regard du contenu de l’article.







