Dépistage des hépatites virales et du VIH dans les structures médico-sociales d’addictologie (CSAPA et Caarud), France, 2018-2023
// Screening for viral hepatitis and HIV in addiction treatment facilities (CSAPA and CAARUD) in France, 2018–2023
Résumé
Introduction –
L’élimination des hépatites virales et l’arrêt de la transmission du VIH sont des objectifs clés des stratégies de santé mondiale et nationale. Le dépôt de gouttes de sang sur buvard après ponction digitale a montré un intérêt clinique pour augmenter le diagnostic des maladies infectieuses, en particulier vis-à-vis de certaines populations vulnérables.
Matériel et méthodes –
L’activité de dépistage des hépatites virales (B, D et C) et du VIH a été évaluée dans 26 structures médico-sociales (centres de soins, d’accompagnement et de prévention en addictologie – CSAPA –, centres d’accueil et d’accompagnement à la réduction des risques pour usagers de drogues – Caarud) sur une période de 6 ans (2018-2023), et ce à partir de sang déposé sur buvard (DBS). Les variables démographiques (âge, sexe), épidémiologique (facteurs de risque), clinique (score de fibrose) et thérapeutiques (initiation de traitement, taux de guérison virologique) ont été recueillies.
Résultats –
Au total, 588 sujets, majoritairement des hommes (81,0%) âgés en moyenne de 44,4 (écart-type, ET=9,7) ans ont été dépistés pour un ou plusieurs virus. Trois cent vingt-trois (54,9%) ont rapporté un ou plusieurs facteurs de risque (usage de drogues, rapports sexuels non protégés). Plus d’un tiers des individus (33,5%) évalués avaient une fibrose significative (≥F2) dont 11,2% avaient une cirrhose. Le taux de positivité du VHC (infection active), VHB et VIH était respectivement de 16,3%, 1,8% et 1,3%. Un seul porteur chronique de l’antigène HBs (AgHBs) était infecté par le VHD. Parmi les 96 patients nouvellement diagnostiqués pour le VHC, 80 patients ont reçu un traitement par antiviraux à action directe (AAD). La proportion de patients ayant une guérison virologique était de 90,0%. Pour les patients nouvellement dépistés pour le VHB (n=4) ou le VIH (n=2), 4 ont débuté un traitement anti(rétro)viral.
Conclusion –
Le dépistage des virus d’hépatites et du VIH à partir de spot de sang séché dans les structures médico-sociales d’addictologie est faisable et facilement implantable sans renforcement de personnels. Les taux de positivité pour le VHC (infection active), VHB et le VIH étaient largement supérieurs aux prévalences observées dans la population générale. La plupart des cas nouvellement diagnostiqués ont pu bénéficier d’une prise en charge thérapeutique.
Abstract
Introduction –
Eliminating viral hepatitis and stopping HIV transmission are key objectives of global and national health strategies. Dried blood spot (DBS) sampling has shown clinical interest in enhancing the diagnosis of infectious diseases, particularly in certain marginalized populations.
Material and methods –
Screening activity for viral hepatitis B, D and C as well as HIV was evaluated in 26 specialized medical services in addictology (CSAPA and Caarud) over a 6-year period (2018–2023), using dried blood spot (DBS). Demographic (age, gender), epidemiological (risk factors), clinical (fibrosis score assessment) and therapeutic (treatment initiation, virologic cure rate after DAA treatment) data were collected.
Results –
A total of 588 subjects, mainly men (81.0%) with a mean age of 44.4 (standard deviation=9.7) years, were screened for one or more viruses. Among these, 323 (54.9%) reported one or more risk factors (drug use, unprotected sex). More than a third of individuals had significant fibrosis (≥F2), including 11.2% with cirrhosis. The rate of HCV (active infection), HBV and HIV infection was 16.3%, 1.8% and 1.3%, respectively. Only one HBsAg-positive carrier was infected with hepatitis Delta. Of the 96 patients newly diagnosed with HCV, 80 patients received direct acting antivirals. Ninety percent achieved a sustained virological response (SVR). For patients newly diagnosed with HBV (n=4) or HIV (n=2) infection, 4 initiated anti(retro)viral treatment.
Conclusion –
Screening for viral hepatitis and HIV using DBS in specialized medical services in addictology is feasible and easy to implement, with no need for additional staff. Rates of positivity for HCV, HBV and HIV were far above the prevalences estimated in the general population. Most newly diagnosed cases benefited from therapeutic management.
Introduction
L’élimination des hépatites virales chroniques et l’arrêt de la transmission du VIH sont des objectifs clés des stratégies de santé mondiale et nationale 1. L’Organisation mondiale de la santé (OMS) a fixé pour objectif l’élimination de l’infection par les virus d’hépatites chroniques d’ici à 2030, c’est-à-dire que 90% des personnes vivant avec l’hépatite B (et D) et/ou C soient diagnostiquées, et 80% des sujets pouvant bénéficier d’un traitement soient traités. L’autotest à domicile améliore le taux de dépistage du VIH 2 et les spots de sang séché sur papier filtre (DBS, dried blood spot) améliorent le taux de dépistage de l’infection par le virus de l’hépatite C (VHC) 3.
Les stratégies de dépistage des hépatites virales et du VIH sont généralement complexes et impliquent de multiples visites médicales et au laboratoire, ce qui a pour conséquence de retarder le diagnostic et l’accès aux soins ou d’augmenter les ruptures de suivi (patients perdus de vue) 4. À l’heure actuelle, le dépistage de l’infection par le VHC repose sur la mise en évidence, dans le plasma ou le sérum, des anticorps totaux dirigés contre le VHC, à l’aide d’un test immunologique pratiqué dans un laboratoire de biologie médicale centralisé. En cas de positivité du test sérologique, il est recommandé de réaliser une détection (voire une quantification) de l’ARN du VHC au moyen d’une technique sensible de biologie moléculaire en temps réel sur un second échantillon biologique 5,6. Cette stratégie en 2 étapes a pour conséquence que de nombreux sujets séropositifs ne réalisent pas le test moléculaire, donc perdent le lien avec le système de soins. Pour les populations vulnérables comme les usagers de drogues, les migrants et les travailleurs du sexe, une altération du réseau veineux peut également constituer un frein majeur au dépistage des infections par les virus des hépatites ou du VIH 7.
Le dépôt de sang capillaire sur papier filtre (DBS) a été proposé pour le dépistage néonatal de la phénylcétonurie par Robert Guthrie en 1963 et est aujourd’hui étendu à celui d’autres maladies génétiques. Le papier filtre permet l’auto-prélèvement à domicile ou le prélèvement de sang capillaire dans des structures ne disposant pas de personnels de santé. En effet, il nécessite des ressources limitées à la fois pour le recueil du sang, le stockage et le transport des échantillons vers un laboratoire de biologie médicale centralisé, ce qui rend le DBS adapté à de nombreuses situations cliniques, en particulier vis-à-vis des populations fréquentant les structures médico-sociales d’addictologie 8. Le prélèvement de sang capillaire après ponction digitale est adapté aux sujets ayant une altération du réseau veineux. Le papier buvard améliore le dépistage des hépatites virales par rapport au prélèvement veineux 3. Le papier buvard est cependant moins efficace que les tests moléculaires rapides décentralisés (« on site ») en vue de l’initiation d’un traitement antiviral contre le VHC 9,10. En effet, un modèle de soins simplifié dans lequel la détection de l’ARN VHC à l’aide d’un test moléculaire rapide décentralisé et l’initiation d’un traitement sont réalisés au même endroit et dans la mesure du possible le même jour, doit être privilégié 11. Des évaluations à grande échelle du dépistage par recueil de sang sur papier filtre (« DBS sampling ») sont essentielles pour évaluer la faisabilité, l’acceptabilité et l’impact sur l’accès aux soins des populations vulnérables ne fréquentant par les systèmes de soins classiques afin d’orienter les politiques publiques et la mise en œuvre de programmes.
Matériel et méthodes
Design de l’étude et participants
Tout individu fréquentant l’une des structures médico-sociales d’addictologie et présentant, ou non, selon le centre, un risque d’infection par le VHC, VHB, VHD ou le VIH (consommation de substances et mode de consommation, pratique sexuelle à risque) s’est vu proposer un dépistage de l’un ou plusieurs des virus à l’aide d’un prélèvement de sang capillaire (« DBS sampling »). Les variables démographiques (âge, sexe), épidémiologique (facteurs de risque), clinique (score de fibrose évaluée par élastrométrie FibroScan®) et thérapeutiques (initiation de traitement, taux de guérison virologique (RVS), défini par l’absence d’ARN VHC 12 à 24 semaines après l’arrêt du traitement) ont été recueillies. Vingt-trois centres de soins, d’accompagnement et de prévention en addictologie (CSAPA) et 3 centres d’accueil et d’accompagnement à la réduction des risques pour usagers de drogues (Caarud) répartis sur le territoire métropolitain ont participé.
Les trousses de prélèvement DBS distribuées aux structures médico-sociales comprenaient une carte buvard en cellulose (Whatman® 903), des lancettes stériles, un sachet zippé et des sachets dessicants. La procédure de prélèvement consistait à déposer des gouttes de sang dans des cercles pré-imprimés délimitant une surface d’environ 1,1 cm2, ce qui correspond à un volume d’échantillon de 50 µL environ. Les dépôts (spots) de sang, séchés à température ambiante, étaient ensuite adressés par voie postale le jour même ou dans un délai de quelques jours au laboratoire de virologie de l’hôpital Henri Mondor et stockés jusqu’à analyse.
Le taux de positivité des hépatites B, D et C et du VIH a été évaluée sur un échantillon de convenance provenant des 26 structures médico-sociales d’addictologie (CSAPA, Caarud) participantes, et ce sur une période de 6 ans (2018-2023), à partir de sang déposé sur buvard.
Analyses virologiques
Pour les analyses sérologiques (AgHBs, anti-HD, anti-VHC et anti-VIH/p24), un spot de 1,2 cm de diamètre était élué dans 1 mL de tampon phosphate salin (PBS) sous agitation pendant 1 heure à température ambiante et ensuite centrifugé à 36 220 g pendant une minute. Les anticorps totaux VHC (anti-VHC) ont été recherchés à l’aide d’une trousse immunologique de 3e génération (aHCV VITROS ECi™, ou Anti-HCV Architect, ou Anti-HCV Alinity i) conformément aux instructions des fabricants. La recherche de l’antigène de surface du VHB (AgHBs) a été réalisée à l’aide d’une trousse immunologique (VIDAS® HBsAg Ultra, ou HBsAg Qual II Architect, ou HBsAg Qual II Alinity i). Les anticorps totaux du virus de l’hépatite D ou Delta (anti-HD) ont été recherchés chez tous les sujets positifs pour l’AgHBs comme recommandé par les sociétés savantes d’hépatologie et l’OMS 12,13,14 à l’aide d’une trousse reposant sur la chimiluminescence sur l’automate d’immuno-analyse Liaison XL (Liaison® XL murex Anti-HDV). La détection des anticorps du VIH-1, du VIH-2, et de l’antigène p24 du VIH-1 (anti-VIH/p24) a été réalisée à l’aide d’une trousse immunologique de 4e génération (Architect HIV Ag/Ab COMBO, ou Alinity i HIV Ag/Ab COMBO) conformément aux recommandations des fabricants.
Pour les analyses moléculaires (ADN VHB, ARN VHD et ARN VHC), un spot de 1,2 cm de diamètre était élué dans 1,5mL d’un tampon approprié (Alinity m DBS Buffer kit, ou HIV-1 Qual Assay Sample Reagent, PBS ou NucliSENS® Lysis buffer) sous agitation pendant 30 minutes à température ambiante et ensuite centrifugé à 36 220 g pendant une minute. La détection de l’ARN du VHC ou de l’ADN du VHB a été réalisée à l’aide des trousses de PCR en temps réel, respectivement sur la plateforme Alinity m (Alinity m HCV assay ou Alinity m HBV assay) ou GeneXpert (Xpert® HCV Viral Load ou Xpert® HBV Viral Load). La détection de l’ARN du VHD a été réalisée à l’aide de la trousse EurobioPlex HDV RT-qPCR (EBX-071) sur le système QuantStudio 5™ après une étape d’extraction des acides nucléiques sur l’automate d’extraction EMAG.
Analyse statistique
Les résultats sont présentés sous forme de nombre et de pourcentages pour les données catégorielles et sous forme de moyenne avec écart-type pour les variables continues. Les taux de positivité ont été estimés dans les populations concernées. Le taux d’infection active par le VHC était défini par la présence d’ARN viral.
Résultats
Caractéristiques des participants
Au total, 588 individus, majoritairement des usagers de drogues (53,9%) ont été dépistés pour un ou plusieurs virus dans l’une des 26 structures médico-associatives d’addictologie sur la période 2018-2023. Un dépistage combiné des 3 virus a été réalisé chez 345 patients (58,7%), tandis que 138 individus (23,5%) ont bénéficié d’un dépistage du VHC associé à celui du VIH ou du VHB, et 104 individus (17,7%) ont bénéficié uniquement d’un dépistage du VHC. Un individu (0,1%) supplémentaire a été dépisté uniquement pour le VHB. Les sujets étaient majoritairement des hommes (81,0%), âgés en moyenne de 44,4 (écart-type, ET=9,6) ans au moment du dépistage (tableau). Trois cent vingt-trois individus (54,9%) ont rapporté un ou plusieurs facteurs de risque. La consommation de drogues était le facteur de risque le plus souvent rapporté (97,5%). Les substances psychoactives les plus fréquemment consommées étaient la cocaïne et son dérivé le crack, suivis par l’héroïne, les opiacés et le cannabis. Les modes de consommation les plus fréquents étaient l’injection, suivie par la fumée, le sniff et la voie orale. Quarante individus recevaient un traitement de substitution aux opiacés (TSO) par buprénorphine (17,5%) ou méthadone (75,0%). Le TSO n’était pas renseigné pour 4 individus (10,0%). Le score de fibrose hépatique a été évalué par élastométrie (FibroScan®) chez 179 individus. Plus d’un tiers des individus (33,5%) avaient une fibrose significative (≥F2) dont 11,2% avaient une cirrhose.
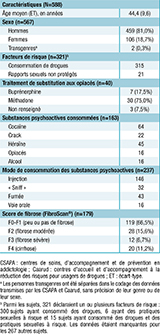 Agrandir l'image
Agrandir l'imageTaux de positivité du VHC, VHB, VHD et du VIH
Cinq cent quatre-vingt-sept individus ont été dépistés pour le VHC comprenant un dépistage sérologique (recherche d’anticorps totaux) chez 328 individus (56,0%) et un dépistage moléculaire chez 259 individus (44,0%), méthode de dépistage recommandée dans cette population 15,16,17 (figure). Parmi les 328 sujets dépistés par recherche d’anticorps totaux, 143 (43,5%) étaient séropositifs, soit un taux de séropositivité de 43,6%. Parmi les sujets séropositifs, 42 (29,4%) avaient un ARN détectable. Parmi les 259 sujets dépistés par recherche d’ARN du VHC, 54 (20,8%) avaient un ARN détectable. Une infection active était présente chez 16,3% des personnes dépistées pour le VHC (anticorps ou ARN). Quatre-vingt-seize étaient des sujets nouvellement diagnostiqués.
Quatre cent quarante-sept individus ont été dépistés pour le VHB. L’antigène de surface du VHB (AgHBs) était positif chez 8 sujets, soit un taux de séropositivité de 1,80%. L’ADN du VHB était détectable chez seulement 4 patients (50%) pour lesquels l’AgHBs était positif. Un porteur chronique de l’AgHBs était également infecté par le VHD. La recherche d’ARN VHD était cependant négative. Le portage de l’AgHBs était connu chez 4 individus.
Trois cent soixante-dix patients ont été dépistés pour le VIH. Parmi les 5 sujets séropositifs pour le VIH, 2 étaient nouvellement diagnostiqués. Le taux de positivité du VIH était de 1,30%.
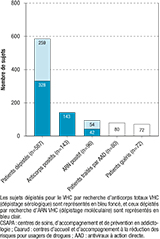 Agrandir l'image
Agrandir l'imageCascade de soins du VHC
Parmi les 587 individus dépistés pour le VHC, 96 sujets avaient un ARN détectable et quantifiable (figure). Le niveau de réplication virale était en moyenne de 3,8 (ET=0,8) log UI/mL. Le génotype viral a été déterminé chez 78 patients dont la charge virale (ARN VHC) était supérieure à 1 000 UI/mL (3 log UI/mL). La distribution des génotypes était la suivante : 41 (52,6%) sujets étaient infectés par un génotype 1 (majoritairement 1a, 26 patients, et 1b, 14 patients), 34 (43,6%) par un génotype 3a, 3 (2,6%) par un génotype 4 (sous-type 4a et 4d), et 1 (1,3%) par un génotype 2a. Au total, 80 individus (79,2%) ont débuté un traitement, tandis que 8 patients n’ont pas été traités pour différentes raisons (guérison spontanée, refus, rupture de suivi, absence de couverture sociale). Le critère principal d’efficacité (réponse virologique soutenue (RVS) définie comme l’absence d’ARN viral 12 à 24 semaines après l’arrêt du traitement) était obtenu chez 72 des 80 patients (RVS : 90,0%), les données de 4 patients n’étaient pas encore disponibles. Deux patients ont interrompu prématurément leur traitement et un patient était perdu de vue. Aucun évènement indésirable grave n’a été signalé.
Discussion
La réduction du fardeau de l’infection par le VHC, VHB, VHD et le VIH dans les populations vulnérables n’ayant pas accès aux structures de soins classiques nécessite des stratégies ciblées et axées sur les différentes étapes de la cascade de soins. Cela passe par la mise à disposition des méthodes de dépistage et de diagnostic simples, fiables et peu coûteuses, une simplification des algorithmes de prise en charge et la mise à disposition de thérapeutiques efficaces à un prix accessible pour toutes les populations qui en ont besoin. L’utilisation de tests rapides à proximité du patient ou sur le lieu où les soins sont dispensés (POCT, point-of-care test) et le dépôt de gouttes de sang sur buvard (« DBS sampling ») sont désormais recommandés par nombre de sociétés savantes et l’OMS pour simplifier les algorithmes de prise en charge, augmenter le nombre de sujets dépistés et faciliter la prise en charge médicale en réduisant le nombres de visites médicales 18,19,20,21,22.
Notre étude a montré que le recours au papier buvard (« DBS sampling ») est possible et facilement réalisable, en particulier vis-à-vis des individus fréquentant les structures médico-sociales d’addictologie. Les taux de positivité des hépatites virales C et B et du VIH (respectivement 16,3%, 1,8% et 1,3%), étaient très nettement supérieurs aux prévalences estimées dans la population générale, justifiant le renforcement des politiques de dépistage dans les structures médico-sociales d’addictologie avec la mise à disposition d’outils de dépistage simples et peu coûteux, ainsi que des programmes de réduction des risques. Ces chiffres étaient comparables à ceux de données espagnoles récentes qui indiquaient qu’un peu moins d’un quart des usagers de drogues séropositifs pour le VHC avaient une infection active 21, mais inférieurs aux données américaines où plus de 40% des sujets avaient une infection chronique 16. Cela s’expliquait en partie par la population d’usagers qui était différente. Dans notre étude, moins de la moitié des usagers rapportait une consommation de substances psychoactives par injection ou le partage de seringues ou matériel d’injection. Des injections plus fréquentes, le partage de seringues ou de matériel d’injection sont des comportements généralement associés à une infection par les virus d’hépatites ou le VIH.
Au sein des populations fortement marginalisées (usagers de drogues, sujets incarcérés, travailleurs du sexe), le recours au traitement par antiviraux à action directe (AAD) a nettement augmenté au regard de l’efficacité de ces médicaments dans ces populations et dans une moindre mesure avec l’élargissent de la prescription des AAD aux médecins non spécialistes des maladies du foie 23,24,25. En effet, une étude publiée dans ce numéro du BEH a montré que, depuis l’élargissement de la prescription des AAD en mai 2019 en France, 5,4% des traitements étaient initiés par les médecins généralistes, parmi les 15 938 patients éligibles à une prise en charge simplifiée (période mai 2019 à fin 2022, données issues du Système national des données de santé – SNDS) 26.
Parmi les individus dépistés pour le VHC, 16,3% avaient un ARN positif et la majorité a débuté un traitement antiviral. La plupart des sujets traités ont été guéris. Le nombre de sujets en rupture de suivi avant le début du traitement et en cours de traitement était très faible. En ce qui concerne les patients nouvellement dépistés pour le VHB ou le VIH, respectivement 2 (50%) et 2 (100%) ont débuté un traitement anti(rétro)viral.
Quelques limitations sont cependant à souligner. La population étudiée est un échantillon de convenance, composée majoritairement d’usagers de drogues fréquentant les CSAPA ou Caarud en région parisienne et dans le Nord de la France, et n’est pas forcément représentative de la population fréquentant les structures médico-sociales au niveau national. Les résultats ne sont donc pas généralisables à tous les usagers de drogues en France. Les performances des tests réalisés à partir de sang capillaire prélevé au bout du doigt et déposé sur papier filtre ne sont pas équivalentes à celles des tests réalisés à partir de matrices conventionnelles (plasma, sérum). Ceci est la conséquence d’un plus faible volume de sang collecté, de la présence d’hématies et d’une étape analytique supplémentaire d’extraction des analytes (antigène, anticorps ou acides nucléiques) du papier filtre 27. Les performances des tests réalisés à partir de sang capillaire déposé sur buvard ne sont pas non plus équivalentes à celles des plateformes moléculaires automatisées dites « point-of-care » (intégrant l’extraction, l’amplification et la détection d’acides nucléiques). Une méta-analyse récente montrait que la sensibilité et la spécificité du test Xpert® HCV Viral Load Fingerstick pour la détection d’ARN VHC étaient de 99%. Des chiffres légèrement inférieurs étaient observés avec les DBS (respectivement, 97% et 100%) 28. Avec un rendu rapide (<1 heure), les POCT moléculaires contribuent à la décentralisation du soin vers les structures médico-sociales en permettant une initiation de traitement au même endroit et le même jour (modèle de soins simplifiés).
Conclusion
Le dépistage des virus des hépatites et du VIH à partir de spots de sang séché dans les structures médico-sociales d’addictologie était faisable et facilement implantable sans renforcement de personnels. Les taux de positivité pour le VHB, VIH et le VHC étaient largement supérieurs aux prévalences observées dans la population générale. La plupart des cas nouvellement diagnostiqués ont pu bénéficier d’une prise en charge thérapeutique, en particulier pour l’infection virale C avec une mise sous traitement par antiviraux à action directe avec l’obtention d’une guérison virologique dans la grande majorité des cas. Une seule co-infection par le virus Delta a été identifiée dans cette population.
Remerciements
Nous remercions les participants, les infirmières et travailleurs sociaux pour leur implication, ainsi que les médecins des structures médico-sociales (CSAPA Epice, Créteil ; CSAPA de L’Ouest Audois/CeGIDD, Carcassonne ; CSAPA Boris Vian, Lille (EPSM de l’agglomération lilloise) ; CSAPA La Passerelle, Elbeuf ; CSAPA La Boussole, Rouen ; Caarud Pause Diabolo, Lyon ; CSAPA EGO, Association Aurore, Paris ; CSAPA Oppelia, Évry ; Centre Nova Dona (CSAPA), Paris ; CSAPA de Malaussena, Nice ; CSAPA SOS 75 site « 110, Les Halles », Paris ; CSAPA CèdrAgir, Tourcoing ; CSAPA de l’Archet, Nice ; Caarud Oxygène, Fâches Thumesnil ; CSAPA Intermède, Limoux ; CSAPA La Mosaïque, Montreuil ; Caarud Joao, Tourcoing ; CSAPA Oppelia Le Triangle, Nantes ; CSAPA Châteauroux, Association Addictions France, Châteauroux ; CSAPA Le Mail, Amiens ; CSAPA SATO, Compiègne ; CSAPA ESI 14, Lisieux ; CSAPA EPSM, Caen ; CSAPA Centre Passages, Toulouse ; CSAPA Le Corbillon, Saint Denis ; CSAPA Danielle Casanova, Marseille)
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.




