Épidémie de leptospirose à Mayotte, un territoire endémique, 2016
// Outbreak of leptospirosis in an endemic French territory, Mayotte, 2016
Résumé
La leptospirose est une zoonose endémique dans la plupart des pays de la région de l’océan Indien. À Mayotte, sa surveillance a été renforcée depuis 2008, notamment grâce au signalement systématique à l’Agence de santé Océan Indien de tous les diagnostics confirmés par PCR (Polymerase Chain Reaction) par le laboratoire du Centre hospitalier de Mayotte (CHM).
En 2016, une épidémie de grande ampleur a été observée au cours de la saison chaude et humide, de janvier à avril. Au total, sur l’année, 152 cas autochtones et 3 cas importés ont été recensés, dont 144 entre janvier et mai. L’incidence annuelle était de 65 cas pour 100 000 habitants. À l’image des années précédentes, cette pathologie a touché principalement les hommes (3/4 des cas) âgés d’une trentaine d’années ayant des activités à risque (agriculture, élevage). Les enfants et les femmes adultes étaient touchés en proportions non négligeables (respectivement 26% et 19%). La marche pieds nus (77%) et une exposition à de l’eau de rivières, marécages ou flaques de boue (86%) étaient fréquemment rapportées chez les cas. Le pic de cas a suivi le pic de pluviométrie, mais avec un délai plus bref que les autres années : entre 1 et 2 mois. Le sérogroupe prédominant restait le sérogroupe Mini, représentant plus de 70% des souches typées en 2016. Ceci confirme le caractère atypique de l’épidémiologie microbienne de la leptospirose à Mayotte, avec l’absence d’identification de souches du sérogroupe Icterohaemorragiae.
La leptospirose demeure un problème de santé publique important sur l’île de Mayotte. L’exposition humaine résulte d’une contamination environnementale pendant la saison des pluies, particulièrement abondantes au premier trimestre de l’année 2016. Les actions d’éducation pour la santé et de prévention à destination des populations à risque mais aussi au plus près des jeunes, qui représentent plus de la moitié des habitants de l’île, sont primordiales pour permettre à la population de comprendre la maladie et ses facteurs de risque. En parallèle, certaines mesures globales s’avèrent indispensables pour lutter contre la leptospirose à Mayotte : amélioration de la salubrité de l’habitat, de l’assainissement et de la gestion des déchets domestiques, et généralisation de l’accès à l’eau potable.
Abstract
Leptospirosis is an endemic zoonosis in most countries of the Indian Ocean region. In Mayotte, surveillance of leptospirosis has been strengthened since 2008, through the systematic reporting to the Indian Ocean Health Agency of all diagnostics confirmed by PCR by the Laboratory of the Centre Hospitalier de Mayotte (CHM). In 2016, a major outbreak was observed during the hot and humid season, from January to April. In total, 152 autochthonous cases and 3 imported cases were recorded during the year, 144 of which between January and May. The annual incidence was 65 cases per 100,000. As in previous years, this pathology mainly affected men (3/4 of the cases) aged about thirty years with activities at risk (agriculture, farming). Children and women were also affected in proportion not negligible (26% and 19% respectively). Walking barefoot (77% of cases) and water exposure from rivers, marshes and mud (86% of cases) are the main risk factors. The peak of cases followed the peak of rainfall but with a shorter delay than during the other years: between 1 and 2 months. The predominant serogroup remained the Mini serogroup with 70% of the strains typed in 2016, which confirmed the atypical microbial epidemiology of leptospirosis in Mayotte with the absence of the serogroup Icterohaemorragiae. Leptospirosis remains an important public health problem on the island of Mayotte. Human exposure results from environmental contamination during the rainy season, which was particularly abundant in the first quarter of 2016. Health education and prevention measures targeting at-risk populations, as well as young people, who represent more than half of the island’s population, are essential to enable the population to understand the disease and its risk factors. At the same time, some measures are needed to fight against leptospirosis in Mayotte: improvements in habitat, sanitation, waste management, and widespread access to drinking water.
Introduction
À Mayotte, département français situé dans le sud-ouest de l’Océan Indien, la leptospirose demeure un véritable problème de santé publique. Il s’agit d’une pathologie saisonnière avec une incidence maximale en saison chaude et humide 1. Mayotte étant située en zone tropicale, la saisonnalité de la maladie est très marquée, avec une recrudescence habituellement observée trois mois après le début de la saison des pluies qui s’étend habituellement de décembre à mars 2,3.
La leptospirose est due à une bactérie spirochète du genre Leptospira. Si cette bactérie peut être hébergée par de nombreux animaux, les rongeurs, et plus particulièrement les rats, constituent son principal réservoir. De nombreux autres mammifères de compagnie (chiens), d’élevage (bovins) ou sauvages (chiroptères frugivores telles que les roussettes) sont impliqués dans le maintien et la transmission à l’Homme de la leptospirose 4. Le tanrec, petit mammifère introduit de Madagascar, a récemment été identifié comme réservoir de l’espèce L. mayottensis 5. La transmission s’effectue par contact direct (avec un animal infecté) ou indirect (avec un environnement souillé par les urines animales : eaux douces, eaux de surface, sols boueux, égouts) de la peau lésée ou des muqueuses de l’Homme. La bactérie a une capacité de survie de plusieurs mois dans l’eau douce, ce qui favorise la contamination 1.
À Mayotte, cette pathologie touche des populations dites à risque, de par leurs pratiques agricoles ou d’élevage ou leur fréquentation de bassins ou rivières d’eaux douces (pêche, baignade, activités domestiques…). En 2015, la marche pieds nus ou sans chaussures fermées a été retrouvée comme mode de contamination possible chez un tiers des patients 3.
La période d’incubation est de 10 jours en moyenne (extrêmes : 2 à 21 jours). La maladie est souvent bénigne (simple syndrome grippal) mais elle peut conduire à une défaillance multi-viscérale avec insuffisances rénale et hépatique associées à un syndrome hémorragique (maladie de Weil). Les formes graves et les décès restent rares à Mayotte : le taux de létalité moyen pour la période 2010-2015 était de 0,9%, soit moins d’un décès par an depuis 2010 3.
Le diagnostic rapide (en 24 heures) et précoce (dès l’apparition des signes cliniques) de la maladie peut être posé grâce à une PCR (Polymerase Chain Reaction). La sérologie (Elisa et/ou test de micro-agglutination) permet également la confirmation du diagnostic à partir de la deuxième semaine suivant l’apparition des symptômes. Il existe 10 espèces pathogènes et plus de 300 sérovars répartis en plus de 24 sérogroupes 6. À Mayotte, on observe une grande diversité au sein des souches isolées et une nouvelle espèce pathogène pour l’Homme a récemment été identifiée : Leptospira mayottensis 7. Depuis plus de 10 ans, le Centre national de référence (CNR) de la leptospirose décrit l’épidémiologie atypique du territoire, où prédomine le sérogroupe Mini 8. Le sérogroupe Icterohaemorrhagiae, le plus fréquemment rencontré en France métropolitaine et à La Réunion, n’a jamais été identifié sur l’île via une technique moléculaire. L’étude de séroprévalence menée en 2011 avait également montré la prédominance du sérogroupe Mini, qui concernait 74,5% des cas 8,9,10. L’infection induit une immunité contre le sérovar infectant.
La stratégie thérapeutique repose sur une antibiothérapie précoce (amoxicilline, céphalosporines ou cyclines) permettant de réduire la durée et la gravité des symptômes 11. Les formes graves peuvent nécessiter une hospitalisation en réanimation. À titre préventif, la vaccination (Spirolept®) peut être proposée aux populations à risque, mais elle présente peu d’intérêt à Mayotte étant donné la faible prévalence du sérogroupe contre lequel protège ce vaccin (Icterohaemorrhagiae) 8.
En 2014, selon le CNR, l’incidence estimée de la maladie était de 0,98 cas pour 100 000 habitants en France métropolitaine, avec 628 cas de leptospirose recensés. Dans les Outre-Mer, l’incidence était de 10 fois (La Réunion, Nouvelle-Calédonie) à plus de 30 fois (Mayotte, Guyane, Guadeloupe, Martinique, Polynésie française) plus élevée qu’en métropole. En effet, pour La Réunion, 61 cas ont été recensés et 162 à Mayotte 8, correspondant respectivement à des incidences de 7,4 et 74,6 pour 100 000 habitants. À l’échelle mondiale, la leptospirose serait responsable de plus d’un million de cas et environ 60 000 décès chaque année 12.
En 2016, une situation épidémique inédite a été observée à Mayotte. Cet article présente les données épidémiologiques recueillies dans le cadre de la surveillance spécifique de la leptospirose sur ce territoire français endémique.
Méthodes
Depuis 2008, la surveillance épidémiologique de la leptospirose repose sur le signalement de tous les cas biologiquement confirmés par le laboratoire du Centre hospitalier de Mayotte (CHM) à la cellule de veille, d’alerte et de gestion sanitaires (CVAGS) de l’Agence de santé océan Indien (ARS OI) à Mayotte. Cette surveillance entre dans le cadre du dispositif de surveillance des syndromes dengue-like pour toutes les consultations réalisées au CHM. En effet, tout patient présentant un tel syndrome fait l’objet d’une recherche systématique par PCR ou sérologie portant sur la dengue, le chikungunya et la leptospirose. La recherche de la fièvre de la vallée du Rift, initialement incluse dans les analyses, a été supprimée du dispositif depuis le 1er janvier 2017 en raison de l’absence de nouveaux cas humains depuis 2008.
Certaines souches isolées sont envoyées pour typage au Centre national de référence de la leptospirose à l’Institut Pasteur de Paris.
À Mayotte, depuis 2010, pour chaque cas confirmé, une enquête individuelle systématique permet d’investiguer le cas grâce à un questionnaire standardisé. Ainsi, des données sociodémographiques (âge, sexe, commune de résidence, notion de voyage) et cliniques (antécédents médicaux, modalités de prise en charge hospitalière, évolution) sont récoltées. À cela s’ajoutent les données d’investigation au domicile ou par téléphone renseignant les facteurs de risque de contamination, qu’ils soient comportementaux (activités à risque) ou environnementaux (type d’habitat, accès à l’eau, contact avec des animaux). Ces données sont recueillies et enregistrées par la CVAGS de l’ARS OI.
Les données sont analysées par la Cellule d’intervention en région Océan Indien (Cire OI) de Santé publique France afin de décrire l’évolution de la situation épidémiologique sur le territoire.
L’analyse descriptive des cas a été réalisée sur les cas autochtones uniquement (N=152). L’analyse des données environnementales et comportementales a été réalisée sur les 121 cas autochtones pour lesquels une enquête a été réalisée.
Les données de pluviométrie (en mm) ont été fournies par Météo France.
Les analyses statistiques ont été réalisées à l’aide du logiciel Stata12®.
Résultats
Incidence et pluviométrie
En 2016, 155 nouveaux cas de leptospirose (152 cas autochtones et 3 cas importés d’Anjouan, aux Comores) ont été déclarés à la CVAGS. Cela représente un taux d’incidence global de 65 cas pour 100 000 habitants.
L’année 2016 a été marquée par un phénomène épidémique majeur lors de la saison des pluies, avec 144 cas diagnostiqués entre le 1er janvier 2016 et le 31 mai 2016. Pour comparaison, en moyenne sur les dix dernières années et sur la même période de l’année, une soixantaine de cas avaient été signalés.
Selon les données de pluviométrie sur l’île de Mayotte, les premiers mois de l’année 2016 ont été marqués par des précipitations abondantes, avec un mois de février particulièrement pluvieux : 466 mm, soit quasiment deux fois plus que la moyenne calculée entre 2008 et 2015 pour le même mois (figure 1).
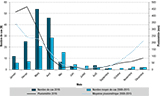 Agrandir l'image
Agrandir l'imageRépartition géographique
Des cas ont été rapportés sur l’ensemble de l’île et la majorité d’entre eux provenait des communes de Mamoudzou (28,7%) et Chirongui (12,7%). Le taux d’incidence variait selon le lieu de résidence du cas et semblait plus élevé dans les zones centre et sud de l’île (figure 2). Seul un cas a été identifié sur Petite-Terre, à Dzaoudzi.
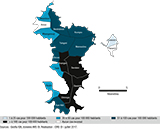 Agrandir l'image
Agrandir l'imageDescription des cas
Caractéristiques démographiques
Au total, 75% des patients infectés étaient des hommes (N=114). La moyenne d’âge était de 29 ans [1-85 ans], sans différence selon le sexe, à la différence de la période 2010-2015 où les femmes étaient plus jeunes que les hommes. Les enfants (moins de 18 ans) représentaient 26% des cas déclarés. La répartition des cas par tranche d’âge et sexe est rapportée dans la figure 3.
 Agrandir l'image
Agrandir l'imageLes cas se déclaraient le plus souvent sans profession (homme ou femme au foyer ; 23%) mais également élèves ou étudiants (16%). Les agriculteurs-jardiniers et les éleveurs représentaient respectivement 9,9% et 10,5% des cas. Dans 28% des cas, l’activité professionnelle n’était pas renseignée (tableau).
 Agrandir l'image
Agrandir l'imageDonnées cliniques
Le délai moyen entre la date de début des symptômes et la date de prélèvement (sous-entendu, la date de consultation au CHM) était de 2,5 jours. Par ailleurs, on a observé un délai moyen de 7 jours entre la date de prélèvement du patient et la date de déclaration à la CVAGS par le laboratoire du CHM.
Au total, 72,4% des cas ont présenté un syndrome dengue-like en amont du diagnostic d’infection : fièvre ≥38,5°C associée à un ou plusieurs symptômes non spécifiques (douleurs musculo-articulaires, manifestations hémorragiques, céphalées frontales, asthénie, signes digestifs, douleur rétro-orbitaire, éruption maculo-papuleuse). Six pour cent des cas (N=9) ont présenté des manifestations viscérales (rénales, hépatiques, neurologiques, cardiovasculaires, pulmonaires ou hémorragiques). Seuls 2 patients avaient une pathologie sous-jacente au moment de l’infection, dont l’un atteint d’une cardiopathie.
La prise en charge des patients a reposé sur un traitement symptomatique (70,4% des cas), associé à une antibiothérapie (80,9% des cas). Le traitement comprenait de l’amoxicilline dans 70% des cas (N=106). L’information n’était pas disponible pour 26% des cas.
Parmi les 152 cas, 34 ont été hospitalisés au CHM (soit 22%), dont 7 ont été admis en réanimation. Parmi ces derniers, 6 ont présenté des manifestations viscérales. Ces 7 patients étaient tous des hommes et la moyenne d’âge était de 36 ans (23-60 ans). Aucun d’entre eux n’avait de pathologie sous-jacente.
Un seul décès a été rapporté en 2016. Il s’agissait d’un patient pour lequel une PCR leptospirose s’est avérée positive ; un traitement antibiotique a été initié et le patient est décédé suite à un arrêt cardiaque, probablement en lien avec l’infection.
Données microbiologiques
En 2016, le diagnostic biologique a été porté par une technique moléculaire (PCR) pour 98% des patients (N=149).
Onze souches ont pu être analysées au CNR de la leptospirose, qui a identifié huit souches de L. borgpetersenii sérogroupe Mini, une souche de L. borgpetersenii sérogroupe non déterminé, une souche de L. mayottensis sérogroupe non déterminé et une souche de L. kirschneri sérogroupe Mini.
Données environnementales
La plupart des cas habitaient des maisons traditionnelles en terre ou en tôle (55,4%) et 43,8% d’entre eux vivaient dans une maison en dur. Plus de la moitié des cas (66,9%) possédaient un jardin de terre ou de végétation autour de la maison. Aucun patient n’a déclaré avoir voyagé hors de Mayotte dans le mois précédant le début des symptômes.
Des animaux étaient présents dans l’environnement direct de tous les malades : il s’agissait majoritairement de rats (93,4% des cas) mais l’on retrouvait aussi des chats (42%), des volailles (38,8%), des makis (25%), des chauves-souris (20%), des caprins (19%), des chiens (9,9%) et des bovins (8,3%). Les 7 cas hospitalisés en réanimation ont signalé des rats dans leur environnement.
La plupart des cas (55%) ne possédaient pas de poubelles fermées au domicile et rapportaient avoir des ordures au sol ou des poubelles ouvertes à la maison. Plus de deux tiers des cas (67%) ne disposaient pas d’un moyen de gestion des ordures et déclaraient accumuler leurs déchets dans la cour de la maison ou dans les environs.
Données comportementales
Près de la moitié des cas (47,1%) rapportait un bain ou un loisir nautique réguliers, le plus souvent en rivière (46,3%).
Soixante pour cent des cas pratiquaient régulièrement une activité d’agriculture ou de jardinage (une fois par jour à une fois par semaine) et seulement 4% d’entre eux disaient utiliser une protection des pieds au cours de ces activités. Des activités d’élevage animalier ont été rapportées par 26,4% des cas, d’une fois par semaine à une fois par mois. Seuls 2 cas ont déclaré utiliser une protection au cours de ces activités.
Une grande majorité de patients (77%) disaient marcher régulièrement pieds nus, tous les jours pour 63% d’entre eux, et 86% d’entre eux étaient alors exposés à de l’eau de rivières, marécages ou flaques de boue.
Quasiment la moitié des cas (47,1%) présentaient des lésions cutanées, portes d’entrées plausibles d’infection, dans le mois précédant l’infection.
Discussion
Selon les données de surveillance recueillies entre 2008 et 2015, l’incidence moyenne annuelle de la leptospirose à Mayotte est estimée à 47 cas pour 100 000 habitants 3. Le 101e département français est donc une zone de haute endémicité pour la leptospirose, avec une saisonnalité très marquée au cours de l’été austral.
Au début de l’année 2016, une importante épidémie a marqué la saison chaude et pluvieuse, de janvier à avril. On a pu observer une augmentation du nombre de cas au-delà de la recrudescence habituellement constatée à la même période : 135 cas en 2016 contre 66 en moyenne de 2008 à 2015. Cela représente un taux d’incidence global de 65 cas pour 100 000 habitants en 2016 contre 39 cas en 2015, soit un doublement de l’incidence. Un tel chiffre n’avait jamais été observé en huit années de surveillance, excepté au cours de deux années particulières ayant conduit à une augmentation des recherches de leptospirose : 2011 (année d’étude de séroprévalence de la leptospirose chez l’Homme) et 2014 (année épidémique pour la dengue, pathologie incluse dans le dispositif de surveillance des syndromes dengue-like, au même titre que la leptospirose) 3. Toutefois, il convient de noter la sensibilisation permanente des professionnels de santé vis-à-vis de cette pathologie endémique sur l’île, ce qui permet chaque année, depuis dix ans, d’en optimiser le diagnostic. En effet, depuis 2008, la surveillance de la leptospirose a été renforcée dans le cadre du dispositif de surveillance biologique des syndromes dengue-like. Il n’est pourtant pas impossible que la situation épidémiologique soit sous-estimée. En effet, devant une suspicion d’infection, tous les patients ne font pas l’objet d’une confirmation biologique au laboratoire avant l’instauration d’une antibiothérapie. Certains cas ne sont pas identifiés par ce dispositif de surveillance. Par ailleurs, se pose la question du renoncement aux soins au sein d’une population aux conditions de vie précaires. En 2012, 26 000 étrangers étaient en situation irrégulière sur le territoire, soit autant de personnes avec un accès aux soins limité et pour lesquelles seule une grave dégradation de l’état de santé est un motif de consultation. Les patients alors pauci-symptomatiques ne seront jamais vus en consultation, à la différence des cas qui ne se présenteront au CHM qu’à un stade avancé de la maladie.
Il semble que cette épidémie d’ampleur inhabituelle soit en partie due à une pluviométrie particulièrement importante en 2016. En effet, sur les 4 premiers mois de l’année, on a observé une augmentation des pluies de 52% par rapport aux années précédentes : 831 mm en moyenne de 2008 à 2015 versus 1 264 mm en 2016. Habituellement à Mayotte, le pic de pluviométrie observé en janvier engendre un pic d’incidence de la maladie au mois d’avril. Cependant, il semble que l’importance des pics d’incidence de la leptospirose soit davantage liée au nombre de mois consécutifs avec de fortes pluies plutôt qu’à la pluviométrie totale 2,3. En 2016, le pic de pluviométrie s’est étalé sur les mois de janvier et février (respectivement 428 mm et 466 mm de pluies tombées) et le pic de cas a rapidement été observé au cours des mois de mars (N=54) et avril (N=46 cas). Le délai d’apparition du pic saisonnier a donc été plus court que les années précédentes 2. Pour autant, cette dynamique épidémique avait déjà été observée en 2011 et 2014 suite à plusieurs mois consécutifs de fortes pluies.
En 2016, 80% des cas déclarés ont été investigués par la CVAGS. C’est plus que la moyenne observée entre 2008 et 2015 (environ 50%) 3, et cela malgré les obstacles rencontrés pour s’entretenir avec les patients (barrière de la langue, coordonnées erronées, difficultés d’accès au domicile...).
L’analyse de la répartition géographique des cas n’a pas permis de mettre en évidence des zones plus à risque que d’autres. Contrairement aux années précédentes, les taux d’incidence n’étaient pas significativement différents entre le Nord et le Sud de l’île. En effet, en 2014 et 2015, plus des trois quart des cas de leptospirose signalés au premier trimestre provenaient du Nord de l’île. En 2016, la tendance semblait plutôt s’inverser. Cependant, les communes prises en compte dans l’analyse sont celles de résidence pour le cas et ne constituent donc pas un fidèle reflet des zones de contamination potentielles.
En 2016, malgré un nombre important de cas, la létalité de la leptospirose a été de 0,6% et le taux d’hospitalisation globalement faible (22%), proche de celui retrouvé à Mayotte sur la période 2008-2015 et inférieur à celui de La Réunion entre 2004 et 2015 (93%). Un peu moins d’un quart des patients hospitalisés ont été admis en réanimation mais aucune caractéristique pouvant expliquer leur gravité (comme une pathologie sous-jacente) n’a pu être mise en évidence.
Malgré le turn-over important des équipes médicales qui se succèdent au CHM et dans les centres de santé périphériques, la leptospirose est une pathologie bien connue des cliniciens à Mayotte. Devant un tableau évocateur, le patient fait systématiquement l’objet d’une antibiothérapie adaptée, sans attente de confirmation biologique. Cette prise en charge précoce est certainement l’une des explications du faible taux de formes sévères observées sur l’île. Cela peut également s’expliquer par l’absence du sérogroupe Icterohaemorrhagiae particulièrement pathogène, et impliqué dans la majorité des formes les plus sévères. En 2016, même si seulement 13 souches ont pu être analysées par le CNR, leur typage a permis de confirmer l’épidémiologie atypique des souches circulantes à Mayotte : absence du sérogroupe Icterohaemorrhagiae et prédominance du sérogroupe Mini. Le sérogroupe Icterohaemorrhagiae est identifié dans 2/3 des cas graves à l’hôpital en France métropolitaine, mais aussi dans d’autres régions du monde comme la Nouvelle-Calédonie 13, et chez jusqu’à 91% des cas graves à l’hôpital en Martinique 14. Dans le monde, il est associé au plus haut taux de létalité, qui atteint 13,6% pour les cas non soignés 15.
À Mayotte, toutes les conditions sont réunies pour expliquer une telle incidence de la leptospirose : population rurale, omniprésence de l’eau en saison humide, promiscuité homme-animal. De nombreuses caractéristiques environnementales ou comportementales favorables à la contamination ont été rapportées. La majorité des cas vivaient dans des conditions précaires (maison en tôle ou en terre) avec un accès à l’eau non systématique. La baignade ou les activités domestiques dans les rivières, faute d’accès à l’eau courante, sont des pratiques traditionnelles et peuvent expliquer le nombre non négligeable de femmes et d’enfants touchés par la maladie.
Actuellement, la prévention passe par les moyens de lutte collective (limiter la prolifération des rongeurs, gérer les déchets domestiques) et les actions de sensibilisation auprès des professionnels ayant des facteurs de risque de contamination, comme les hommes pratiquant l’agriculture ou l’élevage (port d’équipements de protection adaptés). Au-delà de ces actions à destination des populations à risque, il apparait important de développer des mesures de prévention concrètes à l’égard des enfants. En effet, à Mayotte, plus jeune département de France, plus de la moitié de la population a moins de 20 ans 16. Si plusieurs études ont montré qu’il existe des différences en termes d’expression clinique de la maladie entre adultes et enfants atteints de leptospirose, les adultes étant plus enclins à développer une forme sévère de la maladie 17,18, les enfants représentaient néanmoins plus d’un quart des cas de leptospirose recensés en 2016. Des campagnes d’information et des ateliers d’éducation pour la santé auprès des jeunes et des mères de famille permettraient d’expliquer la maladie, ses modes de contamination et les moyens de prévention simples et adaptés au contexte local. Des gestes simples comme la désinfection et la protection des plaies cutanées pourraient permettre de diminuer l’incidence de la maladie.
Enfin, il apparait primordial d’améliorer de façon globale la salubrité de l’habitat et la gestion des déchets domestiques, et de généraliser l’accès à l’eau potable et à l’assainissement. Il s’agit de mesures essentielles pour lutter contre la maladie sur l’ensemble du territoire.
Six ans après sa départementalisation, Mayotte est un territoire en pleine mutation socio-économique, avec une urbanisation rapide et, pour autant, des habitats et conditions de vie qui demeurent précaires pour de nombreux mahorais. Les changements climatiques qui s’opèrent à l’échelle mondiale suggèrent une nouvelle dynamique des épidémies saisonnières de leptospirose qu’il sera nécessaire de suivre dans les prochaines années pour adapter les mesures de prévention.




