Surveillance du paludisme à Mayotte entre 2007 et 2016
// Malaria surveillance in Mayotte (France) between 2007 and 2016
Résumé
Introduction –
Dans l’Archipel des Comores, le paludisme est endémique et constitue un problème majeur de santé publique, avec une transmission intense et permanente. Plasmodium falciparum est responsable de la majorité des cas de paludisme sur l’île de Mayotte. Cette étude rapporte les résultats de 10 années de surveillance du paludisme à Mayotte entre 2007 et 2016.
Matériel et méthodes –
Tous les cas de paludisme notifiés à la délégation de Mayotte de l’Agence de santé de l’Océan Indien entre 2007 et 2016, dans le cadre de la déclaration obligatoire, ont été inclus dans l’analyse. Les cas ont été confirmés par au moins un test de diagnostic rapide et/ou un frottis sanguin ou une goutte épaisse positive à Plasmodium sp. Un recueil de données sociodémographiques, la date de survenue de la maladie, la présentation des symptômes, des données biologiques et des antécédents de séjour éventuels en zone impaludée a été réalisé en consultation ou en cours d’hospitalisation des cas. Les données mensuelles de pluviométrie ont été compilées sur la période d’étude.
Résultats –
Entre 2007 et 2016, 2 113 cas de paludisme ont été rapportés à Mayotte : 997 cas importés, 826 cas autochtones et 290 cas d’origine inconnue. L’incidence globale annuelle a diminué, passant de 3 cas pour 1 000 habitants en 2007 à 0,05 cas en 2015 (0,12 en 2016) et, pour les cas autochtones sur la même période, de 1,6 à 0,004 cas pour 1 000 (0,08 en 2016). En 2011, Mayotte est entrée en phase d’élimination du paludisme selon la définition de l’Organisation mondiale de la santé (incidence annuelle de P. falciparum en dessous d’1 cas pour 1 000 personnes à risque).
Discussion – Conclusion –
Les actions combinées de la lutte anti-vectorielle avec la surveillance active autour des cas et leur prise en charge, incluant le diagnostic et le traitement par des médicaments dérivés de l’artémisinine, ont eu un rôle essentiel dans la diminution de la transmission à Mayotte. Mayotte est entrée en phase d’élimination du paludisme, mais des cas autochtones sont survenus en 2016 dans l’ancien foyer de Bandraboua et l’implication du moustique Anopheles funestus est suspectée. Des études sont nécessaires pour évaluer son rôle dans cette réémergence. Par ailleurs, des approches communautaires pour une lutte anti-vectorielle localisée pourraient être intéressantes, en parallèle d’une politique de lutte régionale contre le paludisme.
Abstract
Introduction –
Plasmodium falciparum is responsible for most malaria cases on Mayotte Island. Malaria is endemic and a major public health problem in the Comorian Archipelago with an intense and permanent transmission. This study reports results of 10 years of malaria surveillance in Mayotte from 2007 to 2016.
Materials and methods –
Surveillance was based on physicians’ reports of malaria cases to the Delegation of the Regional Health Agency in Mayotte between January 2007 and December 2016. Malaria cases were confirmed by at least a positive rapid diagnostic test and/or demonstration of Plasmodium sp. in a blood smear. The date of onset, and the patients’ age, sex, address, presentation of symptoms, biology, treatment and recent history of travel were collected by verbal questioning during consultation and/or hospitalization. Monthly rainfall data were also compiled during the study period.
Results –
From 2007 to 2016, 2,113 cases were reported on Mayotte Island: 997 imported cases, 826 autochthonous cases and 290 cases of unknown origin. The total malaria annual parasite incidence lowered from 3.0 in 2007 to 0.05 per 1,000 inhabitants in 2015 (0.12 in 2016) as the autochthonous malaria incidence decreased from 1.6 to 0.004 per 1,000 inhabitants in the same period (0.08 in 2016). Mayotte entered the elimination phase in 2011, as the the World Health Organization definition, when P. falciparum annual parasite incidence reached less than 1 case per 1,000 people at risk.
Discussion – Conclusion –
The combination of vector control measures, active surveillance around cases and case management, including effective treatment with artemisinin-based combination therapy, has been essential to achieve a present status of low malaria transmission on the island. Mayotte has entered the elimination phase, but some autochthonous cases occurred in 2016 in the former case cluster of Bandraboua and implication of Anopheles funestus is suspected. Studies are required to assess the role of An. funestus in this reemergence. Community-based approaches for localized vector control could also be of interest in parallel with a regional management policy.
Introduction
Mayotte est une île de l’archipel des Comores, située dans le canal du Mozambique entre Madagascar et la côte est de l’Afrique. Elle est en réalité constituée d’un ensemble d’îles dont deux principales, Grande-Terre et Petite-Terre (figure 1). Mayotte est un département français depuis 2011. Sa population, estimée à 235 132 habitants en 2016, est répartie sur 376 km², soit 625 hab/km², dont 54% ont moins de 20 ans 1. L’immigration légale et clandestine y est importante, avec 40% de la population d’origine étrangère 2. Le climat est tropical et humide, avec une saison chaude pluvieuse de novembre à avril/mai et une saison sèche entre mai et octobre. Les trois autres îles de l’archipel forment l’Union des Comores depuis l’indépendance vis-à-vis de la France en 1975.
Le paludisme est endémique dans l’archipel et constitue un problème de santé publique, avec une transmission permanente. Huit espèces d’anophèles ont été observées à Mayotte, dont quatre sont considérées comme des vecteurs primaires de la maladie : Anopheles gambiae s.s., Anopheles funestus, Anopheles mascarensis et Anopheles merus. Les rôles d’An. mascarensis et An. merus sont peu documentés mais semblent mineurs 3. An. gambiae s.s. est retrouvé en permanence sur toute l’île alors que la répartition d’An. funestus est moins décrite, mais des moustiques adultes ont été retrouvés à Bandraboua dans le nord de l’île, où un foyer de transmission a été identifié en 2004 4. Ces deux dernières espèces sont endophiles 5.
Pendant des années, Plasmodium falciparum a été le seul parasite identifié parmi les cas cliniques. Plus récemment, P. vivax a été retrouvé parmi des cas autochtones 6. P. ovale et P. malariae ont été rapportés principalement dans les îles voisines 7,8.
Avant les années 1970, la politique de contrôle du paludisme à Mayotte était limitée. En 1972, la prévalence du parasite s’élevait à 36,5% parmi les enfants de Petite-Terre. Un programme de chimioprophylaxie par chloroquine a alors été lancé chez les femmes enceintes et les enfants en dessous de 15 ans 9. En 1976, une unité de contrôle du paludisme a été créée et l’aspersion intradomiciliaire ainsi que la destruction des gîtes larvaires ont été instaurées. Ainsi, la prévalence globale du parasite a baissé de 25,5% en 1976 à 0,9% en 1980, et l’objectif d’élimination était presque atteint 10.
Cependant en 1984, 1987, 1994 et 1995, Mayotte a subi plusieurs épidémies de paludisme et la prévalence du parasite était de 2% en 1996, en partie du fait de la baisse des activités de contrôle au début des années 1980 11. En outre, la chimioprophylaxie par chloroquine a été arrêtée en 1986, sauf pour les femmes enceintes, en raison d’une baisse d’efficacité dans la zone Océan Indien et des recommandations de l’Organisation mondiale de la santé (OMS) 12. En 2001, l’incidence annuelle du parasite était de 20/1 000 habitants soit environ 3 000 nouveaux cas par an. Par la suite, selon les recommandations du programme Roll Back Malaria, de nouvelles mesures de contrôle du paludisme ont été mises en place avec la distribution gratuite de moustiquaires imprégnées, notamment à destination des femmes enceintes et des enfants, combinée à l’aspersion intradomiciliaire avec la deltaméthrine et l’utilisation de tests de diagnostic rapide (TDR). Entre 2002 et 2007, les patients avec une forme non compliquée de paludisme recevaient une association de chloroquine et de sulfadoxine-pyriméthamine. Les médicaments dérivés de l’artémisinine (ACT) ont été introduits en mai 2007 comme traitement de première ligne. Les dispositifs de surveillance se sont aussi renforcés 13. En 2006, l’incidence annuelle estimée du parasite était de 3,1/1 000 habitants, avec 496 cas ; soit une nette diminution en particulier parmi les enfants de moins de 5 ans 6.
Ce travail rapporte les résultats de 10 années de surveillance du paludisme à Mayotte entre 2007 et 2016 après l’intensification des mesures de contrôles du paludisme à Mayotte et, au niveau régional, dans les îles voisines.
Matériel et méthodes
La surveillance du paludisme à Mayotte repose sur la déclaration obligatoire des cas, par les médecins et les laboratoires, auprès de la Cellule de veille, d’alerte et de gestion sanitaires (CVAGS) de l’Agence de santé Océan Indien (ARS-OI), délégation de Mayotte.
Tous les cas de paludisme notifiés entre 2007 et 2016 ont été inclus dans l’analyse. Pour chaque cas, les médecins ont renseigné un formulaire et fourni des données cliniques, de gravité et d’hospitalisation. Le recueil concernait des données sociodémographiques, la date de survenue de la maladie, la présentation des symptômes, des données biologiques et des antécédents de séjour éventuels en zone impaludée. Après anonymisation et validation des cas, les données étaient transmises à la Cellule d’intervention en région Océan Indien de Santé publique France (Cire OI) pour analyse. La collecte de données de surveillance est approuvée par la Commission nationale de l’informatique et des libertés (Cnil), en accord avec la réglementation française sur la confidentialité des données de la déclaration obligatoire (autorisation n°02-082 du 19 novembre 2002).
Un cas autochtone de paludisme à P. falciparum est défini comme un cas confirmé par un frottis ou une goutte épaisse, acquis sur l’île de Mayotte, sans antécédents de voyage dans le mois précédent l’infection. Un cas importé a été infecté en dehors de Mayotte, avec antécédent de séjour en zone impaludée dans le mois précédent l’infection par P. falciparum.
Le Centre hospitalier de Mayotte (CHM) est composé d’un hôpital central à Mamoudzou, cinq hôpitaux périphériques et 13 dispensaires répartis sur toute l’île. Le paludisme est recherché chez tout patient présentant une fièvre >38,5°C prise dans l’oreille. Depuis septembre 2001, le diagnostic est réalisé au plus près des patients par TDR (OptiMAL IT®, Laboratoire Bio Rad, France). Les TDR sont confirmés par un frottis ou une goutte épaisse, principalement au laboratoire du CHM ou bien dans l’unique laboratoire privé de l’île. En cas de discordance, une PCR (Polymerase Chain Reaction) est réalisée pour distinguer les faux positifs des faibles parasitémies. Tout cas confirmé avec une forme non compliquée reçoit un traitement de trois jours consécutifs par ACT (depuis 2007). Si la parasitémie persiste à sept jours, un second traitement est recommandé par atovaquone/proguanil ou méfloquine. Les cas sévères et les femmes enceintes sont systématiquement hospitalisés et traités par quinine 14.
Un service de lutte anti-vectorielle (LAV) a été créé en 2002 au sein de l’ARS. Cette unité est destinée au contrôle des populations d’insectes vecteurs, notamment anophèles (adultes et larves), à la mobilisation sociale, à la distribution de moustiquaires imprégnées d’insecticide longue durée (MIILD), à l’aspersion intradomiciliaire, au contrôle des gîtes larvaires et à l’évaluation de la résistance des vecteurs aux insecticides en accord avec les standards de l’OMS. La lutte contre les gîtes larvaires utilise le Bacillus thuringiensis israelensis (souche Bti AM65-52, VectoBac® WG 37,4%), le téméphos ou le diflubenzuron, un inhibiteur de croissance. La pulvérisation intradomiciliaire ou extérieure est réalisée avec un adulticide, la deltaméthrine.
Entre 2007 et 2009, l’aspersion intradomiciliaire a été proposée dans chaque maison de l’île, avec au moins un traitement par an. Des traitements supplémentaires ont été réalisés dans l’habitation des cas et les maisons avoisinantes. Dans les foyers actifs de cas, l’objectif était de réaliser deux traitements par an. Depuis 2010, l’aspersion intradomiciliaire a progressivement été remplacée par la distribution de MIILD dans les foyers actifs de l’île, dont celui de Bandraboua. L’année suivante, la distribution des MIILD a été généralisée sur toute l’île, à raison d’une moustiquaire par lit dans chaque maison.
À partir de 2011, les activités de routine de LAV ont été renforcées par des interventions spécifiques autour des cas, avec une enquête environnementale pour identifier l’origine de la contamination. Cette surveillance active autour des cas consiste à rechercher la présence de vecteurs, à réaliser un échantillonnage et à rechercher d’autres cas éventuels dans l’environnement proche du cas index. Après une information aux habitants sur le paludisme et sa transmission, une distribution gratuite de MIILD est réalisée au domicile du cas et dans les maisons avoisinantes, les gîtes larvaires sont traités et une pulvérisation intradomiciliaire d’insecticide est proposée.
Les données de température et de pluviométrie ont été compilées et fournies par Météo France à partir de sept zones réparties à différentes altitudes autour de l’île.
Les résultats des investigations ont été saisis sur EpiData 3.1®. Des courbes d’incidences par année et par zone ont été réalisées avec le logiciel Qgis 2.2 (Fondation OSGEO®).
Résultats
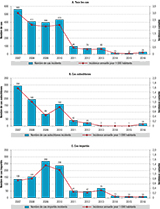
Entre 2007 et 2016, 2 113 cas de paludisme ont été rapportés à la CVAGS de Mayotte : 997 cas importés, 826 cas autochtones et 290 cas d’origine inconnue. L’incidence globale annuelle a diminué, passant de 3 cas pour 1 000 habitants en 2007 à 0,05 cas en 2015 (0,12 en 2016), et de 1,6 à 0,004 cas autochtones pour 1 000 habitants sur la même période (0,08 en 2016) (figure 2).
 Agrandir l'image
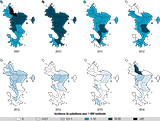
Agrandir l'imageEntre 2007 et 2010, 366 cas ont été rapportés dans le foyer de Bandraboua, soit 45% des cas autochtones de l’île sur la période 2007-2016. À l’exception de ce foyer, la plupart des cas autochtones sont survenus dans un contexte familial ou dans le voisinage de cas importés. Quelques petits foyers ont été observés, notamment dans la commune de Dembéni et à Miréréni dans la commune de Chirongui jusqu’en 2016 où on observe à nouveau un foyer à Bandraboua, avec la survenue de 10 nouveaux cas, dont 8 cas autochtones (figure 3).
 Agrandir l'image
Agrandir l'imageAprès une augmentation entre 2007 et 2010, le nombre de cas importés a chuté à 10 en 2016. Ils provenaient pour la plupart des Comores (92%), en majorité de Grande Comore (79%), en augmentation sur la période (69% en 2007, 84% en 2013), puis d’Anjouan (17%), en diminution de 29% en 2007 à 7% en 2012, 2% de Mohéli et 2% sans précision. Une minorité (6%) provenait de Madagascar, 2% d’Afrique (de l’Est pour la moitié) et 1% d’ailleurs.
P. falciparum a été isolé dans 93,4% des cas sur la période d’étude, P. malariae dans 4,1% des cas, P. vivax dans 2,0% des cas et P. ovale dans 0,4% des cas. P. falciparum était retrouvé chez 94,6% des cas importés et 92,9% des cas autochtones alors que P. malariae était isolé chez 3,0% des cas importés et 5,2% des cas autochtones. Les proportions étaient équivalentes pour les autres espèces.
Sur la période d’étude, la proportion d’hommes infectés a été de 62%, avec un minimum de 51% en 2013 et un maximum de 79% en 2016. La moyenne d’âge était de 23,8 ans, 24,3 ans chez les hommes et 23,2 ans chez les femmes, en constante augmentation jusqu’en 2015 pour les deux sexes (figure 4). Les moins de 15 ans représentaient 31% des cas (dont 42% âgés de moins de 5 ans) ; 23% des cas avaient entre 15 et 24 ans, 33% entre 25 et 44 ans et 12% plus de 45 ans. La proportion des cas la plus importante se situait dans la tranche des 15-24 ans pour les hommes (avec 28% des cas) et des 25-34 ans pour les femmes (avec 22% des cas). Au total, 40 femmes enceintes ont été infectées (dont 15 infections autochtones).
 Agrandir l'image
Agrandir l'imageEntre 2007 et 2016, on retrouve 11% de formes graves, dont 2 décès survenus parmi des cas importés, chez un enfant de 16 ans en 2007 et chez un enfant de 2 ans en 2011. Parmi les cas, 19% ont été hospitalisés (3% en réanimation). Le taux d’hospitalisation a augmenté depuis 2010, atteignant 54% en 2016. Depuis la mise en place de l’association artéméther-luméfantrine dans le traitement du paludisme non compliqué à P. falciparum sur l’île en mai 2007, 89% des cas ont reçu ce médicament et 10% ont reçu de la quinine (8% par voie intraveineuse).
La distribution mensuelle des cas confirme la transmission continue avec une répartition similaire chaque année sur la période, avec deux pics : en décembre-janvier, au milieu de la saison des pluies, et en juillet-août, au milieu de la saison sèche, pour les cas autochtones comme pour les cas importés. L’intensité de la transmission varie selon les années, sans lien direct avec les variations climatiques (figure 5).
 Agrandir l'image
Agrandir l'imageDiscussion – Conclusion
On observe une diminution majeure de l’incidence du paludisme à Mayotte au cours des 10 dernières années, associée à une diminution globale de la transmission. En 2011, l’île est entrée en phase d’élimination du paludisme quand, selon la définition de l’OMS, l’incidence annuelle du parasite P. falciparum est passée en dessous d’1 cas pour 1 000 personnes à risque, ce qui a été confirmé les années suivantes 14,15. L’objectif d’élimination semble proche, toutefois l’année 2016 a été marquée par une réémergence de cas autochtones dans le foyer historique de Bandraboua. Or, ce foyer compte pour la moitié des cas autochtones de l’île sur les 10 dernières années de surveillance alors qu’il ne représente que 5% de la population de Mayotte. En 2004, l’incidence annuelle du paludisme à Bandraboua était de 58,1 pour 1 000 habitants alors que l’incidence globale annuelle sur l’île était de 4,6/1 000 16.
La diminution de la transmission autochtone du paludisme à Mayotte est le résultat d’une combinaison de mesures comme la surveillance passive intégrée et la recherche active autour des cas avec l’utilisation des TDR depuis 2001, la prise en charge thérapeutique par ACT depuis 2007 et bien sûr l’amélioration des mesures de LAV depuis 2002. En effet, l’aspersion intradomiciliaire régulière, l’identification et le traitement des gîtes larvaires ainsi que la distribution généralisée de MIILD sont recommandés pour leur efficacité prouvée dans la lutte contre le paludisme 15.
En parallèle, les politiques de lutte contre le paludisme mises en place dans les pays voisins ont entraîné une baisse globale de la transmission dans la zone. Ainsi les Comores, qui représentent 92% des cas importés à Mayotte ces 10 dernières années, ont vu leur incidence globale annuelle chuter de 109 cas de paludisme pour 1 000 habitants en 2011 à 2,8/1 000 en 2014. Cette baisse est notamment liée aux actions de lutte entreprises à Anjouan et en Grande Comore depuis 2010 17. Étant donné que ces deux îles comptent pour 97% des cas importés des Comores à Mayotte, on observe une chute du nombre des cas importés à Mayotte de 160 en 2010 à 42 en 2011.
En 2016, la réémergence de cas autochtones dans le foyer historique de Bandraboua, alors que le nombre de cas importés sur l’île était aussi faible qu’en 2015 avec 10 cas seulement, semble davantage en faveur d’un phénomène local. Les cas, 8 autochtones et 2 importés des Comores, sont de jeunes hommes qui ont tous une activité agricole et ont séjourné ou vivent dans un village de gratte ou « tobé » de Bouyouni (commune de Bandraboua). Un village de gratte est un village situé à l’écart des zones urbaines, le plus souvent en forêt, avec un accès par une piste et composé de quelques maisons construites en végétaux et/ou en tôle, essentiellement occupées par des cultivateurs en saisons des pluies. Ce sont principalement de jeunes hommes originaires des Comores vivant clandestinement sur l’île. Cette situation avait déjà été décrite à Bouyouni, qui constituait un des regroupements de cas autochtones du foyer historique de Bandraboua 18. Ces « tobé » ont pu aussi servir de refuge à ces populations suite aux tensions sociales récentes entre communautés sur l’île. L’action de la LAV a consisté à rechercher des cas secondaires dans l’environnement des cas, l’aspersion intradomiciliaire à base de deltaméthrine et la distribution gratuite de MIILD. Les captures de moustiques adultes réalisées à proximité retrouvent la présence d’An. funestus ainsi que des larves d’An. gambiae dans un point de décharge d’ordures. En 2010, 91% des Anopheles femelles capturées à Bouyouni étaient des An. funestus alors que cette espèce était considérée comme disparue de l’île depuis les années 1980 4,18.
Les connaissances sur ce vecteur à Mayotte sont limitées. L’espèce est décrite comme rare, localisée à certains secteurs marécageux, plus abondante en saison sèche. Les gîtes larvaires d’An. funestus sont souvent encombrés d’une végétation abondante les rendant peu accessibles à la lutte larvaire 9. En outre, les difficultés d’accès de la LAV pour l’aspersion intradomiciliaire et pour la distribution de MIILD, ainsi que la faible rémanence aux insecticides des logements précaires de ces villages ont pu favoriser la transmission entre les cas. En Afrique, An. funestus est décrite comme endophile et anthropophile, en réémergence dans plusieurs pays, où elle serait associée à la persistance de foyers de transmission du paludisme 19. Par ailleurs, une récente revue de la littérature rapporte des résistances fréquentes aux insecticides en Afrique dans les suites du Programme d’éradication globale du paludisme 20, résistances à l’origine de la réémergence d’An. funestus 21. Même si les données sur la résistance d’An. gambiae aux insecticides à Mayotte sont rassurantes 5, des travaux similaires restent à réaliser chez An. funestus.
Le risque de réémergence du paludisme est un phénomène à considérer, même sur une île, d’autant plus que la densité de population ne cesse de croître à Mayotte, dans un contexte social délétère, et que la persistance d’An. funestus pendant la saison sèche comme vecteur du paludisme est un facteur important de la transmission péri-annuelle du paludisme sur l’île 4. En parallèle les médecins, dont le renouvellement est important et régulier, sont moins habitués à suspecter un cas de paludisme et le taux d’hospitalisation a augmenté de façon paradoxale, non pas en raison de la gravité des cas mais en lien avec une prise en charge hospitalière des formes non compliquées.
Le maintien des politiques de lutte contre le paludisme est essentiel, aussi bien au niveau régional qu’au niveau local, afin de conserver ce bas niveau de transmission dans l’archipel. Des stratégies développées au niveau mondial ont largement suggéré l’efficacité d’actions combinées, associant la LAV comme l’aspersion intradomiciliaire, la mise en place de MIILD, la surveillance active et la prise en charge des cas, incluant le diagnostic et le traitement par ACT 15. Un cas autochtone de paludisme à P. falciparum résistant à l’artémisinine vient cependant d’être rapporté en Afrique de l’Ouest 22. Des études sur la résistance aux dérivés de l’artémisinine restent à réaliser à Mayotte et plus largement dans l’archipel 23,24. Enfin, les freins au recours au soin des clandestins ont pu laisser échapper un certain nombre de cas du système de surveillance passif ou retarder leur découverte. La mobilisation vers une surveillance active recommandée par l’OMS en phase d’élimination serait davantage à même de détecter ces cas et de casser la chaîne de transmission à l’origine de réémergences et de foyers. Des approches communautaires de sensibilisation, de surveillance active, de LAV et de prévention en général, avec l’implication de travailleurs sociaux intégrés, seraient des pistes d’amélioration pour atteindre ces populations en parallèle des opérations de la LAV sur l’île 25,26. Des actions de dépistage ciblé sur des populations migrantes à risque permettraient aussi de retrouver des porteurs asymptomatiques, en cause dans la transmission à bas bruit 27.
Remerciements
Les auteurs remercient les professionnels de santé du Centre hospitalier de Mayotte et les équipes du Service de lutte antivectorielle et de la Cellule de veille, d’alerte et de gestion sanitaires de la délégation de l’Agence de santé à Mayotte.