Évaluation du dépistage prénatal de la trisomie 21 en France, 2009-2012
// Assessment of antenatal trisomy 21 screening in the French population, 2009-2012
Résumé
Contexte –
Les tests de dépistage prénatal de la trisomie 21 combinant une mesure de la clarté nucale au 1er trimestre de la grossesse et le dosage de marqueurs sériques ont été introduits en France en 2009, à la suite de la publication des recommandations de la Haute Autorité de santé (HAS) en 2007. L’objectif de cette étude est d’évaluer l’impact de l’utilisation de ces tests de dépistage prénatal sur l’évolution du nombre de prélèvements invasifs (amniocentèse et prélèvement de villosités choriales) et de diagnostics prénatals d’anomalies chromosomiques.
Méthode –
Les bilans annuels de tous les laboratoires de cytogénétique et de biochimie prénatales en France, de 2009 à 2012, ont été analysés. La fréquence des tests positifs, des prélèvements invasifs et la valeur prédictive des tests de dépistage ainsi que le nombre de diagnostics prénatals de cas de trisomie 21 ont été comparés dans le temps et en fonction des types de tests de dépistage.
Résultats –
Le nombre de femmes ayant réalisé un test de dépistage avec marqueurs sériques maternels a augmenté de 673 444 à 684 745 sur la période étudiée, soit environ 85% des accouchements. La montée en charge du test combiné du 1er trimestre a été très importante puisqu’en 2012, il représentait 70% de tous les tests utilisés. La fréquence des tests positifs est passée de 8,8% à 4,1% (p<0,001), s’accompagnant d’une diminution de 47% des prélèvements invasifs soit 37 478 en moins. La valeur prédictive positive (VPP) des tests est passée de 1,3% à 4% (p<0,001), du fait de la VPP élevée des tests combinés du 1er trimestre par rapport à celle des tests du 2e trimestre (5,6% contre 1,9% en 2012, p<0,001). Le nombre de cas de trisomie 21 diagnostiqués en prénatal n’a pas diminué : il est passé de 1 918 en 2009 à 1 971 en 2012.
Conclusion –
La mise en place des tests combinés de dépistage prénatal de la trisomie 21 a permis de diminuer de façon très importante le nombre de prélèvements invasifs en France, permettant d’éviter environ 200 fausses couches sans diminution du nombre de diagnostics prénatals de cas de trisomie 21. L’évaluation du dépistage de la trisomie 21 en population générale se poursuit à l’Agence de la biomédecine.
Abstract
Context –
Trisomy 21 prenatal screening for all pregnant women using maternal age, week 11-14 nuchal translucency and maternal serum markers during the second semester were introduced in France in 2009 following the publication of the 2007 national guidelines by the French National Authority for Health (HAS), French national health insurance funded. The objective of this study is to evaluate the impact of the introduction of the national policy of prenatal trisomy 21 first-trimester screening on the number of invasive prenatal diagnostic procedures (amniocentesis and chorionic villus sampling), and the unbalanced chromosomal anomalies diagnosed prenatally.
Methods –
The results of all routine prenatal trisomy 21 screening and invasive diagnostic procedures were collected for the whole country over the period 2009-2012. The number of invasive prenatal diagnostic procedures, trisomy 21 diagnosed prenatally, screen-positive rates (risk cut-off 1:250) and positive predictive values were estimated over the period and according to the type of screening tests.
Results –
Over the study period, the number of women undergoing serum screening (including 1st and 2nd trimester screening tests) increased from 673,444 to 684,745, representing 85% of all deliveries in France. By 2012, first-trimester combined screening accounted for 70% of all screening. The screen-positive rate decreased from 8.8% to 4.1% (p<0.001) resulting in a 37,478 (47%; p<0.001) drop in the number of invasive diagnostic procedures. The positive predictive value of screening increased from 1.3% to 4% from 2009 to 2012 (p<0.001), due to the higher positive predictive value of 1st trimester over 2nd trimester screening (5.6% vs. 1.9% over the period 2010-2012, p<0.001). The number of trisomy 21 diagnosed prenatally did not decrease: 1,918 in 2009 vs. 1,971 in 2012.
Conclusions –
The implementation of combined antenatal trisomy 21 screening significantly reduced the number of invasive tests in France, contributing to avoid around 200 foetal losses each year with no reduction of the number of antenatal trisomy 21 diagnoses. The assessment of trisomy 21 screening in the general population continues at the French Agency of Biomedicine.
Introduction
L’Agence de la biomédecine a pour mission de promouvoir, de réguler et d’évaluer les activités de quatre domaines spécifiques de la santé : le prélèvement et la greffe d’organes, de tissus et de cellules, l’assistance médicale à la procréation, la génétique et l’embryologie humaine. Dans le cadre de ses missions, elle suit en particulier l’activité de dépistage de la trisomie 21 qui a beaucoup évolué au cours de ces dernières années. Dès les années 1970, avec les possibilités de prélèvements fœtaux invasifs (amniocentèse, biopsie de villosités choriales ou, plus rarement, ponction de sang fœtal) et de réalisation d’un caryotype, les femmes enceintes ont souhaité bénéficier d’un diagnostic in utero de la trisomie 21, afin de faire éventuellement le choix d’une interruption médicale de leur grossesse. En raison du risque de perte fœtale inhérent aux prélèvements fœtaux, il a toujours paru justifié de réserver ces prélèvements aux femmes à risque élevé, d’abord en raison de leur âge (le seuil en France était de 38 ans), puis progressivement en fonction des signes d’appel échographiques (SAE) et des dosages biochimiques de marqueurs sériques maternels (MSM), d’abord au 2e trimestre puis au 1er trimestre de la grossesse et, enfin, en fonction de la combinaison de tous ces facteurs de risque.
Parmi les SAE, l’augmentation de l’épaisseur de la nuque du fœtus entre 11 et 14 semaines d’aménorrhée (SA) est très corrélée au risque de trisomie 21, ce qui en a fait un critère majeur de dépistage. L’arrêté du 23 juin 2009 « fixant les règles de bonnes pratiques en matière de dépistage et de diagnostic prénatals avec utilisation des marqueurs sériques maternels de la trisomie 21 » a été publié après une évaluation par la Haute Autorité de santé (HAS) 1. Cet arrêté préconise que le test combinant une mesure échographique de la clarté nucale au 1er trimestre de la grossesse avec des MSM prélevés aussi au 1er trimestre (test combiné du 1er trimestre) soit proposé à toutes les femmes enceintes ; à défaut, si la prise de sang pour MSM est faite trop tard, les femmes peuvent bénéficier du test séquentiel au 2e trimestre (prenant en compte la mesure de la clarté nucale et les MSM du 2e trimestre). L’intérêt de ces tests combinés est d’améliorer la valeur prédictive positive (VPP) de ce dépistage de la trisomie 21 et ainsi de diminuer la fréquence des prélèvements invasifs (amniocentèse ou villosités choriales) qui comportent un risque de fausse couche non négligeable, de 0,5% à 1% selon les études 2. Les femmes n’ayant pas eu de mesure de la clarté nucale au 1er trimestre de la grossesse conservent la possibilité de faire un dépistage par les seuls MSM au 2e trimestre de grossesse. Trois types de dépistages sont donc disponibles pour que toutes les femmes enceintes puissent en bénéficier, même en cas de découverte tardive de la grossesse. Néanmoins, le dépistage de la trisomie 21 au cours de la grossesse reste toujours un choix libre pour chaque femme enceinte (chaque couple), qui doit avoir reçu une information claire, précise et loyale en fonction des différents paramètres concernant sa grossesse. La combinaison entre mesures échographiques et mesures biochimiques a nécessité une organisation des professionnels : les échographistes ont eu à mettre en place un contrôle qualité portant sur les mesures de la clarté nucale et les biochimistes ont dû intégrer les mesures échographiques pour faire le calcul combiné du risque.
Afin d’étudier l’impact de la mise en place au niveau national, en 2010, des tests de dépistage combinés de la trisomie 21 incluant la mesure de la clarté nucale fœtale, sont présentées dans cette étude les évolutions du nombre de prélèvements invasifs pendant la grossesse et du nombre de diagnostics prénatals de trisomies 21 et des autres anomalies chromosomiques déséquilibrées.
Population et méthodes
Population
Tous les laboratoires de cytogénétique prénatale et postnatale et les laboratoires de biochimie autorisés pour le dépistage prénatal adressent à l’Agence de la biomédecine un rapport annuel d’activité, dans lequel sont renseignés l’ensemble des activités de dépistage et de diagnostic ainsi que les indications des prescriptions et les résultats des examens. L’analyse de ces bilans d’activité est présentée dans le rapport annuel médical et scientifique de l’Agence de la biomédecine 3. Ainsi, toutes les femmes ayant réalisé un test de dépistage de la trisomie 21 avec MSM et toutes celles ayant réalisé un prélèvement invasif prénatal à visée de diagnostic cytogénétique sont incluses dans ce bilan. Cette étude permet de présenter l’activité nationale exhaustive de 2009 à 2012.
Méthode
Les trois types de tests avec MSM disponibles en France (tests combinés du 1er trimestre, tests combinés séquentiels et tests du 2e trimestre sans mesure de la clarté nucale) sont considérés comme positifs lorsque que le risque calculé de trisomie 21 est supérieur au seuil de 1/250 4. Une mesure de la clarté nucale supérieure à 3,5 mm au 1er trimestre de la grossesse est considérée comme une anomalie échographique et peut conduire à la réalisation d’un caryotype sans être associée à un dépistage par MSM. Les laboratoires de biochimie ont exclu de leurs statistiques tous les cas de dépistage par marqueurs sériques avec clarté nucale supérieure à 3,5 mm.
Analyse statistique
Pour des raisons de logique chronologique, l’analyse présente en premier lieu la population d’étude, c’est-à-dire le nombre et la fréquence des femmes ayant réalisé un dépistage et des femmes avec un test de dépistage positif, puis l’évolution du nombre de femmes ayant réalisé un prélèvement invasif à visée de diagnostic cytogénétique et la fréquence des diagnostics de trisomie 21. Les deux indicateurs d’efficacité disponibles sont la fréquence des tests positifs et la VPP (fréquence des diagnostics de trisomie 21 parmi les tests de dépistage positifs). Dans le cas du dépistage de la trisomie 21, la fréquence des tests positifs est une très bonne approximation de la fréquence des faux positifs (fréquence des tests positifs parmi les cas indemnes) du fait du nombre très faible des cas atteints dans l’ensemble de la population ainsi que de la spécificité (fréquence des tests négatifs parmi les cas indemnes) qui est le complémentaire du précédent.
Les fréquences sont présentées avec un intervalle de confiance à 95% (IC95%) et les comparaisons statistiques de fréquences sont réalisées avec un test du Chi2 au seuil de 5% de significativité.
Résultats
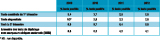
Le nombre de femmes dépistées par des marqueurs sériques maternels, quel que soit le type de tests utilisés, est très élevé en France puisque près de 85% des femmes sont concernées. En 2009, 98% des tests de dépistage étaient des tests du 2e trimestre de la grossesse sans mesure de la clarté nucale. La part des tests combinés incluant la mesure de la clarté nucale au 1er trimestre a rapidement augmenté, passant de 40% à 70% entre 2010 et 2012. Les marqueurs sériques du 2e trimestre ne représentaient plus que 18% des tests de dépistage en 2012 (tableau 1).
 Agrandir l’image
Agrandir l’image
Dans le même temps, la fréquence des tests de dépistage positifs au niveau national a été divisée par 2, passant de 8,8% à 4,1% (p<0,001). La fréquence des tests positifs était beaucoup plus faible avec les tests combinés à la mesure de la clarté nucale : 2,8% (IC95%:[2,7-2,8]), 2.8% (IC95%:[2,7-2,9]) et 9,8% (IC95%:[9,6-9,9]) respectivement pour les tests combinés du 1er trimestre, les tests séquentiels et les tests du 2e trimestre sans mesure de la clarté nucale en 2012. À noter qu’en 2009, les tests combinés du 1er trimestre étaient déjà utilisés pour des femmes à risque élevé, ce qui explique que la fréquence des tests positifs était plus élevée en 2009 que les années suivantes. (tableau 2).
 Agrandir l’image
Agrandir l’image
Cette évolution s’est accompagnée d’une diminution de 47% du nombre de prélèvements invasifs à visée diagnostique (amniocentèses ou biopsie de villosités choriales) pendant la période étudiée, passant de 79 105 en 2009 (10% de l’ensemble des accouchements en France) à 41 627 (5% des accouchements) en 2012 (tableau 3). Cette diminution des actes invasifs pendant la grossesse aurait permis d’éviter de 187 à 375 fausses couches.
 Agrandir l’image
Agrandir l’image
La fréquence des diagnostics prénatals de trisomie 21 réalisés à la suite d’un test de dépistage positif (VPP) est passée de 1,3% (IC95%:[1,2-1,4]) à 4% (IC95%:[3,7-4,3] ; p<0,001) en France pour l’ensemble des types de tests (tableau 4). La VPP est plus élevée pour les tests associés à la mesure de la clarté nucale : 5,6%, 4% et 1,9% respectivement pour les tests combinés du 1er trimestre, séquentiels et du 2e trimestre, en 2012 (p<0,0001). Le nombre de cas de trisomie 21 diagnostiqués à la suite d’un test de dépistage positif est passé de 423 en 2009 à 802 en 2012, soit respectivement 22% et 41% de tous les cas diagnostiqués en prénatal (tableau 4 et tableau 5). Les autres cas de trisomie 21 sont diagnostiqués essentiellement à la suite d’une anomalie morphologique détectée au cours d’un examen échographique du fœtus.
 Agrandir l’image
Agrandir l’image
 Agrandir l’image
Agrandir l’image
Le nombre d’anomalies chromosomiques déséquilibrées diagnostiquées en période prénatale est d’environ 4 000 par an, soit 0,48% des naissances en France, et reste relativement stable sur l’ensemble de la période étudiée. Le diagnostic des trisomies 21, 13 et 18 représente près de 70% de ces anomalies. Le nombre de diagnostics prénatals de trisomie 21 a augmenté de 53 cas (+2,8%) entre 2009 et 2012 (tableau 5). La diminution du nombre de prélèvements invasifs pendant la grossesse n’a pas eu d’impact sur le nombre de diagnostics prénatals des autres anomalies chromosomiques déséquilibrées, qui est resté relativement stable durant cette période. On n’observe pas en particulier de diminution des diagnostics prénatals de trisomie 18 et 13 (tableau 5).
Discussion
Les éléments qui avaient motivé la mise en place du dépistage combiné du 1er trimestre et la publication de l’arrêté de 2009 étaient, d’une part, l’observation d’un nombre trop élevé de prélèvements invasifs (presque 10% des grossesses) responsables d’un certain nombre de fausses couches et, d’autre part, le souhait des femmes enceintes de sortir du caractère séquentiel du dépistage dont elles se plaignaient : elles se trouvaient rassurées par une échographie du 1er trimestre puis étaient néanmoins parfois dans la zone à risque supérieur à 1/250 après le dosage des marqueurs sériques au 2e trimestre. Le dépistage au 1er trimestre est préféré par les femmes enceintes puisqu’un grand nombre d’entre elles choisiront d’interrompre la grossesse lorsqu’une anomalie chromosomique est diagnostiquée. Or, il est moins difficile d’interrompre une grossesse au 1er trimestre. La montée en charge rapide du dépistage combiné au 1er trimestre entre 2010 et 2012 témoigne d’une adhésion massive des femmes enceintes et de leurs médecins à ce dépistage, malgré les difficultés pour certaines régions de disposer d’un nombre suffisant d’échographistes, et l’absence de moyens financiers spécifiques alloués aux réseaux de santé périnatale. Ce choix s’est fait aux dépens des MSM du 2e trimestre et du prélèvement invasif d’emblée pour âge supérieur à 38 ans. La comparaison des trois tests de dépistage met en évidence que la fréquence des tests positifs est plus faible avec les tests qui incluent la mesure de la clarté nucale (de 2,8% à 3,8%) qu’avec les MSM du 2e trimestre seuls (8,7% à 9,8%). La VPP du dépistage combiné est plus élevée que celle du dépistage par les MSM seuls (5,6% contre 1,9% en 2012). Ces chiffres mettent en évidence l’impact important de la mesure de la clarté nucale sur le calcul du risque. Le nombre de prélèvements invasifs a diminué de moitié entre 2009 et 2012. Cette diminution est liée au fait que les femmes de 38 ans et plus ont été orientées vers le dépistage combiné et n’ont donc pas eu d’emblée un prélèvement invasif, mais aussi à la montée en charge importante du dépistage combiné dans lequel beaucoup moins de femmes sont à risque.
Malgré cette diminution importante du nombre de prélèvements invasifs, le nombre de diagnostics prénatals de trisomies 21 a augmenté régulièrement, passant de 1 918 en 2009 à 1 970 en 2012. Le diagnostic prénatal des trisomies 13 et 18, qui repose essentiellement sur des SAE en raison des malformations associées, est resté parfaitement stable entre 2009 et 2012, malgré la diminution du nombre des prélèvements invasifs. Ces résultats, qui ont le mérite d’être le fruit d’un travail national réalisé en population générale 5, sont tout à fait comparables aux évaluations réalisées également en population générale dans d’autres pays européens 6,7,8. L’évaluation des indicateurs mesurant l’efficacité des différents tests de dépistage, et en particulier la sensibilité, nécessite de connaître l’issue de grossesse de toutes les femmes dépistées afin d’identifier les cas de trisomie 21 non dépistés (faux négatifs). Pour réaliser cette étude, il faudrait suivre et connaître l’issue de grossesse d’environ 700 000 femmes chaque année pour identifier moins de 200 cas ; or, il n’existe pas actuellement de suivi national exhaustif de toutes les grossesses en France, ni de registre national des naissances avec malformations congénitales. Pour compléter cette évaluation, une enquête a été réalisée, en collaboration avec l’Association des cytogénéticiens de langue française (ACLF), auprès des laboratoires de cytogénétique postnatale afin d’étudier l’évolution du nombre de cas d’enfants atteints de trisomie 21 de 2010 à 2012. Ce travail est en cours d’analyse et devrait permettre d’avoir une estimation de la sensibilité des tests de dépistage.
En conclusion, les objectifs de la mise en place du dépistage combiné de la trisomie 21 ont été atteints, puisque la montée en charge a été importante, le nombre de prélèvements invasifs a diminué de moitié et le niveau du dépistage est resté stable. Ce dépistage pourrait néanmoins connaître des évolutions importantes avec les méthodes d’analyse de l’ADN fœtal libre dans le sang maternel. Il semble que la sensibilité et la spécificité de ces méthodes soient élevées, mais il reste pour l’instant à définir leur stratégie d’utilisation à l’échelon national.
Remerciements
Les auteurs remercient tous les participants du groupe de travail sur l’évaluation du dépistage de la trisomie 21 à l’Agence de la biomédecine, et tous les laboratoires de cytogénétique et de biochimie prénatals en France qui réalisent un bilan annuel de leur activité et participent ainsi à la constitution d’une base de données nationale. Un article a été soumis à une revue internationale 5.




