Hypothyroïdie congénitale en France : analyse des données recueillies lors du dépistage néonatal de 2002 à 2012
// Congenital hypothyroidism in France: analysis of data collected during neonatal screening from 2002 to 2012
Résumé
Le dépistage de l’hypothyroïdie congénitale (HC) à la naissance est réalisé en France depuis 1978, sous l’égide de l’Association française pour le dépistage et la prévention des handicaps de l’enfant (AFDPHE). Une étude préliminaire des données de ce dépistage avait montré une augmentation des taux d’incidence annuels de l’HC avec glande en place (GEP) entre 1984 et 2010. Une étude des données complémentaires disponibles depuis 2002 a été réalisée afin d’analyser les caractéristiques des enfants avec une HC dépistée à la naissance, d’étudier si elles contribuaient à l’augmentation des taux d’incidence entre 2002 et 2012 et de décrire les disparités régionales des taux d’incidence.
Un total de 2 722 cas d’HC a été diagnostiqué entre 2002 et 2012. Parmi eux, 1 021 (37,5%) avaient une HC avec GEP, 1 701 (62,5%) étaient porteurs de dysgénésies (athyréose, ectopie thyroïdienne). Les nouveau-nés porteurs d’une HC avec dysgénésie étaient majoritairement de sexe féminin (71%), nés avec un terme et un poids de naissance (PN) similaires à ceux de la population générale des nouveau-nés, alors que les nouveau-nés avec une HC avec GEP avaient un sex-ratio équilibré et avaient plus fréquemment un petit poids de naissance (14,1% avec PN<2 500 g ou 5,5% avec PN<-2 déviations standard (DS)) et une naissance prématurée (14,2%) que la population générale des nouveau-nés des Enquêtes nationales périnatales. Les taux d’incidence étaient de 33,0 cas/100 000 d’HC globale ; de 11,8 cas/100 000 d’HC avec GEP et de 19,7 cas/100 000 d’HC avec dysgénésies. De 2002 à 2012, une augmentation annuelle moyenne d’incidence de 7,7% (p<0,0001) a été observée chez les HC avec GEP, alors que les taux chez les HC avec dysgénésies étaient stables (p=0,4). Des disparités régionales d’incidence d’HC avec GEP ont été observées, avec des taux plus élevés en Picardie et Franche-Comté.
Les facteurs explicatifs des disparités régionales et de l’augmentation de l’incidence des HC avec GEP en France durant la période 2002-2012 mériteraient d’être explorés par des études complémentaires.
Abstract
In France, the nationwide neonatal screening program of congenital hypothyroidism (CH) has been implemented since 1978 and is performed by the French Association for Screening and Prevention of Infant Handicaps (AFDPHE). A preliminary study performed by the French Institute for Public Health Surveillance (InVS) and AFDPHE showed an increase incidence of congenital hypothyroidism with normal-size gland in situ between 1984 and 2010. A study of additional data available since 2002 was conducted to describe birth parameters among children with congenital hypothyroidism. We also aimed to study whether those characteristics contributed to the increase of incidence rates between 2002 and 2012, and analyze regional differences in incidence rates.
A total of 2,722 cases of CH were identified between 2002 and 2012. Of these, 1,021 (37.5%) had normal-size gland in situ, 1,701 (62.5%) had thyroid dysgenesis (athyreosis, ectopic thyroid). In cases with thyroid dysgenesis we observed a female predominance (71%), they were born with a term and birth weight similar to the general population of newborns, while cases with normal-size gland in situ, had a balanced sex ratio, were more frequently born with low birth weight (14.1% with a birth weight <2,500 g or 5.5% with BW <-2SDS) and preterm (14.2%; gestational age <37 week gestation) than the general population of newborns of Perinatal National Surveys. The overall incidence rate per 100,000 cases was 33.0 for CH; 11.8 for normal-size gland in situ, and 19.7 for thyroid dysgenesis. From 2002 to 2012, an average annual increase incidence of 7.7% (p<0.0001) was observed in the CH with normal-size gland in situ while rates among CH with dysgenesis remained stable (p=0.4). Regional disparities of incidence were observed in CH with normal-size gland in situ with higher rates in Picardie and Franche-Comté.
Further studies are required to explore the regional disparities and the increase incidence of CH with normal-size gland in situ during the period 2002-2012 in France.
Introduction
L’hypothyroïdie congénitale (HC), avec une incidence d’environ 1 cas sur 3 500 naissances 1, est caractérisée par un défaut de fonctionnement de la glande thyroïde, avec une production insuffisante d’hormones thyroïdiennes qui conduit, en l’absence de traitement, à de graves séquelles neuro-développementales. Dans la plupart des cas, il s’agit d’une anomalie du développement de la glande thyroïde appelée dysgénésie thyroïdienne, liée à une anomalie de la migration thyroïdienne (ectopie) ou à une agénésie de la glande (athyréose). Les autres cas d’HC concernent des glandes situées en position normale mais ne produisant pas suffisamment d’hormones (glande en place). Le dépistage néonatal est utile pour mettre en œuvre un traitement substitutif dès la période néonatale afin d’améliorer le pronostic statural et surtout mental des patients. En France, il existe un programme de dépistage néonatal national depuis 1978, coordonné par l’Association française pour le dépistage et la prévention des handicaps de l’enfant (AFDPHE).
L’AFDPHE a mis en place une base nationale des cas d’HC dépistés avec quelques informations sur le nouveau-né (date de naissance, terme de naissance, sexe, région de naissance, étiologie de l’HC) et les tests réalisés. Les résultats préliminaires d’une étude menée à l’Institut de veille sanitaire (InVS) en collaboration avec l’AFDPHE ont montré une augmentation des taux d’incidence annuels de l’HC avec glande en place (GEP) entre 1984 et 2010 en France métropolitaine, et une stabilité de l’incidence des autres formes d’HC 2. Depuis 2002, le fichier a été enrichi de quelques autres variables (poids de naissance, terme de la grossesse, pathologie familiale, malformations associées). L’objectif de la présente étude était d’analyser ces variables selon la forme de l’HC et de voir si elles contribuaient à expliquer l’augmentation des taux d’incidence entre 2002 et 2012.
Matériels et méthodes
Système de dépistage néonatal de l’HC en France
Le programme de dépistage néonatal de l’hypothyroïdie congénitale a été mis en place en France en 1978 et progressivement généralisé à l’ensemble du territoire. Il couvre tous les nouveau-nés depuis 1980. Coordonné par l’AFDPHE, sous la tutelle du ministère de la Santé, ce programme est financé par la Caisse nationale d’assurance maladie des travailleurs salariés (CnamTS).
Le système de dépistage de l’HC est multicentrique. Il est géré par des associations régionales, en relation avec des laboratoires de biologie médicale régionaux. Composée d’un réseau de professionnels, chaque association régionale assure l’organisation et le suivi du programme au niveau de son territoire géographique, depuis le prélèvement sanguin jusqu’à la prise en charge des enfants dépistés positifs. Le dépistage repose sur le dosage de la thyroïd stimulating hormone (TSH) sur un papier buvard sur lequel sont déposées des gouttes de sang prélevées chez tous les nouveau-nés à 72 heures de vie. Les HC centrales (très rares), causées par une anomalie de la glande hypophyse, ne sont pas dépistées dans ce programme. Lorsque l’élévation de la concentration de la TSH (TSH supérieure au seuil en vigueur) est confirmée, une convocation est adressée aux parents et l’enfant est vu par un pédiatre endocrinologue. Des examens complémentaires biologiques et morphologiques sont alors réalisés pour confirmer le diagnostic. Afin de préciser l’étiologie de l’hypothyroïdie, une scintigraphie et une échographie de la thyroïde sont pratiquées pour déterminer la présence, la localisation et la taille du tissu thyroïdien. Selon les laboratoires, la mesure de la TSH sur le papier buvard de dépistage est réalisée soit par un dosage immunofluorimétrique (DELFIA® – Perkin Elmer, Turku, Finlande) soit par un dosage radioimmunologique (RIA®-Iba-CisBio, Gif-sur-Yvette, France). Jusqu’en 2002, les seuils de dépistage variaient entre 20 mU/L et 30 mU/L selon le laboratoire et la méthode de dosage. Depuis 2002, avec l’avènement d’une standardisation internationale, la commission technique de l’AFDPHE a recommandé des seuils de dépistage à l’échelle nationale correspondant à 20 mU/L pour DELFIA® et 25 mU/L pour la méthode RIA.
Les critères d’inclusion dans cette étude étaient les mêmes que les seuils recommandés par la commission technique, couplés à une confirmation de diagnostic d’une HC par le pédiatre.
Il s’agit d’une étude observationnelle multicentrique à partir des données collectées prospectivement par l’AFDPHE sur tous les enfants porteurs d’une HC en France métropolitaine de 2002 à 2012. Une description des caractéristiques des enfants a été réalisée en fonction de l’étiologie et des variables suivantes : sexe, prématurité, poids de naissance, antécédents familiaux, malformations congénitales et taux de TSH.
Analyses statistiques
Les résultats ont été exprimés en pourcentage pour les variables qualitatives et en moyenne pour les variables quantitatives.
Les risques relatifs de prématurité et de petit poids de naissance chez les nouveau-nés atteints d’HC ont été calculés en prenant comme référence les taux de prématurité et de petit poids de naissance observés en population générale dans les Enquêtes nationales périnatales (ENP) de 2003 et 2010. De même, le risque relatif de trisomie 21 a été calculé en prenant comme référence les taux de trisomie 21 chez les enfants nés vivants relevés dans les registres de malformations congénitales. Des Z scores du poids de naissance par rapport à l’âge gestationnel et au sexe ont été calculés à partir de la base de données Audipog (Association des utilisateurs de dossiers informatisés en pédiatrie, obstétrique et gynécologie : http://www.audipog.net).
Nous avons analysé les tendances temporelles, entre 2002 et 2012, des taux d’incidence annuels de nouveau-nés atteints d’HC. L’incidence a été exprimée en nombre de cas d’HC pour 100 000 naissances et a été calculée en utilisant le nombre de cas diagnostiqués divisé par le nombre de nouveau-nés dépistés. Des pourcentages de variation annuelle moyenne ont été estimés afin de quantifier les tendances des incidences d’HC au cours de la période 2002-2012. Des modèles de régression linéaire de Poisson ont été construits, incluant le logarithme du taux d’incidence annuel comme variable dépendante et l’année comme variable indépendante.
Les analyses statistiques ont été réalisées à l’aide du logiciel SAS® Entreprise guide, version 4.3. Le seuil de signification retenu était de 5%.
Résultats
Description
Effectifs
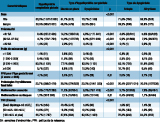
Entre 2002 et 2012, 8 623 973 nouveau-nés ont été testés et un total de 2 722 cas d’HC ont été diagnostiqués et inclus, après exclusion des enfants dont l’étiologie n’était pas connue (HC non typée ; n=124). Parmi ces enfants, 1 021 (37,5%) avaient une HC avec GEP et 1 701 (62,5%) étaient atteints de dysgénésies, dont 1 112 ectopies et 589 athyréoses. Parmi les HC avec GEP, sur 668 enfants pour lesquels la morphologie de la glande thyroïde était décrite, 152 (22,8%) avaient un goître, 69 (10,3%) avaient une hypoplasie et 447 (66,9%) avaient une glande thyroïde de morphologie normale.
Caractéristiques à la naissance : HC globale et par type d’hypothyroïdie (GEP et dysgénésies : ectopie ou athyréose)
Une description des caractéristiques des enfants à la naissance, globalement et en fonction de l’étiologie, a été effectuée (tableau 1). Dans cette étude, l’HC concernait plus fréquemment les filles (63,5%) que les garçons (36,5%), Cette prédominance des filles était retrouvée essentiellement chez les enfants atteints de dysgénésies (70,7%), le pourcentage de filles chez les enfants présentant une HC avec GEP étant de 51,7%. Le taux d’enfants prématurés (âge gestationnel <37 semaines d’aménorrhée, SA) était globalement de 8,4% pour l’ensemble des patients, mais différait selon l’étiologie avec 14,2% et 4,8%, respectivement, chez les HC avec GEP et dysgénésies (p<0,0001). Cet excès de taux de prématurité identifiés chez les HC avec GEP par rapport aux HC avec dysgénésie était retrouvé quel que soit le degré de prématurité : 14,8% d’HC avec GEP vs 6,3% d’HC avec dysgénésie (p<0,001) avec un âge gestationnel compris entre 32 SA et 37 SA, et 2,9% vs 0,4% (p<0,001) avec un âge gestationnel <32 SA. La proportion d’enfants de petit poids de naissance (poids de naissance inférieur à 2 500 grammes) était de 14,1% parmi ceux atteints d’HC avec GEP et de 7,1% parmi ceux atteints d’HC avec dysgénésie (p<0,0001). La proportion de petits poids de naissance par rapport à l’âge gestationnel (Z score <-2 DS) était plus élevée chez les patients avec GEP vs dysgénésie (5,5 vs 3,0% ; p=0,01).
 Agrandir l’image
Agrandir l’image
Des antécédents de pathologies thyroïdiennes familiales étaient présents chez 23,7% des patients sans distinction d’étiologie. Chez les patients avec GEP, près du tiers (29,5%) des enfants présentait des antécédents familiaux de pathologies thyroïdiennes, contre 20,3% chez les patients avec dysgénésie (p<0,0001). Une malformation était diagnostiquée chez 11,2% des nouveau-nés atteints d’une HC avec GEP, contre 5,3% chez ceux atteints d’HC avec dysgénésie (p<0,0001), avec une fréquence plus élevée chez les athyréoses (7,8 %) que chez les ectopies (3,7%) (p<0,0001). L’association avec une trisomie 21, relativement fréquente pour les nouveau-nés atteints d’une HC avec GEP (2,1%), n’a jamais été rapportée pour les autres formes d’HC. Une association avec une malformation cardiaque a été rapportée chez 30 patients (1,1%), dont 11 cas de communication interventriculaire (2 étaient associées à une trisomie 21). Parmi les patients atteints d’une HC avec GEP, 1,8% (n=18) présentaient une malformation cardiaque associée contre 0,7% (n=12) des patients avec HC avec dysgénésie (p=0,01). Chez les enfants atteints d’HC avec dysgénésie, la malformation cardiaque associée était significativement plus fréquente chez ceux avec athyréoses 1,7% (n=8) que chez ceux avec ectopies 0,4% (n=4) (p=0,03).
La proportion d’enfants avec un taux de TSH supérieur à 100 mU/L était nettement plus élevée chez les HC avec dysgénésie (82,5%) que chez les GEP (37,6%).
Évolution temporelle entre 2002 et 2012
Évolution des taux d’incidence de l'HC globale et selon le type d’étiologie
Durant la période 2002-2012, le taux d’incidence global d’HC était de 33,0 cas pour 100 000 (IC95%:[31,8-34,2]). Le taux d’incidence des HC avec GEP était de 11,8 cas pour 100 000 (IC95%:[11,1-12,6]) et celui des dysgénésies était de 19,7 cas pour 100 000 (IC95%:[18,8-20,7]) (tableau 2).
 Agrandir l’image
Agrandir l’image
La courbe d’évolution des taux montrait une tendance à l’augmentation de l’incidence des HC avec GEP, confirmée par les analyses qui indiquaient une forte augmentation des taux d’incidence entre 2002 et 2012, avec une augmentation annuelle moyenne de 7,7% (IC95%:[4,4%-11,0%] ; p<0,0001). En revanche, les taux d’incidence des dysgénésies étaient relativement stables sur la période (p=0,4) (figure 1).
 Agrandir l’image
Agrandir l’image
Évolution de la proportion de prématurés, de petit poids de naissance (PPN), de PPN par rapport à l’âge gestationnel et de pathologies familiales
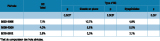
Pour étudier l’évolution de la prématurité chez les enfants atteints d’HC durant la période d’étude, les années ont été regroupées, en raison du faible effectif annuel, en trois périodes (deux de 4 ans et une de 3 ans). La proportion de prématurés était relativement stable sur les trois périodes, quel que soit le type d’HC (tableau 3). Toutefois, pour les HC avec GEP, les analyses ont montré une tendance à la baisse (p=0,01) de la proportion des grands prématurés (âge gestationnel <32 SA), de 5,8%, 2,5% et 1,6% sur les trois périodes respectivement. Cette tendance n’a pas été retrouvée chez les HC avec dysgénésies (p=0,2).
 Agrandir l’image
Agrandir l’image
Pour le poids de naissance, les données sont disponibles depuis 2003. Les années ont été regroupées en deux périodes de 3 ans et une de 2 ans (tableau 4). Aucune évolution significative de la proportion de PPN n’a été observée chez les enfants atteints d’HC avec GEP (p=0,6), ni chez ceux affectés d’une dysgénésie (p=0,4). En revanche, les analyses ont montré une tendance à la baisse de la proportion de PPN par rapport à l’âge gestationnel chez les HC avec GEP (p=0,003), mais cette proportion était stable chez HC avec dysgénésies (p=0,09) (tableau 5).
 Agrandir l’image
Agrandir l’image
 Agrandir l’image
Agrandir l’image
Les antécédents de pathologies thyroïdiennes familiales étaient stables sur les trois périodes et dans tous les groupes étiologiques (tableau 6).
 Agrandir l’image
Agrandir l’image
Répartition régionale des taux d’incidence
Durant la période 2002-2012, une disparité des taux a été observée selon les régions chez les HC avec GEP. Les régions Franche-Comté et Picardie présentaient les taux d’incidence d’HC avec GEP les plus élevés par rapport au taux national, leurs intervalles de confiance ne recouvrant pas l’intervalle de confiance national (figure 2). En revanche, la région Centre montrait un taux inférieur au taux national. Pour les HC avec dysgénésies, seule la région Normandie présentait un taux d’incidence significativement différent du taux national (figure 3).
 Agrandir l’image
Agrandir l’image
 Agrandir l’image
Agrandir l’image
Comparaison avec la population générale des naissances en France
Comparaison avec les données des ENP 2003 et 2010
Chez les enfants présentant une HC avec GEP, la proportion de prématurité (14,2%) était significativement plus élevée que celle observée dans la population cumulée des ENP 2003 et 2010 (7,3%), avec un risque de près du double de celui de la population générale (risque relatif, RR=1,9 [1,6-2,3] ; p<0,001). On observe le même excès de risque pour les grands prématurés (RR=2,0 [1,2-3,1] ; p<0,01). Chez les enfants atteints d’une HC de type dysgénésies, la proportion de prématurité (4,8%) était 2 fois plus faible que celle observée dans les ENP (RR=0,65 [0,50-0,82] ; p<0,001) (tableau 3). Le risque d’être grand prématuré est nettement plus faible que dans la population générale (RR=0,21 [0,06-0,59] ; p<0,001).
De même, durant la période, la proportion de PPN chez les HC avec GEP était de 14,1%, vs. 7,5% dans les ENP 2003 et 2010. Le risque de naître avec un PPN était doublé chez ces enfants (RR=1,9 [1,5-2,2] ; p<0,001) par rapport à la population générale. La proportion de PPN chez les HC avec dysgénésies (7,1%) était identique à celle de la population générale (7,5%) (tableau 4). La proportion d’enfants ayant un poids de naissance supérieur ou égal à 4 000 grammes était de 10,3% chez les HC avec dysgénésies contre 6,8% dans les ENP 2003 et 2010 (RR=1,6 [1,3-1,9] ; p<0,001). Cette proportion était de 8,8% chez les HC avec GEP et le risque de survenue n’était pas plus élevé qu’en population générale (RR=1,2 [0,9-1,5] ; p=0,05).
Comparaison avec les données des registres de malformations congénitales
Selon les registres de malformations congénitales, le taux de trisomie 21 parmi les naissances vivantes est de 0,067% 3. Chez les enfants avec une trisomie 21, le risque de naître avec une HC avec GEP est extrêmement élevé par rapport à la population générale des nouveau-nés vivants (RR=31,3 ; intervalle de confiance à 95%, IC95%:[24,6-40,6]).
De même, si l’on compare la proportion de nouveau-nés ayant une malformation cardiaque associée aux taux de malformations cardiaques congénitales des registres français chez les nouveau-nés vivants publié par Eurocat (0,72% sur la période 2006-2012) 4, on constate que, par rapport à la population générale des nouveau-nés vivants, le risque de naître avec une malformation cardiaque est plus élevé chez les HC avec GEP (2,1%) (RR=2,9 ; IC95%:[1,7-4,6] et chez les athyréoses (1,7%) (RR=2,3 ; IC95%:[1,0-4,6]) alors qu’il est identique chez les HC avec ectopies (0,4%) (RR=0,6 ; IC95%:[0,2-1,5]
Discussion
Entre 2002 et 2012, 2 722 HC ont été diagnostiquées dans la période néonatale en France métropolitaine, soit 1 cas sur 3 168 naissances. Les taux d’incidence étaient de 33,0 HC/100 000 naissances ; 11,8 HC avec GEP/100 000 naissances et 19,7 HC avec dysgénésie/100 000 naissances. Ces taux sont très proches des taux observés dans d’autres pays : par exemple en Nouvelle-Zélande, durant la période 2002-2010, 36,0 cas d’HC pour 100 000 nouveau-nés testés ; 11,1 HC avec GEP et 20,2 HC avec dysgénésie 5. Avec un seuil de dépistage inférieur à celui pratiqué en France (20 mU/L et 25 mU/L selon la technique de dépistage), des taux d’incidence du même ordre étaient également observés au Québec durant la période 2001-2009 (pour 100 000 enfants testés : 40,8 cas d’HC ; 10,2 HC avec GEP ; 22,2 HC avec dysgénésie) 6. L’hétérogénéité des seuils de dépistage selon les pays et leurs abaissements successifs depuis plusieurs années rendent difficiles l’interprétation des comparaisons internationales des incidences de l’HC. Ainsi, le taux d’HC dans notre étude est nettement inférieur au taux observé en Italie sur la période 1999-2005 (région de Lombardie : 69 HC/100 000 naissances) avec un seuil de détection plus bas (10 mUI/L) 7. Dans cette étude, l’incidence aurait été de 37/100 000 avec un seuil de détection à 20 mUI/L, ce qui est proche de l’incidence d’HC observée dans notre étude. D’autres régions européennes avec des seuils de détection plus bas ont également des taux d’incidence plus élevés (nord de l’Angleterre : 60 HC/100 000 naissances avec un seuil de 20 mU/L à 10 mU/L pour la méthode radioimmunologique et de 6 mU/L pour la méthode immunofluorimétrique 8 ; Grèce : 1 cas sur 1 749 naissances avec un seuil à 10 mU/L et 1 cas sur 3 384 avec un seuil à 20 mU/L 9).
Dans notre étude, la proportion de cas d’HC avec GEP (37,5%) était proche de celles observées au Québec (30%) 6 et en Nouvelle-Zélande (33%) 5, mais elle était légèrement inférieure à celle observée en Italie avec un seuil de détection équivalent (44%).
Le sex-ratio est équilibré chez les HC avec GEP alors qu’on observe une prédominance des filles (70,7%) chez les dysgénésies. Cette prédominance de filles est bien connue chez les enfants atteints d’ HC avec dysgénésies (Nouvelle-Zélande : 83%, Québec : 74,1% de filles chez les HC avec ectopie).
La proportion de prématurité est plus élevée chez les HC (8,4%) que dans la population générale des nouveau-nés (ENP 2010 : 7,4%). Les proportions de prématurité (14,2% chez les enfants atteints d’HC avec GEP et 4,8 % chez ceux atteints d’HC avec dysgénésie) sont proches de celles de l’étude néo-zélandaise (15% chez les enfants atteints d’HC avec GEP et 6% chez ceux atteints d’HC avec dysgénésie). En Italie, la fréquence de prématurité observée chez l’ensemble des enfants atteints HC durant la période 2000-2006 était de 23,4% avec un seuil de dépistage inférieur ou égal à 15 mU/L et de 12,1% avec un seuil supérieur à 15 mU/L 10, et de 20% avec un seuil de dépistage plus bas (10 mU/L) durant la période 2003-2005 7.
La proportion des PPN est plus élevée chez les HC avec GEP que chez l’ensemble des nouveau-nés. La proportion d’enfants de PPN chez les HC en France (10%) est plus faible qu’en Italie (Lombardie : 20%) et qu’aux États-Unis (Massachusetts : 36% en 2001-2004) 11. La proportion d’HC avec très PPN (<1 500 g) est extrêmement faible en France (1,4%) par rapport à l’Italie (4,8%) et aux États-Unis (Massachusetts : 19% en 2001-2004). Toutefois, en Italie, les seuils de dépistage plus bas (10 mU/L) que ceux pratiqués en France permettent de détecter davantage d’HC. Dans le Massachusetts, le protocole mis en place depuis 2001, qui comporte un nombre élevé de prélèvements successifs chez les enfants de très PPN (à 2, 6 et 10 semaines) peut contribuer à cette différence. En effet, dans cette série, ont été décelées des HC de constitution tardive. En revanche au Québec, sur la période 1990-2009, l’incidence de l’HC chez les enfants de PPN (7,2%) est identique à celle de la population générale des nouveau-nés 6.
Dans notre étude, une augmentation des taux d’incidence des HC avec GEP a été observée entre 2002 et 2012. La proportion de cas présentant des facteurs de risque d’HC (prématurité, PPN) n’a pas varié sur cette période et ne semble donc pas contribuer à cette augmentation.
Les effectifs de nouveau-nés testés inclus dans cette étude étaient très similaires aux données de naissances publiées par l’Insee, ce qui montre un quasi-exhaustivité des tests de dépistage néonatal de l’HC et donc une très bonne adhésion des parents à ce programme de dépistage universel sur l’ensemble du territoire national.
Selon Parks et coll. 12, l’augmentation des taux d’incidence des HC pourrait refléter un nombre plus élevé de formes bénignes et transitoires pour lesquelles les étiologies restent le plus souvent méconnues. Ces formes transitoires pourraient être liées à une augmentation des apports iodés (par l’utilisation de désinfectants iodés lors de l’accouchement ou de produits de contraste iodés lors de radiographies, ou encore une consommation élevée d’iode par la mère), à certaines formes de thyroïdite maternelle avec passage transplacentaire d’anticorps ayant un effet transitoirement bloquants sur la fonction thyroïdienne du nouveau-né. Une étude italienne 10, qui comportait un suivi des enfants avec réévaluation de la fonction thyroïdienne à l’âge de 3-5 ans, a montré que la proportion d’HC transitoires était nettement plus élevée lorsque le taux de TSH au dépistage était faible (54% des cas avec TSH<15 mU/L) que lorsque qu’il était plus élevé (21,6% des cas avec TSH>15 mU/L). À partir des données du dépistage en France, il n’est pas possible de différencier les HC transitoires des HC permanentes, mais la proportion élevée de taux de TSH inférieurs à 50 mU/L chez les HC avec GEP (46%) rend cette hypothèse plausible. Un suivi des cas traités depuis la naissance permettrait d’estimer la proportion de cas dont le traitement a été arrêté à l’âge de 2-3 ans. Une analyse des données du Sniiram (Système national d’information inter-régimes de l’assurance maladie) pour déterminer la proportion d’HC transitoires et son évolution dans le temps est en cours de réalisation.
Conclusion
Les résultats de cette étude permettent de mettre en évidence des différences importantes dans la présentation clinique des patients avec HC avec GEP par rapport aux patients avec dysgénésies, avec davantage de prématurité et de PPN, ainsi qu’un sex-ratio équilibré parmi les patients avec GEP. Cependant, ces différences ne paraissent pas expliquer l’augmentation du taux d’incidence des patients avec GEP observée pendant la période étudiée. D’autres études restent nécessaires pour élucider l’augmentation de l’incidence des GEP pendant cette période ainsi que les disparités régionales.




