Plus de 40 ans de dépistage néonatal en France : des données épidémiologiques majeures pour plusieurs maladies rares
// More than 40 years of neonatal screening in France: major epidemiological data for several rare diseases
Résumé
Le dépistage néonatal a débuté officiellement en France en 1972. Il est organisé par l’Association française pour le dépistage et la prévention des handicaps de l’enfant (AFDPHE) et sous la tutelle du ministère de la Santé et de la CnamTS (Caisse nationale d’assurance maladie des travailleurs salariés). Ses principales caractéristiques sont :
- l’accomplissement de la mise en place progressive d’un programme national de prévention offert à tous les nouveau-nés pour cinq maladies : phénylcétonurie (PCU) en 1972, hypothyroïdie congénitale (HC) en 1978, drépanocytose en Outre-Mer en 1985 et en métropole, de façon ciblée, en 1995, hyperplasie congénitale des surrénales (HCS) en 1995 et mucoviscidose en 2002 ;
- une liaison obligatoire entre dépistage et traitement, le dépistage n’ayant de justification que s’il assure à l’individu malade un bénéfice individuel immédiat et durable ;
- des résultats probants avec une couverture de 99,98% des nouveau-nés et une prise en charge des malades par les équipes référentes régionales ;
- une centralisation des résultats permettant un suivi épidémiologique de l’incidence de chaque maladie dépistée ;
- le souci constant de suivre l’évolution médicale et technologique (biologie moléculaire, spectrométrie de masse en tandem) pour offrir ce type de prévention à d’autres maladies, en restant en adéquation avec les critères de dépistage publiés en 1970 par l’Organisation mondiale de la santé (OMS).
Ainsi, depuis plus de 40 ans, 33 millions de nouveau-nés ont été dépistés en France et 19 380 diagnostiqués. En 2013, cela correspondait à 1 naissance sur 1 900 pour l’ensemble des cinq maladies dépistées : 1/18 435 pour la PCU, 1/2 870 pour l’HC, 1/23 044 pour l’HCS, 1/419 pour la drépanocytose en Outre-Mer et 1/793 en métropole, et 1/7 753 pour la mucoviscidose.
Abstract
Newborn screening began officially in France in 1972. It is organized by the French Association for Screening and Prevention of Infant Handicaps (AFDPHE)] under the Ministry of Health and the National Health Insurance Fund for Salaried Workers (Cnamts). Its main features are:
- Successful challenge to the gradual establishment of a national prevention program offered to all newborns: phenylketonuria (PKU) in 1972, congenital hypothyroidism (CH) in 1978, Sickle Cell Disease (SCD) in 1985 in overseas departments and targeted since 1995 in metropolitan France, congenital adrenal hyperplasia (CAH) in 1995, Cystic Fibrosis (CF) in 2002;
- Compulsory link from screening to treatment, screening being justified only if it gives an individual immediate and long term advantage to the patient;
- Spectacular results with a 100% coverage of newborns and full support of all patients by the regional health teams;
- Centralization of results allowing the epidemiological monitoring of the incidence of each disease detected;
- Constant concern to follow the medical and technological advances (molecular biology, mass spectrometry in tandem) to offer this type of prevention of other diseases, while meeting the screening criteria published in 1970 by the World Health Organization (WHO).
For more than 40 years, 33 million newborns were screened in France, and 19,380 were diagnosed. In 2013 this corresponded to 1 birth in 1,900 for all five diseases screened: 1/18,435 for PKU, 1/2,870 for CH, 1/23,044 for CAH, 1/419 for SCD in Overseas Departments, and 1/793 in metropolitan France, 1/7,753 for CF.
Introduction
L’histoire du dépistage néonatal (DNN) systématique, à partir de taches de sang séché sur papier buvard, remonte à 1963 avec la mise au point du test de Guthrie qui, réalisé à trois jours de vie, permet de dépister la phénylcétonurie (PCU). On peut doser dans ce prélèvement la phénylalanine (PHE) dans le sang et donc son élévation, toxique pour le développement cérébral de l’enfant. La PCU, maladie héréditaire de transmission autosomique récessive, devenait ainsi le premier retard mental évitable grâce à l’instauration précoce d’un régime alimentaire spécifique pauvre en PHE à un stade pré-symptomatique, permettant à des enfants d’éviter le déficit mental. Le concept de DNN au moyen de gouttes de sang était né et s’est généralisé à d’autres maladies.
Parmi tous les nouveau-nés (NN), le test de dépistage permet simplement de classer les NN en « enfants probablement non atteints » ou « enfants possiblement malades ». Il ne s’agit pas d’un diagnostic de certitude et un résultat suspect doit donc toujours être confirmé ou infirmé par des examens complémentaires spécifiques à la maladie. La finalité du dépistage est donc, par le biais d’un diagnostic et d’un traitement précoces, d’apporter à l’enfant un bénéfice direct individuel en évitant les symptômes souvent graves, voire mortels, de sa maladie. Il va pouvoir se développer normalement jusqu’à atteindre l’âge adulte. Pour la drépanocytose et la mucoviscidose, les patients bénéficient d’une franche amélioration de leur qualité de vie et surtout de leur espérance de vie.
Le DNN a été introduit progressivement en France à partir de 1968 ; depuis 1972, une association de statut privé (loi 1901), l’Association française pour le dépistage et la prévention des handicaps de l’enfant (AFDPHE : www.afdphe.org), a la charge, par délégation du ministère de la Santé, de mettre en place et de gérer cette action de santé publique sur tout le territoire national. Le financement, assuré en totalité par la Caisse nationale d’assurance maladie des travailleurs salariés (CnamTS), couvre les charges liées à la réalisation des tests de dépistage et à leur gestion administrative et médicale. La prise en charge et le traitement des malades repérés relèvent du régime général de l’assurance maladie.
Après la PCU en 1972, quatre autres maladies ont été introduites dans l’organisation d’un DNN systématique : l’hypothyroïdie congénitale (HC) en 1978 ; la drépanocytose ou syndromes drépanocytaires majeurs (SDM), en 1989 dans les départements et régions d’outre-mer puis en 1995 en métropole, pour une population ciblée ; l’hyperplasie congénitale des surrénales (HCS) en 1995 ; la mucoviscidose (CF pour cystic fibrosis) en 2002. La liste des maladies dépistées a été fixée par le
ministère de la Santé, après avis de l’Agence de la biomédecine, par un arrêté de 2010 1. Ce dispositif permet ainsi un recueil épidémiologique national pour ces cinq maladies.
Population et méthodes
L’AFDPHE fédère 23 associations régionales, soit environ une par région administrative. La réussite du programme du DNN en France est liée à une implication importante de tout le personnel, à la maternité, où est donnée l’information aux parents et où est réalisé le prélèvement au 4e jour de vie, puis aux associations régionales qui enregistrent les cartons de prélèvement et réalisent les analyses biologiques, et enfin aux équipes référentes régionales pour chaque maladie pour la prise en charge du cas du NN suspecté d’être porteur de la maladie. Cette proximité permet une très bonne réactivité, d’une part lorsqu’un dépistage est positif, d’autre part lorsqu’il y a une dérive dans le circuit du prélèvement, avec retard d’acheminement du papier buvard ou prélèvement défectueux par exemple. L’association régionale contrôle l’exhaustivité du DNN en rappelant qu’il s’impose aux professionnels de la naissance, alors que les parents peuvent le refuser malgré l’information fournie 1. Néanmoins, les refus de prélèvement sont exceptionnels (193 sur 829 763 NN à tester en 2013) car les parents comprennent facilement l’intérêt pour l’enfant d’être dépisté et traité aussitôt s’il est atteint d’une des cinq maladies avant même qu’elle puisse s’exprimer de manière irréversible.
Les associations régionales transmettent ensuite chaque trimestre leurs résultats à l’AFDPHE, qui recueille les résultats de l’ensemble de la population des NN en France et apporte ainsi la garantie auprès des tutelles que les tests de DNN ont bien été réalisés et que les enfants sont ensuite pris en charge. C’est au vu de ces résultats que la CnamTS paye l’AFDPHE qui, à son tour, reverse l’argent, au prorata du nombre de naissances, aux associations régionales. Tant que l’une d’entre elles ne communique pas son activité, l’ensemble des associations ne peuvent être payées, ce qui entraîne une excellente solidarité des associations et explique que sont recueillis 100% des résultats 2.
Tous les ans, l’AFDPHE communique les résultats de l’année n-1, par région, métropolitaine et d’outre-mer, et par maladie. On peut donc calculer une incidence de la maladie depuis le début de chaque programme en analysant son évolution annuelle. Sur un très grand nombre de naissances, cela permet de mettre en évidence des différences régionales et de surveiller l’évolution en incidence de chaque maladie. S’agissant de maladies rares, les associations régionales recensent les malades qui auraient échappé au dépistage en demandant aux médecins référents régionaux de leur communiquer ces éventuels faux-négatifs du DNN (NN atteint non repéré par le DNN), permettant de déterminer la sensibilité du test. Un dépistage n’est pas un diagnostic et des NN peuvent être sollicités à nouveau suite à un test douteux avec un diagnostic non confirmé ; il s’agit alors de faux-positifs du DNN dont il importe de suivre le nombre car il va déterminer la spécificité du test de dépistage.
La réactivité régionale permet de réduire au maximum le délai de prise en charge des malades (y compris pour l’Outre-Mer), ce qui est essentiel, notamment pour l’HCS, pour laquelle le décès par déshydratation peut survenir au cours de la 2e semaine de vie, la PCU et l’HC, pour lesquelles le pronostic du développement intellectuel dépend de la précocité du traitement.
Résultats
Les résultats détaillés sont disponibles sur le site Internet de l’AFDPHE 3 ; ceux de 2013 sont présentés dans le tableau 1.
Depuis 1972, et jusqu’au 31 décembre 2013, ce sont plus de 31 millions de NN qui ont eu un DNN par « test de Guthrie » et 19 380 NN ont été repérés comme atteints d’une des cinq maladies dépistées. Les résultats seront présentés par maladie. En réalité ce sont 33 millions de NN qui ont eu un DNN, car certaines régions avaient commencé à titre expérimental dès 1967.
La phénylcétonurie (PCU)
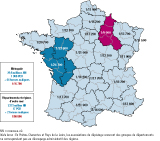
L’incidence de la PCU en 2013 est globalement celle attendue. Tous les cas sont nés en métropole et la différence France métropolitaine – Outre-Mer existe depuis le début du programme en 1972 puisque, si l’incidence est de 1/15 706 sur 29,841 millions de NN métropolitains, elle n’est que de 1/80 784 pour les 1,373 million de NN Outre-Mer, soit une fréquence de 1/16 283 (intervalle de confiance à 95%, IC95%: [1/17 046-1/15 585]) pour 31,214 millions de NN sur toute la France (figure 1). Il est intéressant de constater que la répartition est également hétérogène en métropole. Les variations annuelles ne sont pas significatives. Au total, ce sont 1 963 cas de PCU qui ont bénéficié d’une prise en charge depuis 1972, permettant à ces enfants d’avoir une vie normale avec la mise en route d’un régime restrictif en PHE 4,5.
Tout DNN repère aussi des formes dites modérées qu’il n’est pas toujours facile de classer, mais les spécialistes recommandent maintenant de repérer et de démarrer un traitement au moins provisoirement 4 ; en 2013, ce sont 50 hyperphénylalaninémies modérées permanentes (HMP) qui ont été prises en charge, et 1 244 depuis 1972. Si on les rajoute aux véritables PCU, cela fait une incidence de 1/9 875 NN.
En 2013, les PCU classiques ont été pris en charge à l’âge médian de 10 jours [9-12] et de 15 jours [13,5-19,5] pour les PCU atypiques. Il n’y a eu aucun faux-négatif.
L’hypothyroïdie congénitale (HC)
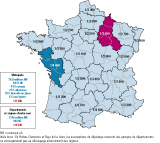
Depuis 1978, date de la mise en place du DNN de l’HC par dosage de la TSH, 8 281 NN atteints ont été repérés sur un total d’un peu plus de 28 millions, soit une incidence de 1/3 398 NN (IC95%: (1/3 473-1/3 326]). Là aussi, les différences sont importantes selon les territoires (figure 2) : 2 fois plus en métropole qu’Outre-Mer et au sein même du territoire métropolitain. Ces HC se répartissent en 2/3 de dysgénésies thyroïdiennes (ectopie et athyréose) et près d’1/3 de glande en place (GEP) et d’HC non typées.
Ces dernières années, l’incidence en données brutes des HC dépistées semble s’élever de façon significative, en raison notamment d’un nombre plus élevé de GEP. Une étude détaillée prenant en compte les variations de seuil et de technique de laboratoire est en cours avec l’Institut de veille sanitaire (InVS), car ce phénomène est déjà signalé dans la littérature internationale 6. En 2013 (tableau 1), 289 HC ont été repérées (282 en métropole et 7 Outre-Mer) soit une incidence de 1/2 870 ; elle était de 1/3 470 en 2006 par exemple (p=0,03). L’âge médian de prise en charge est de 10 jours, toutes étiologies confondues. Les associations régionales ont déclaré 8 faux-négatifs avec un taux de TSH inférieur au seuil, dont 1 ectopie traitée à 24 jours de vie, les 7 autres étant des GEP, dont 2 pouvant être transitoires.
L’hyperplasie congénitale des surrénales (HCS)
Le DNN de l’HCS par dosage de la 17-hydroxyprogestérone est caractérisé par un nombre important de cas de NN suspects (0,6%). Ceci s’explique essentiellement par le grand nombre de faux-positifs engendrés par la prématurité et notamment celle inférieure à 32 semaines d’aménorrhée. Cela a conduit l’AFDPHE à proposer l’arrêt de ce dépistage chez ces grands prématurés, d’autant qu’ils sont repérés sur l’examen clinique lors de leur hospitalisation obligatoire en néonatologie 7. Il a fallu néanmoins attendre la modification de l’arrêté de 2010 1 avant d’officialiser cet arrêt pour cette catégorie de NN.
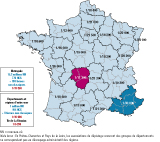
En 2013 (tableau 1), l’incidence est celle attendue, avec toutefois la particularité qu’il n’y a aucun cas Outre-Mer alors qu’habituellement il y a une incidence nettement plus élevée à l’île de La Réunion, 1/6 218 depuis le début du DNN en 1995 alors qu’elle n’est que de 1/19 852 en métropole (figure 3). Sur l’ensemble du territoire national, l’incidence est de 1/18 671 (IC95%: [1/19 996-1/17 511]) pour 16,337 millions de NN, avec là aussi des incidences variant du simple au triple selon les régions métropolitaines.
En 2013, l’âge médian de la prise en charge des NN dépistés est plus précoce que pour les autres programmes, de l’ordre de 4 jours [0-7,3], mais ces résultats incluent les NN repérés sur signes cliniques (ambiguïté sexuelle) et donc avant les résultats du dépistage. Pour les enfants déjà à domicile au moment du résultat, l’âge médian à la prise en charge est de 7 jours [6-9], mais il faut déplorer 1 décès par perte de sel chez une petite fille sans ambiguïté sexuelle le jour de sa convocation à 9 jours de vie, ce qui illustre encore la nécessité d’un résultat rapide même si habituellement la perte de sel intervient au-delà de 10 jours. Les associations régionales ont signalé 3 faux-négatifs, 2 formes classiques virilisantes pures et 1 forme non classique.
 Agrandir l’image
Agrandir l’image
Les syndromes drépanocytaires majeurs (SDM)
Les résultats du DNN des SDM ont déjà été présentés dans le BEH en 2012 8. Ceux de l’année 2013 (tableau 1) ne viennent pas modifier les résultats globaux contenus dans cet article. On rappelle que ce DNN s’est généralisé progressivement dans les départements et régions d’outre-mer à partir de 1985 et qu’il s’est mis en place également progressivement sur une population ciblée en métropole à partir de 1995 (les deux parents originaires de pays à incidence élevée de SDM ou des départements et régions d’outre-mer, ou une mère seule originaire de ces pays mais avec un père non signalé).
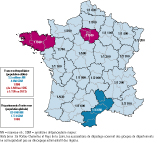
En 2013, ce sont 279 903 NN de métropole qui ont bénéficié de ce DNN (35,7% des naissances métropolitaines) et bien sûr les 36 844 NN ultramarins. Au total, 441 SDM ont été repérés, ce qui fait de cette maladie la plus fréquente de celles ayant un DNN : 353 en métropole soit 1/793, et 88 en Outre-Mer soit 1/419. Si on appliquait ce chiffre à l’ensemble des naissances métropolitaines cela situerait l’incidence à 1/2 221 (IC95%: [1/2 479-1/2 011]), mais avec des différences importantes selon les régions allant de 1/874 en Île-de-France (avec 68% de population ciblée) à 1/21 663 en Provence-Alpes-Côte d’Azur et Corse (avec 44% de population ciblée). L’incidence en population ciblée est détaillée dans la figure 4. Cela témoigne des différentes origines géographiques représentées dans la population et, par exemple, la région Provence-Alpes-Côte d’Azur est davantage concernée par la thalassémie que par les SDM.
La particularité de la technique utilisée, l’électrophorèse de l’hémoglobine, est qu’elle repère aussi les hétérozygotes et ce sont 11 800 NN dont les parents auront besoin d’une consultation d’information.
Le pourcentage de la population ciblée en métropole est passé de 27% en 2006 à 35,7% en 2013. Cependant, le taux d’hétérozygotes est resté stable à 1/37 NN, ce qui est un indicateur de ciblage correct. Néanmoins, ce ciblage est depuis longtemps remis en questions pour trois raisons : l’interrogation des parents sur leur origine géographique, qui pose des problèmes de discrimination dans un pays qui interdit par ailleurs les statistiques basées sur l’origine ethnique, le mélange de groupes ethniques rendus non identifiables après plusieurs générations et une fréquence très élevée de populations à cibler dans certaines régions. La Haute Autorité de santé (HAS) a été saisie par la Direction générale de la santé (DGS) en 2012 de la question de la généralisation de ce dépistage à la totalité de la population. Dans son rapport d’orientation rendu public en mars 2014, la HAS conclut qu’il n’y a pas d’éléments permettant de justifier la pertinence d’une stratégie de DNN systématique des SDM en France métropolitaine 9.
La procédure du DNN des SDM est plus longue puisqu’on a regroupé dans quatre laboratoires l’analyse biologique avec envoi secondaire des taches de sang en cas de ciblage. En 2013, l’âge médian au résultat est de 18 jours [11-27], la confirmation du diagnostic de 57 jours [42-80] et la prise en charge thérapeutique de 66 jours [48,5-87] en raison, entre autres, d’une population pas toujours facile à joindre, mais ce délai ne grève pas le pronostic. Les associations régionales ont déclaré 4 faux-négatifs non repérés par le DNN, dus à une erreur de ciblage sur l’origine géographique des parents.
 Agrandir l’image
Agrandir l’image
La mucoviscidose (CF)
Dernier dépistage systématique mis en place en 2002, celui de la CF a un algorithme plus complexe puisqu’il associe un dosage biochimique, celui de la trypsine immunoréactive (TIR), libérée par le pancréas en cours de remaniement, à une recherche des mutations les plus prévalentes dans la population française du gène impliqué dans la CF (gène CFTR) lorsque la TIR dépasse le seuil d’action et à condition que les parents aient signé au préalable, au dos du carton de prélèvement, leur consentement à cette recherche génétique. Comme pour la drépanocytose et à l’inverse des autres maladies, il ne s’agit pas ici d’éviter l’apparition de la maladie mais d’avoir une prise en charge spécialisée précoce afin d’en ralentir l’évolution et, en particulier, éviter de graves conséquences nutritionnelles 10. Il peut là aussi y avoir un envoi secondaire des taches de sang dans les laboratoires agréés de biologie moléculaire travaillant pour plusieurs associations régionales. Cela explique un délai de prise en charge également plus long, là encore non préjudiciable pour l’enfant.
En 2013 (tableau 1), le DNN ne concerne que 814 067 NN parce que la Martinique n’a débuté ce programme qu’en cours d’année et surtout parce que les territoires d’outre-mer ne sont pas concernés (1). Le taux de TIR supérieur au seuil d’action est de 0,44% (3 497 études en biologie moléculaire), proche du pourcentage théorique déterminé lors de la mise en route du programme (0,5%). Seuls 443 enfants ont été adressés dans un Centre de référence ou de compétence de la mucoviscidose pour réaliser le test diagnostique de la sueur, soit parce qu’on identifiait d’emblée deux mutations du gène CFTR ou une seule mutation (ce qui nécessite de vérifier qu’il s’agit d’un enfant hétérozygote sain et non porteur d’une 2e mutation non identifiée par le kit de dépistage), ou 0 mutation mais gardant un taux de TIR anormalement élevé à J21, ce qui nécessite de reconvoquer le NN à la maternité.
Cet algorithme compliqué identifiait malgré tout trop de faux-positifs et la stratégie a été modifiée en ne demandant un contrôle de TIR à J21 que lorsque le taux de TIR à J3 était particulièrement élevé 11. De ce fait, sur les 443 NN convoqués, 105 ont été déclarés atteints de CF, 88 de forme classique et 17 de forme atypique. L’incidence n’est plus que de 1/7 753 alors qu’elle était encore de 1/4 448 en 2006. Une analyse des données depuis le début du DNN en 2002 est prévue afin d’évaluer si les variations observées sont significatives. Une étude régionale menée en Bretagne, qui pratique ce dépistage depuis 1989, avait déjà montré la baisse de l’incidence sous l’influence du DNN et des diagnostics échographiques anténatals 12. L’âge médian de prise en charge est de 42 jours [32-50].
Depuis 2002 (figure 5), l’incidence globale est de 1/4 909 (IC95%: [1/5 141-1/4 697]) pour 1 881 malades sur 9,233 millions de NN, avec là encore des différences régionales importantes.
Chaque année, l’AFDPHE recense auprès des Centres de référence ou de compétence de la mucoviscidose les CF diagnostiquées non repérées par le DNN. En 2013, 4 malades faux-négatifs ont été repérés, dont 2 nés la même année. Il est important de suivre longtemps les résultats du DNN car un diagnostic sur symptômes cliniques peut être fait des années plus tard et, depuis le début du programme, le pourcentage de faux-négatifs reste à 4,6%, ce qui était là aussi admis au départ 13.
Discussion – conclusion
L’organisation du DNN, instaurée en France en 1972, montre son efficacité avec les objectifs fixés dès le départ : accomplissement de la mise en place progressive d’un programme national de prévention offert pour tous les NN ; couverture de quasi 100% des NN avec la certitude d’une prise en charge du malade repéré par une équipe référencée et un nombre faible et acceptable de faux-négatifs ; centralisation des résultats permettant un suivi épidémiologique de l’incidence de chaque maladie dépistée.
Il est de la responsabilité des tutelles de décider l’introduction de nouveaux dépistages rendus possibles par l’évolution médicale et technologique afin d’offrir ce type de prévention à d’autres maladies, en restant en adéquation avec les critères de dépistage de l’OMS 14. La France a pris du retard dans ce type de programme par rapport aux autres pays européens.
L’avancée majeure actuelle correspond à la mise au point de la spectrométrie de masse en tandem (MS/MS), qui fait passer de la situation « 1 test-1 maladie » à « 1 test-30 maladies » (sans compter les variantes). Cette technique est déjà utilisée dans plusieurs pays avec un nombre variable de maladies dépistées, mais intéressant le plus souvent le déficit en MCAD (medium-chain acyl-CoA deshydrogenase), maladie non exceptionnelle (1/17 000 à 1/20 000 en Europe du Nord), s’exprimant par des crises de décompensation sévères rapidement mortelles, favorisées par une infection ou un jeûne prolongé 15.
Cette extension de dépistage a fait l’objet de recommandations de la HAS en 2011 16, mais la décision ministérielle pour sa mise en place n’est pas encore intervenue. Elle nécessite en effet une réorganisation de la structure du DNN, avec des recommandations de regroupements d’associations régionales pour tenir compte de la rentabilité d’un appareil de MS/MS. La HAS travaille aussi actuellement sur le 2e volet de cette extension à d’autres erreurs innées du métabolisme que la MS/MS permet de détecter.
D’autres maladies suivront, et notamment les déficits immunitaires combinés sévères, dont le DNN se généralise progressivement aux États-Unis et dont un protocole expérimental se met actuellement en place en France. À partir du DNN, on pourra alors suivre précisément l’évolution épidémiologique de ces maladies comme cela est le cas actuellement pour les cinq maladies qui en bénéficient déjà.