Performance de l’auto-prélèvement vaginal sec pour la détection des infections à papillomavirus à haut risque oncogène dans le cadre du dépistage du cancer du col de l’utérus : une étude transversale
// Accuracy of dry vaginal self-sampling for detecting high-risk human papillomavirus infection in cervical cancer screening: a cross-sectional study
Résumé
La participation au dépistage du cancer du col de l’utérus reste insuffisante dans de nombreux pays. La recherche de papillomavirus humains à haut risque (HPV-HR) sur des auto-prélèvements pourrait être une alternative au frottis cervico-utérin (FCU). Notre objectif était de comparer la performance diagnostique de deux méthodes d’auto-prélèvement vaginal (APV), un écouvillon sec (APV-Sec) ou un écouvillon avec milieu de transport liquide (APV-Liq), pour la détection d’infections cervicales à HPV-HR, en comparaison avec un prélèvement cervical en milieu liquide réalisé par un clinicien (PCC-Liq).
Des femmes de 20 à 65 ans ont été recrutées en consultation hospitalière de gynécologie, d’orthogénie ou en centre d’examens de santé entre septembre 2009 et mars 2011. Une recherche d’HPV était réalisée sur chaque prélèvement (3 par femme).
Sur les 734 femmes incluses, le résultat des 3 tests HPV était disponible pour 722. La sensibilité et la spécificité de détection des HPV-HR dans les APV-Sec étaient estimées à 88,7% et 92,5%, respectivement ; elles étaient de 87,4% et 90,9% pour les APV-Liq. Parmi les 27 lésions cytologiques de bas grade, 25 étaient HPV-HR+ pour les 3 prélèvements. Parmi 6 lésions de haut grade, toutes étaient HPV-HR+ pour les APV-Sec et 1 était HPV-HR- sur APV-Liq et sur PCC-Liq.
L’APV sec est une méthode performante pour la détection d’infections cervicales à HPV-HR. Son efficacité et son rapport coût-efficacité pour atteindre les femmes ne réalisant pas de FCU dans un programme de dépistage organisé doivent être évalués avant que ce test ne puisse être utilisé à grande échelle.
Abstract
Cervical cancer screening coverage remains insufficient in many countries. Testing self-collected samples for high-risk human papillomavirus (HPV-HR) could be an alternative to the Pap-smear. Our objective was to compare diagnostic accuracy of two vaginal self-collection methods, a dry swab (vsc-DRY) or a swab in liquid medium (vsc-LIQ), for detecting HR-HPV cervical infection assessed by a cervical clinician-collected sample in liquid medium (ccc-LIQ).
Women aged from 20 to 65 years were recruited in outpatient gynaecology, family-planning clinic or medical check-up centers between September 2009 and March 2011. Each sample (3 per woman) underwent HPV DNA testing.
Among 734 women included, the results of the three HPV tests were available for 722 women. Sensitivity and specificity to detect HR-HPV in vsc-DRY samples was 88.7% and 92.5%, respectively, and in vsc-LIQ samples, 87.4% and 90.9%. Among 27 samples of low-grade squamous intraepithelial lesions, 25 were HR-HPV+ in vsc-DRY, vsc-LIQ and ccc-LIQ samples. Among 6 samples of high-grade squamous intraepithelial lesions, all were HR-HPV+ in vsc-DRY samples, 1 was HR-HPV- in vsc-LIQ samples and 1 was HR-HPV- in ccc-LIQ samples.
Vaginal self-sampling using a dry swab is an accurate method for detecting HR-HPV cervical infection. Its efficacy and cost-effectiveness ratio have to be evaluated before large-scale implementation.
Introduction
Dans le monde, le cancer du col de l’utérus est le deuxième cancer le plus fréquent chez les femmes, avec plus de 600 000 cas incidents et 300 000 décès annoncés en 2015 1. Le dépistage par frottis cervico-utérin (FCU) a permis une réduction importante de l'incidence et de la mortalité liées à ce cancer. Cependant, la couverture de ce dépistage, estimée à 63% dans les pays développés, reste insuffisante 2.
L'infection persistante à papillomavirus humains à haut risque oncogène (HPV-HR) est un facteur nécessaire pour le développement du cancer invasif du col utérin 3. Des études récentes ont montré que la recherche d’HPV était une alternative performante au FCU pour dépister les femmes de plus de 30 ans 4. De plus, la recherche d’HPV peut être réalisée sur des auto-prélèvements génitaux, comme la recherche de certaines autres infections sexuellement transmissibles 5, et pourrait être une technique efficace pour augmenter la participation au dépistage pour les femmes qui ne sont jamais ou rarement dépistées 6. Le choix du dispositif et les modalités de transport des prélèvements doivent être évalués avant l’utilisation en population générale. Une grande variété de dispositifs d'auto-prélèvement (écouvillons, brosses, tampons, serviettes et lavages cervico-vaginaux) a été testée 6. Les dispositifs sont généralement placés dans un milieu de transport liquide lors du prélèvement. Les aspects peu pratiques et le coût de transport du liquide peuvent limiter l’introduction à grande échelle des méthodes d'auto-prélèvements dans les programmes de dépistage organisé. Un écouvillon sec pourrait constituer un réel progrès en termes de prélèvement, de coût et de facilité d’expédition ; l’écouvillon pourrait être adressé aux femmes non dépistées et renvoyé à un laboratoire par la poste.
Nous avons cherché à comparer la performance diagnostique de deux méthodes d’auto-prélèvement vaginal (APV) : un écouvillon sec (APV-Sec) ou un écouvillon avec un milieu de transport liquide (APV-Liq) pour la détection d’infection cervicale à HPV à haut risque (HPV-HR), en comparaison avec un prélèvement cervical en milieu liquide réalisé par un clinicien (PCC-Liq).
Matériel et méthodes
Une étude transversale multicentrique a été menée dans quatre centres : un centre d’orthogénie et un centre de consultation de gynécologie au Centre hospitalier régional universitaire (CHRU) de Tours, et deux centres d’examens de santé à Tours et au Mans (Institut inter-régional pour la santé, Irsa). Le protocole d'étude a été approuvé par le Comité de protection des personnes de Tours et toutes les femmes ont signé un consentement éclairé.
Toute femme consultant pour un dépistage par frottis pouvait être incluse si elle était âgée de 20 à 65 ans, déclarait ne pas être vierge, ni enceinte, ni vaccinée contre l’HPV, n’était pas en période menstruelle et n’avait pas eu de frottis depuis au moins 2 ans, ni subi une hystérectomie.
Trois prélèvements génitaux étaient réalisés pendant la consultation : un APV-Sec (écouvillon sec), un APV-Liq (écouvillon placé dans un milieu de transport liquide) et un PCC-Liq (prélèvement cervical réalisé par un clinicien avec une cyto-brosse, placé dans un milieu de transport liquide).
Les écouvillons en nylon floqués ont été sélectionnés pour leurs capacités de prélèvement et d’élution, leur prix bas et leur aspect plus acceptable que d’autres dispositifs de prélèvement (brosses, lavages cervico-vaginaux).
Un kit d’auto-prélèvement était remis aux femmes pendant la consultation. Ce kit contenait : 1) une notice élaborée en collaboration avec une illustratrice médicale avec des instructions écrites et des dessins expliquant comment réaliser les deux auto-prélèvements ; 2) pour l’APV-Sec, une enveloppe contenant un écouvillon en nylon floqué dans un tube en plastique souple incassable ; 3) pour l’APV-Liq, une enveloppe contenant un écouvillon en nylon floqué et un tube de 12x80 mm contenant 2 mL d’un milieu de transport liquide. L’ordre de réalisation des APV avait été déterminé a priori (randomisation). Les femmes réalisaient les APV dans le bureau du médecin ou à proximité (toilettes, vestiaires) avant l’examen gynécologique et la réalisation du FCU en phase liquide (PCC-Liq). Après les auto-prélèvements, il était demandé aux femmes, par un court questionnaire administré en face-à-face, si elles avaient rencontré des difficultés et si cela était douloureux.
Les deux APV étaient ensuite envoyés séparément à température ambiante, après anonymisation, au laboratoire centralisé de virologie du CHRU de Tours. Les PCC-Liq étaient adressés au laboratoire de cytologie (Irsa, Tours) où ils étaient techniqués en phase liquide (Thinprep 2000®, Hologic), colorés par la méthode de Papanicolaou, puis lus par un anatomo-cytopathologiste selon la classification de Bethesda 2001, puis ils étaient envoyés au laboratoire de virologie pour la recherche d’HPV. Chaque prélèvement était identifié avec un numéro unique afin que les biologistes ne puissent pas rapprocher les 3 prélèvements d’une même femme pendant la réalisation des tests HPV.
Les tests HPV étaient réalisés et validés par deux virologues expérimentés. Les APV-Sec étaient élués avec 3 mL de PBS (phosphate buffered saline). Les autres prélèvements étaient homogénéisés. Les tests HPV étaient ensuite réalisés selon les recommandations du fabricant. Le test HPV utilisé en routine dans le laboratoire centralisé de virologie était le test INNO-LiPA HPV Genotyping Extra® (Innogenetics, Gand, Belgique), qui est basé sur une technique PCR permettant de détecter 28 génotypes d’HPV, dont 15 HPV-HR (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, 82), 3 probables haut risque (26, 53, 66), 7 bas risque (6, 11, 40, 43, 44, 54, 70) et 3 types additionnels de risque inconnu (69, 71, 74). Le test pouvait également être positif sans préciser le génotype (non-typable). Enfin, une bande de contrôle indiquait si le test était interprétable. Ce test avait initialement été sélectionné pour ses possibilités de génotypage (non exploitées dans cette étude), ainsi que pour sa sensibilité analytique élevée qui semblait nécessaire pour des APV, compte tenu d’une charge virale généralement moins importante dans le vagin qu’au niveau du col de l’utérus 7.
Les prélèvements étaient classés HPV-HR+ si au moins un HPV-HR ou un probable HPV-HR était détecté et HPV-HR- dans les autres cas (aucun HPV détecté, présence d’HPV de bas risque ou de risque inconnu ou non-typable).
Le nombre de femmes à inclure était calculé sur la base de la sensibilité de l’APV-Sec et de l’APV-Liq pour détecter des infections cervicales à HPV-HR par rapport au prélèvement de référence (PCC-Liq). En considérant une sensibilité attendue de 85%, et pour montrer l’existence d’une différence significative par rapport à une sensibilité théorique de 75%, nous devions inclure 133 femmes avec un test HPV positif (HPV-HR+) sur le prélèvement de référence (PCC-Liq), en considérant un risque alpha bilatéral de 5% et une puissance de 80%. En prenant l’hypothèse d’une prévalence des infections cervicales à HPV-HR de 15%, nous devions recruter un total de 887 femmes, arrondi à 900 femmes.
Nous avons calculé la sensibilité, la spécificité et les coefficients Kappa avec leurs intervalles de confiance à 95% (IC95%). Les analyses ont été réalisées avec SAS® v9.2 (SAS Inc., Cary, NC).
Résultats
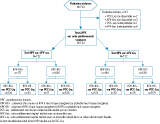
Entre le 11 septembre 2009 et le 9 mars 2011, 734 femmes ont été recrutées. Le nombre de femmes éligibles n’était pas recueilli. Les inclusions ont été arrêtées prématurément car l’effectif attendu de 133 femmes avec un résultat HPV-HR+ sur le PCC-Liq avait été atteint. L’analyse a porté sur les 722 femmes (98,4%) pour lesquelles des données complètes étaient disponibles pour les tests HPV (3 résultats) (figure). La plupart des femmes (74,2%) avaient entre 30 et 65 ans.
 Agrandir l'image
Agrandir l'image
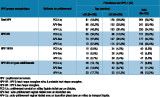
Le résultat des tests HPV était HPV-HR+ pour 151 PCC-Liq (20,9%), 177 APV-Sec (24,5%) et 184 APV-Liq (25,5%) (tableau 1). La sensibilité et la spécificité pour détecter un HPV-HR (ou probable HR) était de 88,7% (IC95%:[82,6-93,3]) et de 92,5% [90,0-94,5] pour l’APV-Sec ; elles étaient de 87,4% [81,0-92,3] et 90,9% [88,2-93,1] pour l’APV-Liq. Selon la classification de Landis et Koch 8, les coefficients Kappa étaient presque parfaits entre les deux APV et forts entre le PCC-Liq et les APV (tableau 2).
 Agrandir l'image
Agrandir l'image
 Agrandir l'image
Agrandir l'image
En limitant l’analyse aux femmes de plus de 30 ans (N=536), la sensibilité et le coefficient Kappa étaient très légèrement inférieurs (non significatif) à ceux observés lors de l’analyse de la population globale ; la spécificité et la concordance étaient très proches de celles obtenues lors des analyses de l’ensemble de la population.
Au total, 79 femmes (10,9%) avaient un frottis anormal ; chez ces femmes, le résultat des tests HPV était HPV-HR+ sur 64,6% des PCC-Liq, 65,8% des APV-Sec et 67,1% des APV-Liq. Parmi 46 ASC-US (atypies des cellules malpighiennes de signification indéterminée), 21 étaient HPV-HR+ sur le PCC-Liq, 21 étaient HPV-HR+ sur l’APV-Sec et 23 étaient HPV-HR+ sur l’APV-Liq. Parmi les 27 LSIL (lésion malpighienne intra-épithéliale de bas grade), 25 étaient HPV-HR+ pour les 3 prélèvements. Parmi 6 HSIL (lésion malpighienne intra-épithéliale de haut grade), toutes étaient HPV-HR+ pour les APV-Sec et 1 était HPV-HR- sur APV-Liq et sur PCC- Liq. Parmi les 634 résultats cytologiques normaux, le résultat était HPV-HR+ sur 15,6% des PCC-Liq, 19,6% des APV-Sec et 20,5% des APV-Liq. Le résultat cytologique était non satisfaisant pour 9 PCC-Liq (tableau 3).
 Agrandir l'image
Agrandir l'image
Au total, 104 femmes (14,4%) déclaraient avoir rencontré des difficultés pour réaliser les APV. Elles avaient notamment des difficultés pour évaluer la profondeur préconisée de l’APV ou pour trouver où et comment introduire l’écouvillon. Une douleur ou sensation désagréable étaient rapportées chez 64 femmes (8,9%).
Discussion
Sur un large échantillon de 722 femmes, notre étude montre qu’un APV est un moyen performant pour détecter une infection cervicale à HPV-HR en comparaison avec un prélèvement cervical réalisé par un clinicien. Ces résultats sont valables aussi bien pour un APV sec que pour un APV avec milieu de transport liquide.
Les études précédentes évaluant la concordance entre des APV et des prélèvements réalisés par un clinicien avaient produit des résultats très hétérogènes 6. Les études mettant en évidence un haut niveau de concordance étaient toutes basées sur des tests HPV utilisant des techniques de PCR 6. La méta-analyse récente d’Arbyn et coll. a montré que la sensibilité et la spécificité d’un test HPV réalisé sur APV sont inférieures à celles d’un test HPV réalisé sur un prélèvement cervical réalisé par un clinicien lorsqu’une méthode par Hybrid capture est utilisée. En revanche, les tests HPV utilisant la PCR montraient généralement une sensibilité similaire sur les APV et sur les prélèvements cervicaux réalisés par un clinicien 9. Ainsi, si l’Hybrid capture semble être une méthode de référence pour le dépistage primaire par test HPV sur des prélèvements cervicaux réalisés par un clinicien, il semble préférable d’utiliser des tests ayant une sensibilité analytique plus élevée pour des APV.
La plupart des études évaluant la performance des APV dans le dépistage du cancer du col utilisaient des milieux de transport liquide, alors que des APV secs seraient plus simples à utiliser et moins chers à envoyer par courrier. Seules quatre études, incluant chacune moins de 140 femmes, avaient évalué l’APV sec, utilisant des dispositifs de prélèvements variés, avec de bons résultats en termes de concordance variant de 84,3% à 86,6% et des coefficients Kappa compris entre 0,67 et 0,72, proches de nos résultats ; ces études utilisaient des techniques de PCR 10,11,12,13. Quatre autres études ont évalué la performance d’auto-prélèvements appliqués sur des matrices en papier imprégné permettant l’extraction, le stockage et le transport de l’ADN ; ces dispositifs, plus coûteux, ont également montré de bons résultats de concordance sur de petits effectifs 14.
Dans notre étude, le calcul d’effectif théorique était basé sur un nombre de femmes ayant un test HPV positif. Afin d’atteindre cet objectif d’inclusion, nous avons décidé d’inclure également les femmes de moins de 30 ans (environ un quart des femmes dans notre étude), car les infections à HPV sont plus fréquentes chez les femmes jeunes. Ceci peut représenter une limite de notre travail, car les femmes de moins de 30 ans ne sont habituellement pas ciblées par un dépistage par test HPV. Toutefois, notre objectif était d’évaluer un dispositif et des méthodes de transport et non la prévalence de l’infection à HPV. Ainsi, la prévalence observée des infections cervicales à HPV-HR (20,9%) était supérieure à notre hypothèse (15%). La prévalence à HPV était plus élevée sur les auto-prélèvements que sur les prélèvements cervicaux quel que soit le niveau de risque des HPV considérés, et plus élevée chez les femmes de moins de 30 ans.
La proportion de femmes ayant déclaré des difficultés (14,4%) et/ou des douleurs (8,9%) lors de la réalisation des auto-prélèvements était supérieure à nos attentes. En effet, les études sur l’APV rapportent habituellement une bonne acceptabilité des APV 6. Il est possible que ce taux élevé soit en partie lié à la formulation des questions. En ce qui concerne la douleur, il aurait été préférable de comparer la douleur ressentie lors de l’APV à celle éprouvée lors du frottis, en l’évaluant sur une échelle visuelle. Les difficultés évoquées pour évaluer la profondeur préconisée de l’APV ou pour trouver où et comment introduire l’écouvillon, pourraient être des pistes pour faire évoluer l’écouvillon (repère visuel ou physique pour la profondeur) et la notice d’utilisation.
À notre connaissance, cette étude est la première à comparer, sur un grand effectif, l’APV sec à un APV avec milieu de transport liquide et à un prélèvement de référence cervical réalisé par un clinicien.
L’APV sec semble une méthode performante pour détecter des infections cervicales à HPV. Son efficacité et son rapport coût-efficacité pour atteindre les femmes ne réalisant pas de FCU dans un programme de dépistage organisé doivent être évalués avant d’envisager une utilisation à grande échelle.
Remerciements
Nous souhaitons remercier les femmes ayant accepté de participer à l’étude et les investigateurs (Trignol-Viguier, Dubreuil, Joly, Blin-Zbiegiel, Neny, Ciavaldini, Charpentier, Jacquet, Acker, Royer, Marquet, Bourderioux, Grenier, Mercat-Caudal, Thivet-Pipelier, Falaise, Teinturier, Cogneau, Cailleau, Seban, Jousse, Masson, Barthelemy, Novak, Contre, Moutarde, d'Hour, Bourges, Chaar, Roncin, Katzantonis, Bodet, Jestin-Depond, Uzureau, Achkar, Freneaux). Nous remercions Carine Coffre et Aurélie Avargues pour le data management et le monitoring.
Cette étude a été financée par l’Institut national du cancer (INCa) et cofinancée par la Ligue contre le cancer (comités 18, 37 et 44). Les écouvillons et les tubes contenant le milieu de transport liquide des auto-prélèvements ont été fournis gracieusement par le laboratoire Copan (Brescia, Italie).




