Collecte et utilisation des stades de cancers : problèmes posés dans les études en population
Collecting and using data on cancer stages: problems posed in population studies
Résumé
Le classement en stades d’un cancer selon son extension anatomique doit permettre une description à la fois précise et condensée de l’extension tumorale, dans le cadre de la prise en charge pluridisciplinaire et des études cliniques ; son utilisation est également indispensable dans les études épidémiologiques décrivant l’évolution de l’incidence ou de la survie des cancers.
Une bonne mesure du stade présente des difficultés dans le cas d’un enregistrement systématique en population. Ces difficultés, et les biais potentiels qui en découlent, sont illustrés par des exemples issus d’une étude sur les cancers recto-coliques diagnostiqués en 1990, réalisée par six registres français. Les problèmes posés par l’évaluation des dimensions constitutives de la classification TNM (notamment les glissements de classification) sont présentés, ainsi que les difficultés rencontrées dans la reconstitution des stades.
La complexité d’une utilisation correcte des stades en situation d’observation explique la prudence avec laquelle les résultats doivent être interprétés et la nécessité d’une standardisation de l’enregistrement du stade par les registres.
Abstract
To be of value to multidisciplinary care and clinical trials, the classification of the anatomical extension of a malignant tumour into various stages must involve stage descriptions which are both precise and concise. Such a classification is also essential in epidemiological studies to describe the evolution of cancer incidence and survival.
It is difficult to accurately evaluate cancer stage in population-based studies. These difficulties and the potential resulting biases are illustrated by findings from a study on colon cancers diagnosed in 1990 carried-out in six French registries. The problems encountered when evaluating the essential components of the TNM classification system are presented (in particular the classification shifts), as well as the difficulties met when rebuilding stages due to missing data.
Given the complexities encountered in using stage classification correctly in observational studies, results must be interpreted with caution. These findings also highlight the need for population-based registries to standardise how cancer stage is recorded.
Introduction et contexte
Le classement en stades d’un cancer selon son extension anatomique ou d’autres paramètres doit permettre une description à la fois précise et condensée de l’extension et de l’agressivité tumorale. Il a une triple finalité :
- clinique, en aidant à la planification des traitements, en donnant des indications sur le pronostic et en facilitant l'échange d'informations pour l’élaboration des référentiels ;
- de recherche, en aidant à l'évaluation du résultat des traitements, en contribuant à la cohérence des projets de recherche et en codifiant la communication des résultats ;
- de santé publique, en permettant d’évaluer l’impact de différentes politiques de santé.
Les études de l’incidence et de la survie, et notamment les études portant sur l’évolution de ces deux indicateurs ou leurs comparaisons entre régions ou pays, devraient prendre en compte le stade de la tumeur au moment du diagnostic. Toutefois, on observe que les comparaisons internationales à partir des données de registres de population incluent rarement des descriptions par stades. En effet, l’utilisation des informations sur le stade est délicate à mettre en œuvre dans le cas d’un enregistrement systématique en population. Cette difficulté tient non seulement à la quantité de données qu’il faut collecter, mais aussi au fait que l’on est en situation d’observation.
Pour permettre un classement de l’extension des tumeurs, on utilise, dans la majorité des tumeurs solides, le système TNM. Le principe du TNM 1 consiste à décrire la tumeur en fonction de trois paramètres : sa taille (T), l'envahissement ganglionnaire (N) et l'existence de métastases à distance (M). La classification est double : clinique, construite à partir des examens cliniques et paracliniques du bilan initial (TNM proprement dit), et post-chirurgicale, issue de l'examen des pièces opératoires (pTNM). Cette présentation est adaptée à la description d'un cas dans un dossier clinique, mais elle est trop détaillée pour décrire l'évolution de groupes de malades. Les catégories TNM (ou pTNM) sont donc généralement regroupées en stades (de I à IV), dont la définition est déterminée en fonction des critères pronostiques spécifiques à chaque localisation cancéreuse et varie en fonction de l’évolution des connaissances.
Malgré une volonté de simplicité, la classification en stades reste difficile à mettre en œuvre, car elle est la résultante d'un ensemble d'informations permettant de classer les différents paramètres de l'extension tumorale et car l'évaluation de ces paramètres est elle-même dépendante des explorations réalisées. L’importance des explorations, c’est-à-dire du bilan d’extension, dépend des recommandations du moment, de l’état du patient et du choix du praticien. On constate en effet une grande hétérogénéité des pratiques en fonction des zones géographiques et des modalités d’exercice. Ces différences sont encore plus critiques lorsque l’on souhaite comparer des périodes. On comprend facilement que l'amélioration des techniques d'exploration permette de mieux évaluer l'extension d'une tumeur. Ce phénomène de glissement de classifications a été décrit sous le nom de « phénomène de Will Rogers » 2 dans un travail qui montre comment l'amélioration de l’imagerie permet de mettre en évidence des métastases qui, jusque-là, passaient inaperçues. En fonction des examens réalisés, les mêmes malades peuvent être classés dans des stades plus ou moins évolués. La comparaison de taux de survie selon le stade entre deux périodes ou deux zones géographiques ayant des pratiques médicales différentes peut faire apparaître une fausse différence du pronostic.
Les problèmes de glissement de classification ne sont pas spécifiques au TNM. Ils existent aussi pour d’autres indicateurs pronostiques. Dans le cas des cancers de la prostate, on a pu observer à la fin des années 1990, sans changement des recommandations chez les anatomopathologistes, une évolution dans la façon de coder le score de Gleason. Cette évolution doit inciter à la prudence dans l’interprétation de l’amélioration du pronostic de ces tumeurs au cours du temps 3.
Les résultats du bilan doivent ensuite être collectés. Dans le cas de la France, le parcours du patient s’est souvent déroulé dans plusieurs établissements, ce qui implique de consulter différents dossiers, parfois difficilement accessibles.
L’absence d’examen, la mauvaise tenue des dossiers et la difficulté d’y accéder sont à l’origine d’un grand nombre de données manquantes ou très imprécises. La reconstitution du stade devient alors difficile et conduit à l’utilisation d’un stade simplifié (par regroupement des catégories). Ce regroupement ne fait généralement que réduire la proportion des données absentes, mais diminue la capacité discriminante du stade et son intérêt aux yeux des cliniciens.
Nous allons illustrer ces difficultés en nous appuyant sur l’exemple d’une cohorte de 1 382 cancers recto-coliques diagnostiqués en 1990 et suivis depuis par six registres de cancer.
Exemples de problèmes posés par l’évaluation des différents paramètres du TNM
Évaluation du pN : importance de la prise en compte du nombre de ganglions examinés
La validité du pN dépend du nombre de ganglions examinés. Ce nombre varie en fonction de ce qu'a pu prélever le chirurgien et de la technique utilisée par l'anatomopathologiste. Il est établi que le nombre de ganglions examinés varie avec l'âge du patient et la localisation de la tumeur. Dans notre cohorte de cancers recto-coliques, le département de résidence du patient, et donc les pratiques médicales locales, influençaient également ce nombre 4, et l'examen d'au moins 8 ganglions était nécessaire pour ne pas risquer de sous-estimer le pN. La comparaison de la survie par stade (tableau 1) confirmait ce résultat et montrait qu’il existait une différence de survie entre les cas classés stade II (donc pN0), avec moins de 8 ganglions examinés et les autres, ce qui renforçait l'hypothèse qu'une fraction non négligeable de ces tumeurs étaient en fait des stades III insuffisamment explorés pour que l’extension ganglionnaire soit correctement mesurée.
 Agrandir l'image
Agrandir l'image
L'examen d'un nombre insuffisant de ganglions provoque donc une sous-estimation des stades. La figure 1 montre la relation qui existe entre la proportion de cas ayant eu un nombre de ganglions examinés satisfaisant dans un département et le rapport nombre de stades II/nombre de stades III dans ce même département. Les stades II étaient d'autant plus nombreux dans un département que le nombre de ganglions examinés était faible.
 Agrandir l'image
Agrandir l'image
Le nombre optimal de ganglions à examiner est encore débattu. L’Union for International Cancer Control (UICC) recommande en cas de cancer colorectal l’examen de 12 ganglions 1. Une modélisation de la probabilité de « manquer » l’envahissement d’un ganglion appliquée aux données du SEER program 5 l’estimait à 30% pour 5 ganglions examinés, 20% pour 8 et 14% pour 12 ganglions. Le nombre minimal de ganglions à examiner dépendait aussi de l’extension pariétale. Ce nombre n’est pas le seul facteur de fiabilité du pN. Pour d’autres tumeurs, il faut tenir compte de l’évolution des techniques de recherche de l’envahissement ganglionnaire (par exemple pour le cancer du sein ou le mélanome, de l’utilisation de la technique du ganglion sentinelle par le chirurgien et immunohistochimie par l’anatomopathologiste).
Évaluation du M : importance de la prise en compte du bilan d'extension
L'identification d'une métastase à distance est encore plus déterminante que celle d'un envahissement ganglionnaire pour déterminer le stade. Cette information doit être obtenue en faisant la synthèse du bilan diagnostique d’un ou plusieurs dossiers, synthèse rendue difficile par l'imprécision et l’hétérogénéité des informations figurant dans ces dossiers. La construction d'un indicateur qui permettrait de prendre en compte la complétude du bilan d'extension pour juger d'une éventuelle sous-estimation de la présence de métastases est nécessaire. Si nous reprenons l’exemple précédent des cancers recto-coliques, le bilan d’extension pouvait être qualifié de complet lorsqu'il comprenait au moins un examen d'imagerie pulmonaire, un examen d'imagerie hépatique et une exploration chirurgicale du foie. Avec cette définition, le bilan diagnostique était complet dans 51% des cas, incomplet dans 21% des cas et, dans 28% des cas, les informations disponibles étaient insuffisantes pour classer le patient dans l’un ou l’autre groupe.
En comparant la survie des patients en fonction de leur bilan pour chaque stade (figure 2), on ne trouvait aucune différence pour les stades I. Pour les stades II, une mortalité supérieure semblait apparaître après la deuxième année quand le bilan était incomplet mais, compte tenu du faible nombre de décès, la différence n'était pas statistiquement significative. Les différences observées pour les stades III et IV étaient très nettes. Pour les stades III, le mauvais pronostic du groupe qui n'avait pas eu un bilan suffisant traduisait l'existence d’une sous-évaluation du stade. Pour les stades IV, les patients dont le bilan était incomplet étaient vraisemblablement ceux dont le cancer était trop évolué pour justifier des explorations poussées.
 Agrandir l'image
Agrandir l'image
Dans cette étude, la proportion de patients ayant eu un bilan considéré comme complet variait selon le département.
L’utilisation d'un indicateur de complétude du bilan comme variable d'ajustement pose des problèmes, car la fréquence des informations manquantes est élevée, rendant complexe l’utilisation de cet indicateur synthétique. L'absence d'information est difficile à interpréter. Le non-signalement d'un examen ne signifie pas sa non-réalisation, même s’il existe une tendance à davantage lister les examens faits et à omettre les examens négatifs. De plus, il existe un biais d’indication. La prescription d'examens complémentaires n'est pas toujours indépendante du pronostic a priori chez le malade. L'association entre qualité du bilan d'extension et survie serait donc autant due au fait que la nature du bilan d'extension varie avec le pronostic qu'au fait que cette variable permet d'individualiser des sujets mal classés 6.
L’identification des tumeurs classées métastatiques pose d’autres problèmes. L’ensemble du bilan devrait théoriquement être fait avant le début du traitement. C’est en partant de ce principe que le TNM définit actuellement le M 1, mais cette situation, confortable pour les épidémiologistes, ne correspond pas à la réalité. Pour de multiples raisons, notamment pour ne pas retarder la prise en charge, il est de plus en plus fréquent que traitement et bilan initial soient intriqués. De plus, il n’existe pas de définition standardisée du délai permettant de discriminer les métastases synchrones (M) des métachrones.
Problématique de la reconstitution d'un stade pronostique en épidémiologie
En pratique, l'imprécision des informations trouvées dans les dossiers oblige souvent à utiliser une catégorisation simplifiée regroupant les valeurs d’un paramètre. Par exemple, afin de pouvoir analyser les données à des fins épidémiologiques, une version simplifiée du T est recommandée par le réseau européen des registres de cancers. Elle résume l'extension locale en deux niveaux seulement : localisé ou évolué. Parfois, les deux dimensions, cliniques et anatomopathologiques, sont utilisées de façon complémentaire 6.
Pour minimiser l’impact des informations manquantes, qui restent fréquentes, la règle de codage a minima est recommandée dans le TNM. Cette règle stipule qu'en cas d'information absente, c'est le stade le plus bas qui doit être codé 7. Cette règle pose des problèmes dans les études pronostiques, car elle conduit à sous-estimer la survie par groupe. Pour illustrer cette sous-estimation, nous utilisons à nouveau la cohorte des cancers colorectaux.
En fonction des informations fournies sur les trois dimensions du TNM, le stade a été calculé de trois façons différentes :
- de façon minimale (règle TNM), toute information absente est considérée comme négative (sauf les cas où l'on ne dispose d'aucune information, codés en inconnu) ;
- de façon maximale, toute information absente est considérée comme positive (sauf les cas pT 1 ou 2, pN0 ou pN ?, M ? et des cas sans aucune information, codés en inconnu) ;
- de façon prudente, toute information absente conduit à ne pas évaluer le stade, sauf si une information de niveau supérieur existe.
Pour les données que nous étudions, ces trois choix aboutissaient aux trois répartitions par stades figurant dans le tableau 2.
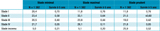 Agrandir l'image
Agrandir l'image
La définition minimale du stade conduisait à des estimations de survie par groupes toujours inférieures (sauf pour les stades inconnus) à celles de codage maximal. Cette différence était attendue puisque le stade était systématiquement minimisé dans le premier groupe, ce qui provoquait l'inclusion dans chaque stade de cas qui auraient dû appartenir à un stade supérieur. La définition prudente donnait des résultats intermédiaires, sauf pour les stades inconnus qui étaient très nombreux dans ce groupe et qui avaient toujours une meilleure survie que le même groupe dans les autres classifications.
Les résultats d’une analyse multivariée comparant des groupes pour lesquels différentes règles de codage auraient été utilisées, seraient biaisés comme le montre le modèle de Cox présenté au tableau 3. Le même groupe de malades a été utilisé trois fois pour construire un fichier composé de trois groupes ayant les trois modes de codage différent. Ils avaient évidemment la même survie puisque composés des mêmes sujets, mais l'introduction du stade dans le modèle faisait baisser de façon importante la valeur des risques relatifs des groupes codés de façon maximale ou prudente par rapport au groupe ayant un codage de type minimal, choisi ici comme référence.
 Agrandir l'image
Agrandir l'image
Il est évident que, pour minimiser ce type de problème, une reconstruction centralisée du stade à partir de ces dimensions constitutives (T, N et M) est recommandée. Toutefois, une centralisation ou un algorithme commun ne résoudra pas les problèmes liés à une variabilité des données absentes. Le groupe des cancers de stade inconnu se compose des cas n'ayant pas été explorés (voire pas opérés), pour lesquels l’absence d’information n’est pas un hasard (biais d’indication), et des cas pour lesquels l'information n'a pas été retrouvée ou perdue, bien qu'elle ait existé. Ce groupe de cas a un pronostic moyen, car l’absence de données tient à d’autres causes que la gravité de la maladie (perte des archives, mauvaise tenue des dossiers, travail de recherche insuffisant). En reprenant l’exemple des cancers colorectaux, lorsque l'on compare les survies des cas de stade inconnu par tranche d’âge en fonction de l'importance de ce groupe (figure 3), on observe une survie qui diminue à mesure que la proportion de cas de stade inconnu augmente. Plus les patients sont âgés, plus leur pronostic est mauvais et plus les explorations complémentaires sont réduites. En revanche, la même comparaison en fonction des départements montre une amélioration de la survie avec l'augmentation de la fréquence des stades inconnus. La fraction des cas graves peu explorés est la même quel que soit le département ; en revanche, la proportion de stades inconnus car l’information n’a pas été retrouvée augmente, ce qui améliore le pronostic du groupe. La qualité de la récupération des informations va ainsi fausser les comparaisons de la survie entre départements. La prise en compte du stade risque d'abaisser artificiellement la survie dans les départements pour lesquels les données absentes sont plus rares. Toute étude comparant des sous-groupes où la qualité et la disponibilité des informations peuvent varier (zones géographiques, périodes, types de populations) sera exposée à ces biais.
 Agrandir l'image
Agrandir l'image
Discussion
La classification des tumeurs en stades a pour objectif de créer des groupes de cancers ayant un état d’avancement au diagnostic semblable et un pronostic a priori homogène, afin de servir d'élément de stratification ou d’ajustement dans les études pronostiques ou dans les comparaisons d’incidence. Son utilisation semble incontournable, mais elle se heurte à des difficultés importantes dès que l'on ne se situe plus dans des essais thérapeutiques où l'ensemble des interventions, y compris les gestes diagnostiques, sont strictement définis.
Dans les études en population réalisées par des registres, l'utilisation du stade est plus difficile. Pour minimiser les biais liés à la constitution du stade, il est important de disposer de ses dimensions constitutives (T, N et M) afin de s’assurer d’une codification identique. Il est évident que pour réduire ce type de problème, une reconstruction du stade, centralisée ou faite par un algorithme commun à partir de ces dimensions constitutives (T, N et M), est recommandée.
Le problème du glissement de classification peut être minimisé ; toutefois, tenter de collecter des informations sur les examens réalisés afin d'ajuster le stade sur le niveau d'exploration auquel a été soumis le malade peut se révéler assez difficile et à terme, inefficace, voire relativement dangereux, quand les données contiennent trop d'informations manquantes. Un enregistrement détaillé ne peut être réalisé sur l’ensemble des cas. En revanche, concentrer les efforts de collecte sur un échantillon représentatif est la meilleure solution dans un contexte de limitation des moyens. C’est dans cette logique que les registres français ont commencé en 2009, dans le cadre du plan cancer, à enregistrer des informations plus détaillées sur des échantillons de certains cancers, afin de pouvoir fournir des données fiables par stades, notamment pour les cancers soumis au dépistage.
Conclusion
La publication régulière d’indicateurs d’incidence ou de survie, de même que la description des pratiques de soins en fonction du stade, dans des études nationales ou internationales (par exemple les programmes EUROCARE haute résolution ou CONCORD 2) est indispensable, car de telles études apportent des informations essentielles à l’élaboration de stratégies adaptées de lutte contre les cancers. Les difficultés qui viennent d’être présentées ne doivent pas être un obstacle à de telles études, mais ces dernières doivent apporter des garanties en termes de comparabilité des données et être interprétées avec prudence. La multiplication des échanges entre les différents registres en Europe et la mise en place de procédures communes permettent une amélioration régulière de la qualité et de la standardisation des données concernant le stade d’extension. L’ensemble des registres français s’inscrit dans cette dynamique de procédure-qualité de leurs pratiques d’enregistrement des stades.




