Survie nette : concept, estimation et illustration à partir des résultats de la dernière étude du réseau Francim
Net survival : concept, estimation and illustration using results from the last FRANCIM study
Résumé
Le programme partenarial pour la surveillance épidémiologique des cancers comporte la production régulière d’indicateurs épidémiologiques. À ce titre, une étude visant à estimer la survie des personnes atteintes de cancer en France est produite tous les cinq ans à partir des données des registres français des cancers (réseau Francim).
Dans le contexte des études de survie menées en population, il est d’usage de publier des estimations de survie globale et de survie nette (autrefois nommée « survie relative »). La survie nette est la survie qui serait observée si la seule cause de décès possible était le cancer étudié. Elle se situe donc dans un cadre qui ne correspond pas à la réalité mais, en s’affranchissant des différences de mortalité dues à d'autres causes que le cancer, elle permet des comparaisons entre pays et périodes.
Des développements méthodologiques récents ont amélioré la qualité de l’estimation de la survie nette. Ils ont été utilisés pour l’analyse de la dernière étude de survie menée sur les données Francim, publiée en 2013. Cet article précise le concept de survie nette et le cadre de son estimation statistique, et discute quelques résultats issus de cette dernière étude.
Abstract
The National Partnership Program for cancer epidemiological surveillance includes the regular production of epidemiological indicators. In this respect, studies estimating cancer survival are produced every five years using data from the French cancer registries network (FRANCIM).
Population studies usually report estimations of observed global survival and net survival (formerly called “relative survival”). Net survival is the survival that would be observed if cancer were the only cause of death. It is therefore defined within a hypothetical context. However, by removing the effect of death from causes other than cancer, net survival allows us to compare cancer survival between periods and between countries, which is not possible with observed survival.
Recent methodological developments have improved the quality of survival estimations. These developments were applied in the analysis of the latest FRANCIM net survival study, published in 2013. This article aims to clarify the concept of net survival, to specify the scope of its statistical estimation, and to comment on some results of the FRANCIM study.
Introduction
Le programme partenarial pour la surveillance épidémiologique des cancers comporte, dans ses objectifs, la production régulière d’indicateurs épidémiologiques. À ce titre, une étude visant à estimer la survie des personnes atteintes de cancer en France est produite tous les cinq ans à partir des données des registres français des cancers (réseau Francim). La dernière étude française a été publiée en 2013 1,2,3. L’analyse portait sur 427 000 tumeurs diagnostiquées entre 1989 et 2004 (avec un suivi jusqu’au 31/12/2007) chez les patients âgés de plus de 15 ans, dans 12 départements couverts par les registres participant à l’étude. Des estimations de survie globale et de survie nette à 1, 3, 5 et 10 ans après un diagnostic de cancer, par âge, sexe et période - standardisées pour l’âge selon le standard ICSS 4 par sexe et par période - ont été fournies pour 47 localisations cancéreuses tous stades confondus. Pour la première fois, un certain nombre de sous-types d’hémopathies malignes ont pu être analysés 2. Outre la survie nette, l’étude rapportait la dynamique du taux de mortalité en excès en fonction du temps écoulé depuis le diagnostic.
Dans le contexte d’une telle étude de survie populationnelle, il est d’usage de publier des estimations de survie globale d’une part, et de survie nette d’autre part (autrefois nommée « survie relative »). L’objectif de cet article est 1) de préciser le concept de survie nette et de clarifier l’usage qui peut en être fait, 2) de rapporter les développements récents qui ont été faits dans le cadre de son estimation et 3) de commenter et d’illustrer quelques résultats de cette dernière étude française.
Le concept de survie nette
La survie globale à 5 ou à 10 ans correspond à la proportion de patients survivants 5 ou 10 ans après la date de diagnostic, quelle que soit la cause possible du décès (cancer ou autre cause). La survie globale est simple à interpréter ; cependant, elle ne reflète pas la mortalité associée à la maladie car tous les décès sont comptabilisés, qu’ils soient ou non liés à la maladie.
La survie nette est définie comme la survie qui serait observée si la seule cause de décès possible était le cancer étudié. Cette survie, à supposer qu’on sache l’estimer, n’est pas influencée par les décès non liés au cancer ; elle reflète donc bien la seule mortalité associée au cancer. Il faut noter que cette association peut être directe ou indirecte : par exemple, les décès liés au traitement sont ainsi « intégrés » à la mortalité associée au cancer (même si, comme nous le verrons plus loin, la cause de décès n’est pas nécessaire pour estimer la survie nette). La survie nette est un indicateur défini dans un monde hypothétique mais, en s’affranchissant des éventuelles différences de mortalité dues à d'autres causes que le cancer, il est le seul indicateur de survie utilisable à des fins de comparaison. Pour illustrer et clarifier ce point, nous présentons ci-dessous deux exemples fictifs (dans le domaine des études populationnelles, les comparaisons sont généralement faites entre pays, entre périodes de diagnostic ou entre âges).
Exemple fictif 1
On souhaite comparer la mortalité associée au cancer entre personnes jeunes et personnes âgées. Les données du tableau 1 montrent que la survie globale est très différente : les personnes âgées décèdent du cancer mais aussi d’autres causes liées à l’âge (maladies cardiovasculaires, notamment). Il n’est donc pas possible, en comparant ces chiffres, de répondre à la question posée. La survie nette, elle, permet d’y répondre. En effet, la survie nette est identique dans les deux groupes, ce qui signifie que, dans cet exemple fictif, la mortalité associée au cancer est identique entre patients jeunes et âgés.
 Agrandir l'image
Agrandir l'image
Exemple fictif 2
On souhaite savoir si la mortalité associée au cancer est plus élevée lorsque le diagnostic de cancer a été effectué en 1990 ou en 2000 (en d’autres termes, si la survie nette a augmenté entre ces deux années). Les données du tableau 2 montrent que la survie globale est différente et qu'elle s’est améliorée entre 1990 et 2000. Est-ce lié à la diminution de la mortalité par cancer ? À la diminution de la mortalité d'autres causes ? Aux deux phénomènes ? Il n’est pas possible, en comparant ces deux valeurs de survie globale, de répondre à la question. De même que dans l’exemple 1, seule la survie nette permet de répondre à la question. En effet, la survie nette s’est améliorée entre les deux années, ce qui signifie, dans cet exemple fictif, que la mortalité associée au cancer était plus élevée en 1990 qu’en 2000.
 Agrandir l'image
Agrandir l'image
Estimation de la survie nette : une nouvelle méthode
Nous avons évoqué plus haut la notion de mortalité associée au cancer. Cette expression laisse supposer que l’information sur la cause de décès est disponible, ce qui n’est pas le cas dans les études de survie menées en population. Cette information est généralement recueillie dans les études cliniques (la survie nette est alors estimée par la survie dite « spécifique »), mais la qualité, la fiabilité et la pertinence de cette information ont des limites vite atteintes chez les sujets âgés et sur le long terme. La méthode d’estimation utilisée dans cette étude ne requiert donc pas la connaissance de la cause de décès et ne présente en cela aucune particularité par rapport aux méthodes utilisées jusqu’alors pour estimer la survie nette à partir de données de registres de cancers (méthodes dites de « survie relative »). La survie nette est en effet estimée à partir de la « mortalité en excès », qui est obtenue par la différence entre : (i) la mortalité observée dans la population des personnes atteintes de cancer de l’étude, toutes causes de décès confondues, et (ii) la mortalité due à d'autres causes que le cancer dans cette même population. Cette dernière mortalité est supposée être correctement reflétée par la mortalité « toutes causes » de la population générale en France obtenue à partir des tables de mortalité fournies par l’Insee (tables présentées par sexe, âge, année et département). Notons que la mortalité « toutes causes » inclut les décès liés au cancer étudié, mais que ces décès représentent une part négligeable de la mortalité « toutes causes » et sont donc sans conséquence sur les estimations, en dehors de très rares situations.
Les estimations fournies dans la dernière étude de survie du réseau Francim reposent sur l’utilisation d’une nouvelle méthode d’estimation de la survie nette proposée par Pohar-Perme en 2012 5. Cette méthode fournit de meilleures estimations de la survie nette que les méthodes de survie relative classiques (« meilleures » dans le sens où elles sont « non biaisées »). Ce résultat a été établi de façon formelle par Pohar-Perme et coll. 5 et a été confirmé par divers travaux réalisés par le Service de biostatistique des Hospices civils de Lyon 6,7 dans le cadre d’une étude collaborative internationale soutenue par l’Agence nationale de la recherche (Méthodes d’estimation de la survie relative – Groupe Mesure – coordination : Pr. Roch Giorgi). Ces travaux ont montré que les méthodes de survie relative classiquement utilisées surestiment en général la survie nette. Le mécanisme responsable de ce biais est la censure informative exercée par la mortalité due aux autres causes.
D’un point de vue théorique, il y a censure informative lorsqu'il existe des facteurs qui influencent à la fois la mortalité associée au cancer et la mortalité due aux autres causes, créant ainsi une dépendance entre ces deux mortalités. Ainsi, un décès dû à une autre cause empêche (i.e., censure) l’observation d’un décès associé au cancer, et ceci de façon non aléatoire (i.e., de façon informative) car les personnes les plus à risque de décéder du cancer sont aussi les personnes les plus censurées (du fait de la dépendance évoquée ci-dessus). Les tables de mortalité sont définies selon quatre variables démographiques: le sexe, l’âge, l’année et le département (ce qui veut dire que ces quatre facteurs ont un effet sur la mortalité due aux autres causes) ; en conséquence, il y a censure informative lorsque l’un de ces quatre facteurs a aussi un effet sur la mortalité associée au cancer (en pratique, l’âge exerce cet effet pour la quasi-totalité des cancers).
Les méthodes de survie relative classiquement utilisées sont incapables de prendre en compte cette censure informative et, comme déjà indiqué, surestiment la survie nette. Cette surestimation est d’autant plus importante que la part de la mortalité liée aux autres causes est importante par rapport à la part de la mortalité liée au cancer. En conséquence, les estimations chez les personnes âgées, pour un suivi à long terme (10 ans après le diagnostic) et pour les cancers de bon pronostic, sont particulièrement impactées. Ces travaux ont également montré que, pour le moment, seules deux méthodes sont capables de fournir des estimations non biaisées de la survie nette. La première méthode est paramétrique ; elle repose sur la modélisation multivariée du taux en excès qui prend en compte l’ensemble des variables susceptibles d'engendrer une censure informative (i.e., l’ensemble des variables démographiques définissant les tables de mortalité). La seconde méthode est non paramétrique ; c'est la méthode de Pohar-Perme, qui corrige le biais en appliquant le principe de pondération par l’inverse de la probabilité de survie attendue 5. Cette dernière méthode présente des avantages certains en matière de mise en œuvre (il n’est pas nécessaire de spécifier un modèle multivarié complexe) et a donc été adoptée pour cette nouvelle étude française. Cette méthode devrait devenir, dans un futur très proche, la référence internationale pour les études de survie populationnelles.
Résultats
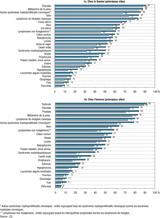
Estimations standardisées de survie à 5 et 10 ans pour les principales localisations
Les estimations de survie à 5 et à 10 ans standardisées pour l’âge selon le standard ICSS (International Cancer Survival Standards) 4 sont fournies pour les principales localisations chez la femme et l’homme en figure 1a et figure 1b respectivement. Pour les tumeurs solides, comme pour les hémopathies, les résultats de l’étude confirment une disparité considérable de la survie entre les différentes localisations. Plusieurs cancers de très mauvais pronostic (poumon, œsophage, foie et, dans une moindre mesure, hypopharynx) sont beaucoup plus fréquents chez les hommes que chez les femmes. En revanche, les femmes présentent une incidence plus élevée de certains cancers de bon pronostic (le cancer du sein, évidemment, mais aussi le cancer de la thyroïde). Par ailleurs, pour un même cancer, les femmes ont généralement un meilleur pronostic que les hommes (la seule exception étant le cancer de la vessie). Cette observation est souvent expliquée par une plus grande précocité des diagnostics chez les femmes, plus sensibilisées à la prévention et au dépistage. Cette explication n’est cependant pas vérifiable en l’absence de données sur les stades des cancers et une éventuelle différence de distribution de ces stades en fonction du sexe. Pour les cancers de la sphère ORL, la différence est importante et peut s’expliquer partiellement par une proportion de cas liés au tabac et à l’alcool - de mauvais pronostic - encore actuellement plus forte chez les hommes. Par ailleurs, un biais lié au calcul de la survie nette peut exister pour ces cancers liés au tabac et à l’alcool, différent de celui évoqué dans le paragraphe précédent, et ne relevant pas d’une censure informative. En effet, la mortalité de la population générale ne reflète probablement pas, dans ce cas, la mortalité due aux autres causes, cette dernière étant plus élevée chez ces patients (l'alcool et le tabac provoquant d’autres maladies). La mortalité due aux autres causes étant donc sous-évaluée, la mortalité en excès s’en trouve surestimée et la survie nette sous-estimée.
 Agrandir l'image
Agrandir l'image
Mortalité en excès
L’observation de la mortalité en excès subie par les patients au fur et à mesure que l’on s’éloigne du diagnostic montre que le risque de décéder du cancer est généralement plus élevé pendant la première année, puis a tendance à décroître. Chez les patients âgés, cette allure de la courbe de la mortalité en excès se rencontre dans quasiment tous les cancers : même si les niveaux de risque initiaux sont très variables d’un cancer à l’autre, c’est immédiatement après le diagnostic que le risque est le plus élevé (voir, par exemple, le cas du cancer colorectal, figure 2). C’est souvent cette mortalité initiale élevée qui explique le plus mauvais pronostic des patients âgés. Pour les sujets les plus jeunes, l’excès de mortalité le plus important ne se présente généralement pas au cours de la phase initiale mais plus de six mois après le diagnostic, et parfois plus tard. Ce phénomène s’observe notamment pour les localisations ORL, les cancers du poumon, du col utérin, du sein (figure 3), de la prostate, de la vessie, pour les tumeurs du système nerveux central, pour les sarcomes et pour plusieurs hémopathies malignes. Il existe probablement des explications multiples et complémentaires aux différences de profil de surmortalité entre patients âgés et patients jeunes. Ce phénomène peut être en partie dû à des stades au diagnostic plus évolués chez les sujets âgés, mais aussi à une moindre tolérance aux traitements intensifs chez ces patients plus fragiles, ou encore (plus probablement) à la prise en compte a priori de cette moindre tolérance qui conduit à proposer des traitements moins intensifs, donc mieux tolérés, mais parfois moins efficaces.
 Agrandir l'image
Agrandir l'image
 Agrandir l'image
Agrandir l'image
Évolution de la survie nette à 5 ans
Cette étude montre, entre 1989 et 2004, une augmentation de la survie nette à 5 ans (standardisée pour l’âge) pour la plupart des cancers. La plus spectaculaire augmentation est celle observée pour les cancers de la prostate (71% à 90%) dont un mécanisme essentiel est une anticipation majeure des diagnostics du fait du dépistage individuel par le dosage sanguin du PSA. L’amélioration de la survie est donc due à la fois à une augmentation de la durée d’observation de la maladie (due à l’avance au diagnostic) et à une prise en charge précoce dont on attend une plus grande efficacité. Un mécanisme analogue explique l’amélioration du pronostic d’autres cancers comme ceux du sein (80% à 87%), de la thyroïde (86% à 94%, survie non standardisée), du rein (59% à 68% chez la femme, 59% à 70% chez l’homme), du côlon-rectum (56% à 61% chez la femme, 53% à 58% chez l’homme). Il est à présent bien reconnu que l’anticipation du diagnostic s’accompagne parfois d’un risque de surdiagnostic et de surtraitement, notamment pour le cancer de la prostate 8.
Les progrès de la prise en charge thérapeutique jouent aussi très probablement un rôle dans l’amélioration observée. Mais, en l’absence de prise en compte du stade du cancer dans l’analyse, la part de chacun de ces deux facteurs (anticipation du diagnostic et progrès thérapeutiques) ne peut être mise en évidence dans cette étude. Dans certains cas précis, on peut raisonnablement penser que les progrès thérapeutiques sont la cause essentielle de l’évolution de la survie, notamment pour certaines hémopathies malignes ayant bénéficié de nouvelles chimiothérapies, ou des traitements ciblés de cancers comme la leucémie myéloïde chronique pour laquelle une amélioration spectaculaire de la survie a été observée durant la période d’étude (1989-2004). L’existence d’un dépistage efficace peut avoir des conséquences paradoxales sur la survie. C’est le cas des cancers du col utérin : le dépistage par frottis permet le diagnostic de lésions invasives à un stade précoce et surtout de lésions au stade de néoplasies intra-épithéliales de haut grade ou de carcinomes in situ. Les cancers diagnostiqués au stade invasif sont alors moins nombreux, mais comportent une proportion plus importante de cancers de mauvais pronostic : cancers non dépistés ou cancers diagnostiqués chez des femmes qui n'ont pas participé au dépistage. Ceci induit une baisse de la survie nette pour les cancers invasifs diagnostiqués (68% à 63%).
Il faut aussi évoquer un autre mécanisme qui permet d’expliquer des changements de la survie. Il s’agit d’un biais lié aux changements de définition ou des critères d’enregistrement des maladies durant la période d’étude. En effet, l’évolution des définitions conduit parfois à sélectionner, dans certains groupes, les cas de meilleur ou de plus mauvais pronostic, faisant ainsi évoluer la survie de ces groupes dans un sens ou dans l’autre. C’est probablement ce qui est à l’origine de la diminution de la survie nette observée pour les syndromes myélodysplasiques ou les cancers de la vessie.
Conclusion
Dans le cadre de l’épidémiologie descriptive des cancers, la survie nette représente un indicateur important. Il rend compte de la mortalité associée au cancer. Il permet de faire des comparaisons entre périodes ou entre pays, ce que n’autorise pas la survie globale. Une nouvelle méthode d’estimation est récemment apparue, supérieure aux anciennes. Cette méthode va très bientôt devenir la référence internationale pour les études de survie populationnelles. Elle a été mise en œuvre pour l’analyse de la dernière étude Francim, qui portait sur une période assez longue (patients diagnostiqués entre 1989 et 2004). L’évolution de la survie nette à long terme dans le temps a donc pu être décrite. Les résultats sont encourageants, mais cette évolution doit, pour chaque cancer, être interprétée prudemment et en regard des différents mécanismes pouvant allonger la survie.
Remerciements
Les auteurs remercient l’Institut de veille sanitaire, l’Institut national du cancer et l’Agence nationale pour la recherche (projet « Mesure » ANR-09-BLAN-0357-01). Ils remercient également Jean Iwaz pour sa relecture attentive.




