Cohorte Elena : étude transdisciplinaire des déterminants des troubles du spectre de l’autisme
// ELENA cohort: Trans-disciplinary study of the determinants of Autism Spectrum Disorders
* Consortium Elena : Pr Amaria Baghdadli, Dr Catherine Chabaux, Dr Clarisse Chatel, Pr David Cohen, Dr Emmanuel Damville, Dr Marie-Maude Geoffray, Pr Ludovic Gicquel, Pr Renaud Jardri, Dr Thierry Maffre, Dr Alexandre Novo, Dr Roxane Odoyer, Dr Marie-Joëlle Oreve, Dr Didier Périsse, Pr François Poinso, Dr Julien Pottelette, Dr Laurence Robel, Pr Catherine Rolland, Dr Marie Schoenberger, Dr Sylvie Serret, Dr Sandrine Sonié, Pr Mario Speranza et Dr Stéphanie Vespirini.
Résumé
Le trouble du spectre de l’autisme (TSA) est un trouble fréquent et chronique du neuro-développement à l’étiologie multifactorielle. Il se caractérise par une forte hétérogénéité des présentations cliniques et des évolutions. Les facteurs liés à sa sévérité sont peu connus, en raison notamment de la rareté des bases de données multidimensionnelles portant sur des cas rigoureusement établis. La cohorte Elena a permis le recrutement, de 2013 à 2019, de 900 enfants ayant un diagnostic formel de TSA dont le suivi sera effectué durant six années et s’achèvera donc en 2025. L’objectif principal est d’étudier les trajectoires évolutives de ces enfants et d’en explorer les déterminants grâce à un recueil de données large portant sur des variables cliniques, psychologiques, sociales, biologiques et environnementales. Cet article décrit la méthode, les résultats préliminaires, les perspectives et les retombées attendues de notre projet.
Abstract
Autism Spectrum Disorder (ASD) is a prevalent and chronic neurodevelopmental disorder with a multifactorial etiology. It is characterized by a strong heterogeneity of clinical presentations and outcomes. Factors related to the severity of ASD are poorly known, in part because of the paucity of multidimensional databases with rigorously established cases. The ELENA cohort has enabled the recruitment, from 2013 to 2019, of 900 children with a formal diagnosis of ASD, whose follow-up will be carried out over six years and will therefore end in 2025. The main objective is to study the outcome trajectories of these children and their determinants through a broad data collection of clinical, psychological, social, biological, and environmental variables. This article describes the objectives, method, preliminary results and perspectives of our project.
Introduction
Le trouble du spectre de l’autisme (TSA) se caractérise par l’association de perturbations de la communication sociale et de profils de comportements stéréotypés et répétitifs 1. Après avoir longtemps été considéré comme une maladie rare, le TSA est actuellement considéré comme une condition fréquente dont la prévalence est estimée autour de 1% en population générale et jusqu’à 20% dans les fratries d’enfants autistes 2. Ce syndrome neuro-développemental précoce se caractérise aussi par sa grande hétérogénéité clinique retrouvée au cours de l’évolution, avec toutefois beaucoup de formes sévères 3,4,5,6,7. Précocité, sévérité et chronicité font du TSA un problème important aux plans de la santé publique et de la société.
Les facteurs pronostiques du TSA sont peu connus. L’association d’une déficience intellectuelle est présentée dans la littérature
comme la principale variable contribuant à un mauvais pronostic. Elle n’explique qu’une part faible de la variance évolutive,
suggérant la nécessité de rechercher d’autres facteurs dans différents domaines de la santé, du développement et de l’environnement
de l’enfant 3,4,5,6,7. Le consensus actuel est en effet que la sévérité du TSA est déterminée par de nombreux facteurs dont la compréhension requiert
une approche interdisciplinaire. L’héritabilité élevée retrouvée dans l’autisme, autour de 83% 8, n’exclut pas l’implication de stresseurs de l’environnement susceptibles d’interagir avec le terrain génétique via notamment des mécanismes épigénétiques pour influencer le neuro-développement, en particulier lors de périodes sensibles
prénatales et postnatales précoces 9. La limite dans l’identification de ces facteurs est la rareté au plan international des grandes bases de données multidimensionnelles
issues du suivi de populations de jeunes patients autistes au diagnostic rigoureusement établi. En France, les grandes cohortes
pédiatriques en santé telles que l’Étude longitudinale française depuis l’enfance
(Elfe) 10, en population générale, ou l’Étude épidémiologique sur les petits âges gestationnels
(Epipage) 11,12, en population d’enfants prématurés, ne ciblent pas spécifiquement l’étude du TSA, pour lequel elles proposent uniquement
un dépistage avec la Check List for Autism Disorders (CHAT) à 36 mois. Elles ne permettent donc pas de disposer d’éléments probants sur les trajectoires évolutives des enfants
autistes ni d’étudier le rôle de leurs environnements sur ces trajectoires.
L’étude Epited (étude longitudinale sur des jeunes adultes atteints d’autisme) 6, cohorte prospective constituée à la fin des années 90, a concerné 106 individus avec TSA suivis durant 15 ans. Ses résultats traduisent l’existence de deux types de trajectoires évolutives (l’une donnant lieu à une compensation des difficultés développementales et l’autre à leur maintien) liées aux niveaux d’intelligence et de langage observés dans l’enfance, ces variables n’expliquant toutefois qu’une part modérée de variance de l’évolution. En effet, de nombreux autres facteurs n’ont pu être explorés du fait d’un nombre limité de données recueillies pour cette étude et du faible échantillon. Dans ce contexte, l’enjeu a été la mise en place d’une nouvelle cohorte prospective portant sur un échantillon plus important d’enfants autistes pour lesquels un recueil de données large serait effectué.
Dans cet article, nous décrivons les objectifs, la méthode, les résultats préliminaires et les perspectives de la cohorte Elena dans laquelle ont été recrutés 900 enfants ayant un diagnostic confirmé de TSA. Ce protocole est décrit de façon plus complète dans une revue internationale 13.
Objectifs
Les objectifs scientifiques principaux de l’étude sont d’identifier d’une part, les phénotypes et trajectoires développementales du TSA et, d’autre part, leurs déterminants aux plans clinique, biologique et environnemental. Les objectifs secondaires sont tout d’abord d’évaluer, grâce à un appariement des données de la cohorte Elena à celles du Système national des données de santé (SNDS), d’une part la typologie des parcours de soins des enfants avec TSA en fonction de leurs caractéristiques et, d’autre part, la prévalence du TSA au moyen d’un algorithme d’identification du TSA préalablement validé à partir des données de la cohorte Elena. Il s’agit aussi de décrire les caractéristiques psychosociales des parents et celles des fratries d’enfants ayant un TSA.
Ces objectifs sont actuellement structurés au sein de plusieurs Work-packages (WP): WP1 – mise en place et gestion des biobanques et bases de données ; WP2 – phénotype clinique ; WP3 – expositions environnementales (pollution, pesticides, nutrition, gradient social) ; WP4 – études génétiques et épigénétiques ; WP 5 – parcours de soin ; WP6 – dissémination des résultats.
Méthode
Recrutement
Le recrutement a été effectué à partir de 13 centres répartis dans neuf régions de France métropolitaine (1), de janvier 2013 au 31 décembre 2019. Ces centres sont des centres de ressources autisme (CRA) ou bien des équipes hospitalières spécialisées qui reçoivent habituellement pour des bilans cliniques multidisciplinaires des enfants adressés par leur médecin généraliste ou spécialiste pour suspicion de troubles du développement.
Inclusion
Elle a été proposée par un médecin investigateur au décours de l’annonce diagnostique aux parents d’enfants âgés de 2 à 16 ans lorsqu’un diagnostic de TSA était confirmé selon le DSM-5 (5e édition du Diagnostic and Statistical Manual of Mental Disorders) 1 à l’issue de bilans multidisciplinaires comportant au minimum l’Autism Diagnosis Interview-Revised (ADI-R) 14, l’Autism Diagnosis Observation Schedule version 2 (ADOS 2) 15, un bilan psychométrique et la passation de l’échelle Vineland II 16. L’inclusion était confirmée en cas d’accord signé par au moins l’un des parents. Il n’y avait pas de critère d’exclusion, en dehors d’un niveau de lecture ou de compréhension insuffisant du français de la part des parents.
Recueil de données
Le recueil des données est multidimensionnel puisqu’il porte sur des données à la fois médicale, comportementale, développementale et environnementale (niveau social et expositions aux contaminants tels que la pollution de l’air et les pesticides). Il fait appel à des outils et des procédures validés (tableau 1). Il recouvre des mesures directes par des professionnels spécifiquement formés et supervisés (observations, tests) et indirectes (questionnaires saisis à distance par les parents des participants dans une base spécifique).
Protocole de suivi
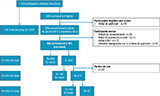
Les enfants bénéficient d’un suivi de six années comportant les cinq points de recueil suivants: V0 (inclusion) ; V1 (V0+18 mois) ; V2 (V0+36 mois) ; V3 (V0+54 mois) et V4 (V0+72 mois). Le suivi comporte des visites dans les centres (V0, V2 et V4), des interviews téléphoniques des parents (V1) et des questionnaires parentaux remplis sur internet (V0, V1, V2, V3 et V4) (figure 1).
Critères d’évaluation
Critère principal
Il concerne les comportements adaptatifs de l’enfant évalué avec l’échelle de Vineland II (VABS II) 16 utilisable chez des enfants de tous âges et tous niveaux de développement, y compris ceux se prêtant avec difficulté à une évaluation. L’échelle de Vineland permet de calculer des scores dans trois domaines importants du fonctionnement de l’enfant (communication, socialisation et autonomie), qui sont très corrélés à son niveau intellectuel général.
Critères secondaires
–Mesures cliniques concernant l’enfant : sévérité du TSA, quotient intellectuel, niveau de langage, troubles comportementaux, qualité de vie, comorbidités psychiatriques et neuro-développementales, profil sensoriel.
–Mesures psychosociales concernant les parents : symptômes anxio-dépressifs, coping, stress, qualité de vie.
–Mesures cliniques concernant les fratries : phénotype d’autisme élargi et comorbidités psychiatriques et neuro-développementales.
–Données médicales concernant l’enfant : antécédents médicaux (neurologiques, génétiques et périnataux) et développement (âge parental, grossesse, accouchement, développement psychomoteur), résultats d’examens complémentaires (EEG, IRM cérébrale, ECG, ETT) et d’analyses génétiques déjà effectuées dans le cadre des soins courants.
–Mesures d’expositions environnementales rétrospectives : historique résidentiel, description du logement durant la grossesse (superficie, exposition au bruit, qualité de l’air), usages de pesticides domestiques et mode de vie de la mère pendant la grossesse (régime alimentaire, produits de soins…), expositions professionnelles des deux parents.
–Prélèvements sanguins pour des tests génétiques et prélèvement de selles pour l’étude du microbiote (pour une partie de la cohorte pour des contraintes financières).
–Parcours de soins : exposition à des médicaments pendant la grossesse, consommations de soins (milieu hospitalier et libéral) et de médicaments.
Gestion des données
La saisie des données est effectuée électroniquement grâce à un eCRF (electronic Case Report Form) développé à l’aide du logiciel d’Ennov Clinical pour les mesures directes et un eCRF parental développé par Epiconcept grâce à l’application Voozanoo pour les mesures indirectes renseignées par les parents. Ces données hébergées par un data center agréé font l’objet de vérifications régulières et de corrections assurées par un data manager et un attaché de recherche clinique. Des contrôles sont effectués à la saisie et à postériori, avec un retour aux dossiers sources en cas d’incohérences.
Éthique et réglementation
Cette étude a reçu l’accord du Comité de protection des personnes (CPP) Sud Méditerranée 1 le 8 octobre 2014 (référence interne 14 75) et de la Commission nationale de l’informatique et des libertés (Cnil) le 7 juillet 2015 (demande d’autorisation n°914281).
Résultats
Les données étant encore en cours de recueil, les résultats portent sur une extraction partielle de la base réalisée le 1er novembre 2018.
Inclusions effectuées
La cohorte Elena est une cohorte ouverte, prospective et multicentrique ayant pour promoteur le CHU de Montpellier également coordonnateur de la cohorte Epited. Au 31 décembre 2019, environ 900 enfants avec un diagnostic confirmé de TSA ont été inclus à partir de 13 centres dans 9 régions pour un suivi prévu sur 6 années (figure 2)
Des caractéristiques à l’inclusion très hétérogènes
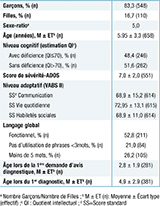
Cinq-cent-quarante-huit (83,3%) des participants sont des garçons et 110 des filles (16,7%). L’âge est de 5,95 ans en moyenne (écart-type, ET : ± 3,3), avec une étendue allant de 2 à 16,5 ans. Le quotient intellectuel moyen des enfants est de 71 ± 27,4 dans l’échantillon total, ce qui implique que 30,9% des enfants ont une déficience intellectuelle sévère ou modérée (QI<55) et 69,9% ont une déficience intellectuelle légère, voire n’ont pas de déficience (QI>55). Le score moyen de sévérité autistique mesurée par l’ADOS-2 est de 7 ± 2, impliquant que 12% des enfants ont des symptômes légers (score entre [1;4]) et 88% des symptômes modérés à sévères (score >4). À l’échelle de Vineland II mesurant le fonctionnement adaptatif, le score moyen est de 68,9 ± 15,2 en communication, 68,9 ± 11 en socialisation et 72,95 ± 1,13 en autonomie. Concernant le niveau de langage extrapolé à partir de l’item 31 de l’ADI-R, 52,8% des enfants ont un langage fonctionnel, 21% n’utilisent quotidiennement que quelques mots et 26,2% n’ont pas de langage. L’âge moyen auquel un premier avis diagnostique a été donné aux parents à propos des difficultés de leur enfant se situe autour de 2,8 ± 1,9 ans. Pourtant le diagnostic de TSA n’a été établi que beaucoup plus tard, autour d’un âge moyen de 4,9 ± 2,9 ans. Comme l’illustrent les écarts-types du tableau 2, la variabilité interindividuelle est importante dans la cohorte.
 Agrandir l'image
Agrandir l'imageUn suivi prospectif en cours (figure 2)
La période d’inclusion a été clôturée au 31 décembre 2019 avec une période de suivi qui s’achèvera en 2025 pour tous les patients, conformément au protocole. Le suivi des patients est effectué par des psychologues formés aux outils de recueil et aux procédures prévues par notre recherche. Les enjeux de ce suivi prospectif sont à la fois la fidélisation des participants et l’actualisation régulière de leurs coordonnées entre les différents temps du suivi. Des efforts importants sont donc faits pour favoriser la communication à destination des participants. Ils visent à actualiser leurs coordonnées pour éviter de les perdre de vue, à identifier et lever des obstacles éventuels à leurs participation, à entretenir un lien privilégié (contacts téléphoniques, mails, « diplôme » et sac de « jeune chercheur » offert à l’enfant à la fin des bilans, carte personnalisée adressée à l’enfant au moment de son anniversaire).
Le taux de refus de participation à l’étude a été de 9,2% environ. Par ailleurs, le taux d’attrition constaté à 3 ans de suivi est de 3,3%.
Structuration d’un réseau de cliniciens et de chercheurs
La constitution de la cohorte Elena s’est appuyée sur un réseau de cliniciens et de chercheurs structuré en un consortium comportant un comité de pilotage qui se réunit régulièrement depuis 2014. Ce réseau s’est élargi dans un second temps à des chercheurs internationaux et des parents impliqués notamment dans le comité scientifique de la cohorte.
Un projet qui n’existerait pas sans la collaboration des familles
L’adhésion des familles au projet se traduit par des taux élevés d’accord de participation et d’observance au cours du suivi. Le maintien de cette participation est renforcé par la remise de comptes rendus détaillés des visites de suivi des enfants (très appréciés des familles) et une vigilance (en lien avec les centres investigateurs, notamment les CRA) aux questions médicales ou sociales que nous adressent les familles, qui peuvent nous contacter sur une boite mail dédiée. Des bulletins d’information annuels leurs sont envoyés et des journées scientifiques sont également organisées autour de thématiques reliées au projet de cohorte. Des captations vidéo de ces conférences, disponibles sur le site internet dédié à la cohorte Elena (www.elena-cohorte.org), les rendent accessibles au plus grand nombre de familles. Les familles ont également participé à la validation de nos perspectives, en particulier celle d’une cohorte prénatale de fratries à risque de TSA. Ainsi, les familles interrogées par questionnaires et dans le cadre de « focus group » sur l’intérêt et les éventuelles limites de ce projet nous y ont encouragé et ont permis d’adapter certains aspects du protocole.
Résultats attendus
Ils recouvrent la constitution en cours d’une base de données multidimensionnelle à même de favoriser la compréhension des trajectoires évolutives des enfants avec un TSA, ce qui est très important pour planifier la réponse à leurs besoins en termes d’accès à la santé, à l’éducation et aux soins. Par ailleurs, notre projet s’oriente vers l’identification de marqueurs cliniques et biologiques pour contribuer au diagnostic précoce du TSA et limiter l’errance diagnostique que connaissent malheureusement beaucoup de familles. Un autre impact potentiel est de limiter l’incidence du TSA par des mesures de prévention en santé rendues possibles par l’identification de facteurs de risque modifiables, notamment au plan de l’environnement. Selon le modèle d’une origine développementale précoce des maladies et de la santé, des stresseurs environnementaux intervenant lors de fenêtres d’expositions périnatales (médicaments, infections, produits chimiques comme les perturbateurs endocriniens, ou encore pollution) sont susceptibles de perturber le neuro-développement et de donner lieu à des troubles sévères tels que le TSA. L’interdiction récente chez toute femme en âge de procréer de la prescription de Dépakine®, mise en cause dans la survenue de troubles neuro-développementaux chez des enfants exposés en période anténatale, illustre cette démarche de prévention. Par ailleurs Elena, de par son caractère multidimensionnel, est déjà le creuset d’une recherche translationnelle sur l’autisme favorisant la rencontre et les collaborations de cliniciens et de chercheurs venant de l’épidémiologie et de la recherche fondamentale. Enfin, le chaînage des données des enfants de la cohorte Elena avec celles du SNDS relatives au parcours et à la consommation de soins incluant la période fœtale permettra des études médico-économiques pour estimer les coûts des prises en charge et le reste à charge des familles ainsi que l’étude des inégalités sociales de santé.
Forces, limites de la cohorte Elena et perspectives
Notre étude repose sur un échantillon de grande taille de cas confirmés suivis prospectivement sur une longue durée, en ayant pris soin de recueillir de nombreuses variables relatives au développement de l’enfant, à sa santé et son environnement. Cela permet non seulement une description précise des trajectoires de développement à long terme, mais aussi d’explorer leurs déterminants dans différentes dimensions supposées intervenir dans l’évolution du TSA. Toutefois, nombre d’informations, notamment celles concernant la période périnatale, sont collectées rétrospectivement, ce qui introduit des biais. De plus, le suivi des enfants débuté après seulement qu’un diagnostic soit établi de façon certaine ne permet pas d’étudier la période des prodromes, alors que sa meilleure connaissance apparaît aujourd’hui nécessaire pour mieux comprendre l’installation du syndrome et mettre au point des interventions très précoces. Cela nous conduit à envisager de mettre en place une cohorte prénatale de nourrissons dont le risque d’autisme est particulièrement augmenté car ils appartiennent à des fratries d’enfants autistes. Une telle cohorte favorisera l’étude des caractéristiques développementales très précoces dans le TSA et d’autres troubles neuro-développementaux. Elle sera déterminante aussi pour identifier des biomarqueurs du diagnostic précoce et de l’effet des traitements.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.
Remerciements
Elena a bénéficié du soutien financier du CHU de Montpellier, de la DGOS (PHRCN-2013) et de la CNSA que nous remercions. Les auteurs remercient aussi les équipes cliniques et les chercheurs partenaires du projet et expriment toute leur reconnaissance et leur affection aux enfants et familles qui se sont impliqués dans le projet.