Enjeux métrologiques associés aux données
de biosurveillance
// Metrological issues associated to biomonitoring data
Résumé
La biosurveillance humaine a pour objectif d’évaluer l’exposition de la population aux substances chimiques organiques et inorganiques afin d’élaborer des valeurs de référence, de comparer les niveaux d’exposition de sous-populations, de mettre en évidence des tendances temporelles ou géographiques, ou encore d’évaluer l’impact de mesures de gestion. Pour cela, la mesure de ces marqueurs biologiques d’exposition (i.e. biomarqueurs) doit reposer sur des méthodologies harmonisées afin de minimiser les biais analytiques et de pouvoir comparer les résultats. Cela nécessite en particulier de déterminer la forme chimique sous laquelle le biomarqueur doit être analysé (composé parent ou métabolites) et de recourir à la méthode analytique la plus appropriée au biomarqueur sélectionné. Les résultats devront être normalisés pour minimiser les variations physiologiques intra et interindividuelles et ainsi permettre une meilleure interprétation et comparabilité. Dans cet article, nous abordons et discutons les questions relatives aux enjeux analytiques évoqués ci-dessus.
Dans un premier temps, nous discutons comment la prise en compte de la toxicocinétique des substances considérées peut permettre de sélectionner, en fonction de la matrice biologique considérée, le biomarqueur (composé parent ou métabolites) le plus pertinent à analyser au regard des critères de fréquence de détection, concentration et spécificité, ou encore des profils d’excrétion urinaire cycliques.
Nous abordons ensuite la question de la méthode analytique et discutons comment différents paramètres tels que la conservation de l’échantillon, le choix d’une méthode de déconjugaison, la préparation d’échantillon ou encore la filière analytique peuvent influencer les résultats d’analyse.
Enfin nous discutons comment la prise en compte de paramètres physiologiques propres aux individus de la population d’étude, pour des matrices biologiques telles que le sang, l’urine et le cheveu, peut affecter de manière significative le calcul de la concentration du xénobiotique considéré.
Abstract
The purpose of human biomonitoring is to assess the exposure of populations to organic and inorganic substances, in order to develop reference values to compare populations or subgroups, to highlight temporal or geographical trends or assess the impact of management measures. The measure of these biological exposure markers (i.e. biomarkers) has to be based on standardized methodologies, in order to achieve a better comparability of results and minimize analytical bias. This requires, in particular, choosing the chemical form in which the biomarker has to be analyzed (parent compound or metabolites) and using the most appropriate analytical method for the selected biomarker. The results should be standardized to minimize intra- and inter-individual physiological variations, and thus allow better interpretation and comparability. In this article, we discuss questions related to the analytical issues mentioned above.
First, we discuss how a better consideration of the toxicokinetics of the considered substances can be used to select, according to the biological matrix, the most relevant biomarker (parent compound or metabolites) to analyze in terms of the detection frequency, concentration, specificity, or cyclic urinary excretion profiles.
Then, we address the issue of the analytical method and discuss how different parameters such as sample storage, choice of deconjugation method, sample preparation and analytical process can influence the analytical results of the considered biomarker.
Finally, we discuss how the inclusion of physiological parameters specific to individuals of the study population for biological matrices such as blood, urine and hair can significantly affect the calculation of the considered xenobiotic concentration.
Introduction et contexte
En 2004, la Commission européenne reconnaissait, dans son Plan d’action 2004-2010 en faveur de l’environnement et de la santé, la pertinence de la biosurveillance humaine comme un outil de surveillance basé sur des indicateurs biologiques (i.e. biomarqueurs) « révélateurs d’expositions environnementales, de maladies et/ou de troubles ou d’une prédisposition génétique, et l’étude des liens éventuels existant entre eux ». Elle soulignait également le besoin de méthodologies harmonisées afin d’obtenir une meilleure comparabilité des résultats.
Les projets européens ESBIO (Expert team to Support Biomonitoring) 1, COPHES (Consortium to Perform Human Biomonitoring on a European Scale) 2, DEMOCOPHES (Demonstration of a study to Coordinate and Perform Human Biomonitoring on a European Scale) 3 puis HBM4EU (HBM : Human Biomonitoring) 4 ont ainsi été conduits afin notamment de développer des méthodes d’analyse dédiées aux contaminants chimiques, organiques et inorganiques, visant à une meilleure comparabilité des données en y incluant des règles de bonnes pratiques validées et reconnues par l’ensemble de la communauté scientifique internationale. Mais les enjeux de la métrologie doivent aussi être étudiés au regard des principaux objectifs de la biosurveillance, dont en particulier : i) l’évaluation de l’exposition de la population aux substances chimiques, ii) l’évaluation de la fiabilité analytique des mesures d’exposition, et iii) la comparaison de sous-populations et la mise en évidence de tendances temporelles et géographiques de l’exposition visant à l’élaboration de valeurs de référence.
Le premier enjeu métrologique renvoie au concept de validité interne, c’est-à-dire à l’aptitude des biomarqueurs utilisés à refléter ce qu’ils sont censés mesurer, à savoir l’exposition humaine dans toute sa variabilité. Cette question implique en particulier le choix, difficile, complexe et souvent peu documenté, du couple « biomarqueur/matrice » le plus pertinent, dont la principale caractéristique doit être sa capacité à maximiser la fréquence de détection de l’exposition considérée dans la population d’étude.
Le deuxième enjeu renvoie à la notion de performances des méthodes analytiques et à l’estimation de l’incertitude de mesure, afin de minimiser les biais analytiques et erreurs d’interprétation au regard des niveaux d’exposition mesurés. Il s’agit en particulier de choisir la forme sous laquelle le biomarqueur doit être analysé et de recourir à la méthode analytique la plus appropriée en termes de spécificité et de sensibilité.
Enfin, le dernier enjeu renvoie à la nécessité de normaliser les résultats au moyen d’un paramètre biologique pour minimiser les variations physiologiques interindividuelles, permettant ainsi une meilleure interprétation et comparaison des données, dans l’espace et dans le temps.
L’absence de référentiels ne permettant pas de guider les choix relatifs aux enjeux évoqués dans le champ de la biosurveillance et plus généralement du biomonitoring en épidémiologie, les options choisies sont souvent le fait d’extrapolation, des connaissances d’une substance considérée à une autre. Nous présentons par la suite les questions posées par ces enjeux.
La détermination du couple biomarqueur/matrice
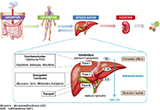
Les xénobiotiques se trouvant généralement à l’état de traces dans les matrices biologiques humaines, l’enjeu pour la biosurveillance est de pouvoir maximiser leur fréquence de détection dans la population d’étude. Cela passe notamment par la détermination du couple optimal biomarqueur/matrice. À cet égard, la prise en compte de la toxicocinétique d’un xénobiotique donné, c’est-à-dire l’étude des phénomènes d’absorption, de distribution tissulaire, de métabolisme et d’excrétion (ADME) 5, est un élément clé pour caractériser de manière appropriée l’exposition de la population d’étude (figure 1). Elle doit permettre de sélectionner, en fonction de la matrice biologique considérée, le biomarqueur (composé parent ou métabolites) le plus pertinent à analyser au regard des critères de fréquence de détection, fenêtre d’exposition, concentration et spécificité. La prise en compte de la toxicocinétique doit conduire également à ajuster la fenêtre des prélèvements à réaliser, en particulier si les xénobiotiques étudiés sont non-persistants (i.e. rapidement métabolisés et/ou excrétés) ou présentent par exemple des profils d’excrétion urinaire cycliques 6.
Les phénomènes d’absorption (passage du milieu extérieur vers le milieu intérieur), de distribution (concentration dans les différents organes/tissus/sites de stockage), de métabolisme (biotransformation) et d’excrétion (élimination dans le milieu extérieur) sont conditionnés par les propriétés physicochimiques de la molécule telles que sa masse moléculaire, son degré d’ionisation, sa réactivité et sa solubilité 5. La masse moléculaire et la polarité sont des facteurs influençant le transport actif ou passif de la molécule à travers une membrane. La solubilité quant à elle est un paramètre important, modulant le passage membranaire cellulaire, le potentiel de la molécule à s’accumuler dans certains tissus et pouvant aussi conditionner l’intervention ou non d’un système de détoxification enzymatique pour son élimination 7. Au regard des propriétés physico-chimiques de la molécule, le choix de la matrice constitue en soi une information quant à la nature de l’exposition à considérer : à court ou long-terme 8. Il est également important de noter que dans l’environnement, le xénobiotique peut déjà se trouver sous forme de produits de biotransformation (métabolites) suite à des réactions chimiques se produisant via le métabolisme animal ou végétal, ou de produits de dégradation suite à des réactions physico-chimiques abiotiques.
Contrairement aux données physico-chimiques généralement disponibles dans des bases de données en ligne telles que PubChem ou ChemSpider, les données de toxicocinétique ne le sont que peu fréquemment pour les xénobiotiques. De plus, ces données sont parfois issues de modèles in vivo animaux qui ne sont pas toujours extrapolables chez l’homme. Si des modèles in silico physiologiques toxicocinétiques tels que les modèles PBPK (Physiologically-Based PharmacoKinetic) permettent d’extrapoler la dose interne à partir de la dose externe, l’ajustement des modèles est souvent rendu difficile en raison de la complexité et du nombre de paramètres à considérer.
En pratique, en raison du manque habituel de données toxicocinétiques, plus particulièrement celles liées au métabolisme, la justification du choix du ou des xénobiotiques à analyser (composés parents et/ou métabolites) et de la matrice se fait généralement en extrapolant les connaissances disponibles pour des molécules possédant des propriétés physico-chimiques « plus ou moins » similaires. Bien qu’il existe des exceptions (hydrocarbures aromatiques polycycliques, lindane, etc.), les polluants organiques persistants (i.e. dans les milieux environnemental et biologique) sont le plus souvent analysés dans le sang sous leur forme parente (non métabolisée), tandis que les polluants organiques non persistants le sont dans l’urine après hydrolyse enzymatique du biomarqueur cible (i.e. formes conjuguées glucuronide et sulfate).
Quant au choix du couple biomarqueur/matrice, il est fait le plus souvent en fonction des méthodes analytiques publiées dans la littérature, mais gagnerait à prendre en compte les données toxicocinétiques lorsque celles-ci sont disponibles ainsi que la fenêtre d’exposition étudiée. Toutefois, au-delà de la disponibilité des méthodes, il existe encore des limites opérationnelles comme le manque de disponibilité commerciale de standards (natifs ou marqués en isotope stable) permettant le dosage de métabolites peu fréquemment recherchés, la difficulté de prélever et d’échantillonner de manière suffisante les matrices « invasives » ou les contraintes de temps ou financières pour disposer d’échantillons répétés dans le temps et par individu dans le cas des xénobiotiques, sujets à une variabilité intra-journalière.
Méthode d’analyse
Avant même l’analyse du biomarqueur, se pose la question de l’impact des conditions de stockage et de conservation des échantillons biologiques sur la stabilité des marqueurs cibles et in fine sur la validité des résultats. Pour préserver les composés organiques, le stockage à -80°C est le plus souvent mis en œuvre et semble adapté pour certaines matrices comme le sang ou l’urine. Les éléments inorganiques étant stables à température ambiante, les échantillons sont toutefois conservés à -20° C pour préserver la matrice. Néanmoins, des dispositions particulières sont prises telles que l’ajout d’un complexant de type EDTA, qui permet d’éviter une coagulation du sang, ou une adsorption des éléments sur le flaconnage, qui biaiserait le résultat d’analyse. Les prélèvements de cheveux sont généralement stockés à température ambiante dans des enveloppes en papier ou en aluminium. Les conditions de stockage peuvent donc poser question au regard de la matrice et du contaminant, et de leur éventuelle dégradation dans le temps. Sur ce point, il serait utile de mener des études visant à évaluer les conditions de conservation optimales (durée, température, conditionnement…) d’un échantillon biologique en fonction de la substance à doser pour préserver au mieux l’échantillon entre le moment du prélèvement et son analyse, en particulier pour les polluants émergents ou encore peu étudiés.
Vient ensuite la question de l’analyse du biomarqueur : doit-il être dosé sous sa ou ses formes conjuguées (mesure directe des métabolites glucuronide et/ou sulfate…), ou sous sa forme libre après une étape de déconjugaison visant à transformer toutes les formes conjuguées en forme libre (mesure de la concentration totale). Sur ce point également, les données toxicocinétiques relatives au biomarqueur d’intérêt devraient permettre de répondre à cette question. Cependant, le dosage des formes conjuguées et l’étude des rendements de déconjugaison trouvent leurs limites dans la commercialisation peu fréquente de ces formes, conduisant les laboratoires, lorsqu’ils le peuvent, à les faire synthétiser à façon avec une exigence de haute pureté afin de répondre aux conditions instrumentales. Quant au dosage des formes libres, leur principale limite réside dans les moyens limités dont disposent les laboratoires pour contrôler l’efficacité de l’étape de déconjugaison, quelle que soit la méthode utilisée (hydrolyse acide, hydrolyse enzymatique…) et dans la difficulté à appliquer des conditions d’hydrolyse adaptées à l’ensemble des biomarqueurs cibles.
Il s’agit ensuite de développer la méthode d’analyse apte à doser le biomarqueur d’intérêt sous sa forme la plus pertinente, généralement à l’état de traces, voire d’ultra-traces, dans un échantillon biologique par nature complexe et disponible le plus souvent en quantité très limitée (quelques centaines de µL à quelques mL pour le sang et l’urine, quelques dizaines de mg pour les cheveux). La complexité de la matrice et une prise d’essai faible, voire très faible, impliquent généralement une étape de préparation de l’échantillon qui, d’une part vise à isoler la molécule d’intérêt des autres constituants de la matrice susceptibles d’engendrer des interférences analytiques et, d’autre part, à la concentrer pour permettre au système d’analyse de la détecter. Élaborer une méthode suffisamment sensible avec des limites de quantification en accord avec les concentrations attendues est évidemment un point crucial, mais d’autres caractéristiques de performances de la méthode (i.e. spécificité, justesse, fidélité) le sont tout autant.
Par ailleurs, plusieurs solutions techniques sont disponibles aujourd’hui pour chaque étape du protocole analytique (extraction, purification, séparation chromatographique et détection) et de nombreux paramètres peuvent être optimisés au cours du développement d’une méthode, si bien qu’il peut y avoir autant de méthodes différentes pour le dosage d’un biomarqueur donné que de laboratoires proposant ce dosage. La figure 2 illustre les différentes méthodes analytiques existantes pour doser différentes familles de contaminants organiques et inorganiques, selon leurs propriétés physicochimiques et les interférences possibles. Cette multiplicité des stratégies analytiques possibles est à l’origine de difficultés pour conduire des programmes de biosurveillance, impactant la comparabilité des résultats d’analyse d’un laboratoire à l’autre et d’une étude à l’autre. Dans ce contexte, l’harmonisation de ces méthodes via l’élaboration de normes d’analyse ou la publication de méthodes « de référence », et surtout l’harmonisation des procédures d’évaluation des performances et des incertitudes de mesure des méthodes, constituent un enjeu d’actualité à l’échelle internationale.
 Agrandir l'image
Agrandir l'imageLes enjeux de la normalisation
Les études de biosurveillance ayant également pour objectifs de comparer la distribution de niveaux de xénobiotiques, organiques et inorganiques, entre différentes populations ou d’établir des valeurs de référence de niveaux d’imprégnation biologique, il est primordial de pouvoir prendre en compte les paramètres physiologiques propres aux individus de la population d’étude, comme par exemple le débit urinaire ou le taux de lipides sériques, qui sont très variables d’un individu à l’autre et peuvent affecter de manière significative le calcul de la concentration urinaire ou sanguine du xénobiotique considéré. Ces facteurs d’ajustement sont propres à la matrice considérée, mais également liés à la toxicocinétique de la molécule étudiée.
En ce qui concerne l’urine, les concentrations varient en fonction de la diurèse et du moment du prélèvement 9,10. Dans le champ de la biosurveillance, le facteur d’ajustement le plus fréquemment utilisé est la créatinine, qui constitue la méthode de référence actuelle. En effet, la créatinine est éliminée par filtration glomérulaire de façon relativement stable pour un individu, permettant ainsi une correction des concentrations affectées par la diurèse. Cependant, son utilisation est de plus en plus remise en cause du fait de la variabilité de son excrétion d’un individu à l’autre, dépendante de l’indice de masse corporelle, du régime alimentaire, de l’âge ou encore du sexe, pouvant conduire à des variabilités intra et interindividuelles significatives. Le fait que tous les xénobiotiques ne suivent pas la même voie d’élimination rénale est un autre argument d’importance qui remet en cause l’applicabilité générale de ce type d’ajustement. D’autres facteurs d’ajustement existent tels que la gravité spécifique, l’osmolalité, le taux d’excrétion du biomarqueur seul ou ajusté sur le poids, le flux urinaire ajusté. Des études comparatives de différents facteurs d’ajustement ont montré des avantages pour la gravité spécifique, l’osmolalité ou le flux urinaire qui semblent moins impactés par des critères tels que la masse musculaire, l’âge et le sexe 11,12. La correction par ces facteurs semble plus pertinente lorsque la population d’étude présente d’importantes différences en termes de masse musculaire et/ou de sexe 13. Le choix d’utiliser préférentiellement l’un de ces facteurs dépendra également des mécanismes d’élimination rénale du biomarqueur d’intérêt. Par exemple, certains phtalates étant éliminés par sécrétion tubulaire active, la gravité spécifique pourrait être plus appropriée que la créatinine pour corriger les concentrations en phtalates (tableau) 14.
Dans le sang, les concentrations en polluants organiques persistants sont souvent exprimées en poids total de lipides. Il existe deux approches, gravimétrique et enzymatique, pour déterminer la teneur en lipides dans le sérum et le plasma 15,16. L’approche enzymatique, la plus utilisée pour le sérum, est basée sur la mesure de la somme de certaines familles lipidiques 17,18. Cette approche revêt un caractère assez consensuel dans la communauté du contrôle réglementaire des matrices environnementales et alimentaires et assure globalement une bonne comparabilité des données disponibles. Elle est en revanche plus critiquable dans le domaine du lien environnement-santé où la relation biologique complexe entre lipides et polluants lipophiles doit être prise en compte dans les analyses statistiques visant à révéler/tester des associations entre les niveaux d’exposition interne et des paramètres de santé (tableau) 19.
Concernant le cheveu, il existe de nombreux paramètres influençant l’incorporation des polluants dans cette matrice, qui peuvent varier fortement d’une substance à l’autre et d’un individu à un autre. Outre les facteurs génétiques, les principaux paramètres d’influence sont l’âge, le sexe, la couleur du cheveu et la concentration en lipides 20,21. Des travaux sur la compréhension de l’influence de ces paramètres sur l’incorporation des métabolites devraient permettre à termes de normaliser les concentrations dans les cheveux. Il serait également nécessaire, comme pour l’urine ou le sang, d’identifier un ou plusieurs facteurs d’ajustement, tels que la kératine, la mélanine ou des minéraux présents dans le cheveu, afin de disposer de mesures fiables et comparables 20.
Des travaux sont donc nécessaires pour clarifier les meilleures méthodologies à mettre en place, dépendantes des biomarqueurs et des objectifs des mesures, afin d’établir un cadre normatif robuste et cohérent.
 Agrandir l'image
Agrandir l'imageConclusions
Les choix relatifs à la mise en œuvre d’une mesure optimale de biomarqueurs sont dépendants de la physico-chimie des substances considérées et de la fenêtre d’exposition étudiée, et nécessitent un travail préalable pour sélectionner la forme la plus pertinente à analyser en fonction de la matrice considérée. Toutefois le manque de données toxicocinétiques pour les substances considérées dans les programmes de biosurveillance rend encore parfois difficile la détermination du meilleur couple biomarqueur/matrice.
En ce qui concerne les méthodes analytiques, leur harmonisation ne passera pas nécessairement par une standardisation des protocoles ou des instruments utilisés, qui peuvent être propres à chaque laboratoire, mais plutôt par l’harmonisation des procédures d’évaluation des performances et des incertitudes de mesure des méthodes.
Enfin, des travaux sont encore nécessaires non seulement pour clarifier le choix quant aux meilleures méthodologies de normalisation à retenir pour l’urine et le sang en fonction du biomarqueur considéré, mais aussi pour identifier des facteurs d’ajustement pertinents pour des matrices telles que le cheveu.
Une étude reposant sur des prélèvements issus de ces différents compartiments biologiques chez les mêmes individus, en condition d’exposition « réelle », permettrait de caractériser la distribution des résidus marqueurs au sein de ces compartiments, afin de mieux documenter leur pertinence et de comparer différentes approches de normalisation et d’expression des résultats.
Au-delà des difficultés évidentes qui limitent la mise en place de ce type d’étude à large échelle (éthiques, économiques, logistiques…), une preuve de concept focalisée sur des composés représentatifs de quelques familles de xénobiotiques aux propriétés physico-chimiques variées (persistants historiques, persistants émergents, non persistants, métaux) constituerait une première approche pour produire des données contribuant à progresser sur ces questions 22,23,24.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de lien d’intérêt au regard du contenu de l’article.
Références
P_Andujar_Toxicocinetique.pdf
468-76.
44-50.
824-31.
388-96.