Létalité à 28 jours après un accident vasculaire cérébral
selon l’étiologie et le sexe, registre des AVC de Lille,
2008-2017
// Comparison of 28-day stroke case fatality by etiology and sex, Lille stroke register, 2008-2017
Résumé
Introduction –
Les accidents vasculaires cérébraux (AVC) ont des étiologies multiples qui affectent le pronostic fonctionnel et vital des patients. Notre objectif était de mesurer et de comparer la létalité à 28 jours associée aux AVC selon l’étiologie et le sexe, dans un échantillon de population générale français.
Méthodes –
Les données proviennent du registre des AVC de Lille qui recueille tous les cas d’AVC des résidents âgés de 35 ans et plus. Tous les cas enregistrés entre 2008 et 2017 ont été inclus dans cette étude. La létalité a été recueillie à 28 jours.
Résultats –
Sur 2 933 AVC, les AVC hémorragiques et ischémiques représentaient respectivement 16% et 84% des cas et les taux de létalité étaient de 48% et 15%. La majorité des décès (75%) survenait avant 6 jours après un AVC hémorragique et avant 16,5 jours après un AVC ischémique. Les taux de létalité n’étaient pas différents en fonction du sexe après un AVC hémorragique, mais étaient supérieurs chez les femmes par rapport aux hommes (18% vs 12% respectivement) après un AVC ischémique. Cette différence disparaissait après ajustement sur l’âge. Parmi les AVC ischémiques, les AVC cardio-emboliques (34%) et de causes indéterminées (33%) étaient les plus fréquents avec des taux de létalité respectifs de 16% et 18%. Les AVC des grosses artères (11%) et les AVC lacunaires (10%) étaient minoritaires avec des taux de létalité de 3%.
Conclusion –
La létalité des AVC est élevée et rapide après un AVC hémorragique et comparativement plus faible après un AVC ischémique, en particulier pour les AVC des grosses artères ou lacunaires.
Abstract
Background and aims –
Strokes have multiple etiologies that affect their functional prognosis and mortality. The aim of our study was to measure and compare 28-days stroke case fatality by etiology and sex in a population-based study.
Methods –
Data were obtained from the stroke population-based register which continuously monitors the adult population of 35 years old and older living in the city of Lille. All reported stroke events over the 2008-2017 period were included in this study. Case-fatality was collected at 28 days.
Results –
Out of 2,933 strokes, 16% were hemorrhagic strokes and 84 % were ischemic strokes, with a 28-day case-fatality rate of 48% and 15% respectively. The majority of deaths (75%) occurred before 6 days after a hemorrhagic stroke and before 16.5 days after an ischemic stroke. Case fatality rates were not different for men and women after a hemorrhagic stroke, while they were higher for women than for men (18% vs 12% respectively) after an ischemic stroke. This difference disappeared after adjusting for age. Cardioembolic (34%) and strokes of undetermined cause (33%) were the most common strokes with case fatality rates of 16% and 18% respectively. Large artery atherosclerosis (11%) and lacunar strokes (10%) represented a minority with case fatality rates of 3%.
Conclusion –
Case fatality is high and rapid after a hemorrhagic stroke and is comparatively lower after an ischemic stroke, especially for strokes of large arteries and lacunar strokes.
Introduction
L’accident vasculaire cérébral (AVC) est une maladie grave en raison du grand nombre de décès prématurés et de l’invalidité qu’il provoque chez de nombreux survivants. Il induit une charge importante sur les familles, les soignants et les services de santé 1. Avec le vieillissement démographique des populations, la prévalence de cette maladie tend à augmenter. En France, les travaux du registre des AVC de Dijon, qui représentaient jusqu’à très récemment la principale source de données épidémiologiques des AVC en France, indiquent que le nombre total d’AVC augmentera de 55% d’ici 2030 à Dijon 2,3.
La létalité après un AVC varie en Europe selon les pays 4 et, en France, selon les régions 5. Elle dépend directement de l’étiologie et des mécanismes physiopathologiques des AVC 6,7. En France, les bases de données médico-économiques ne permettent pas d’analyser précisément les données par type d’AVC, en raison de la part d’AVC non caractérisés comme étant hémorragiques ou ischémiques, qui est évaluée à 44% en 2013 5, et de la déclinaison selon la classification TOAST, qui ne peut être réalisée 7,8.
Afin de mieux connaître les besoins médicaux nécessaires pour leur prise en charge, une connaissance précise des dynamiques d’évolution des AVC et de leur conséquence sur la survie est indispensable, notamment en fonction de leurs étiologies. L’objectif de notre étude était donc de mesurer et de comparer la létalité à 28 jours, associée aux AVC en fonction de l’étiologie et du sexe, dans un échantillon de population générale. Pour cela, nous avons utilisé les données exhaustives du registre de morbi-mortalité des AVC de la ville de Lille, entre 2008 et 2017.
Méthodes
Le registre des AVC de Lille
Le registre des AVC de Lille, créé en 2008, est accrédité par Santé publique France et l’Institut national de la santé et de la recherche médicale (Inserm). Le registre a été décrit en détail précédemment 9. Il surveille en continu la population adulte de 35 ans ou plus vivant à Lille et dans les villes voisines de Lomme et de Hellemmes. Tous les AVC enregistrés entre le 1er janvier 2008 et le 31 décembre 2017 ont été inclus dans la présente étude. Selon les données nationales du recensement de 2016, la zone surveillée comptabilisait 232 737 habitants, dont 94 331 âgés de 35 ans ou plus. L’exhaustivité du recueil des cas d’AVC est assurée grâce à de nombreuses sources : hôpitaux des secteurs publics et privés, cliniques, établissements d’hébergement pour personnes âgées dépendantes (Ehpad), Samu, médecins généralistes et centres de réadaptation. Tous les AVC incidents (le premier AVC) et les récidives d’AVC sont recensés, que le patient soit hospitalisé ou non. Le diagnostic d’AVC est défini (selon les critères de l’Organisation mondiale de la santé (OMS) et la classification internationale des maladies) comme « le développement rapide de signes cliniques localisés ou globaux de dysfonction cérébrale avec des symptômes durant plus de 24 heures, pouvant conduire à la mort, sans autre cause apparente qu’une origine vasculaire » 1.
Ainsi, les accidents ischémiques transitoires avec un déficit neurologique de moins de 24 heures (AIT) ne sont pas recueillis dans le registre. En revanche, les patients traités par thrombolyse ou thrombectomie et ayant récupéré en moins de 24 heures y sont inclus. Sont exclus du registre : les tumeurs cérébrales, hématomes sous-duraux traumatiques, la sclérose en plaques, l’épilepsie, les migraines. Les données cliniques et de l’imagerie cérébrale ont été utilisées pour définir le type d’AVC : infarctus cérébral, hémorragie intracérébrale spontanée, hémorragie sous-arachnoïdienne (non incluse dans la présente étude). Une petite partie des résidents de Lille qui font un AVC ne passent pas par l’hôpital et ne bénéficient pas, de ce fait, d’un bilan étiologique. Il s’agit en général de personnes âgées et dont la condition physique est très altérée. Ces patients pour lesquels un bilan n’a pu être établi ne sont pas inclus dans la présente étude. Leur taux de létalité est de 69%.
Le nombre annuel moyen de sources par cas est de 3,2±1,1.
Étiologie de l’accident ischémique cérébral
Les critères de TOAST (Trial of Org 10172 in Acute Stroke Treatment) ont été utilisés pour définir les sous-types d’AVC ischémiques classés en cinq grandes catégories mécanistiques : AVC cardioemboliques, infarctus cérébral des grosses artères, infarctus cérébral lacunaire, infarctus cérébral autre et infarctus cérébral de cause indéterminée 10.
Analyses statistiques
Les taux de létalité à 28 jours ont été calculés avec au numérateur, respectivement, le nombre de patients victimes d’AVC décédés dans les 28 jours, et au dénominateur le nombre de patients victimes d’AVC, puis comparés par des tests du Chi2. Ces taux ont ensuite été standardisés sur l’âge de la population de la France métropolitaine de 2011 (source : Insee). Des courbes de survie ont été réalisées avec la méthode Kaplan-Meier puis comparées avec le test du Log-rank lorsque les conditions de validité le permettaient. Enfin, chez les patients décédés, les délais entre l’apparition de l’AVC et le décès ont été représentés par des box plots en fonction du sexe et du type de l’AVC et ont été comparés par des tests de Kruskal-Wallis.
L’interaction âge x sexe a été étudiée en incluant le terme d’interaction approprié dans un modèle de régression logistique. Le seuil de significativité a été fixé à 5%. Les analyses statistiques ont été effectuées avec le logiciel R® (version 3.5) 11.
Aspects éthiques
Le Registre des AVC de Lille a été approuvé par le Comité national des registres (référence : 2015/04/07) et par la Commission nationale de l’informatique et des libertés (Cnil).
Résultats
Entre 2008 et 2017, 3 131 AVC de tous types ont été recensés, parmi lesquels nous avons exclus : 103 (3,3%) hémorragies méningées, 91 (2,9%) AVC sans bilan établi (type d’AVC non précisé) et 4 (0,1%) patients perdus de vue pour le suivi à 28 jours. Nos analyses sont donc basées sur 2 933 AVC dont 80% sont des évènements incidents.
Le tableau 1 montre l’effectif total et l’âge moyen en fonction du sexe et de l’étiologie de l’AVC. Parmi les 2 933 AVC, 479 étaient hémorragiques (16%) et 2 454 étaient ischémiques (84%). Il n’y avait pas de différence d’effectif selon le sexe parmi les AVC hémorragiques (p=0,29), tandis qu’il y avait plus de femmes que d’hommes parmi les AVC ischémiques (p<0,0001). Parmi les AVC ischémiques, il y avait 34% d’AVC cardioemboliques, 33% d’infarctus cérébraux de cause indéterminée, 11% d’AVC ischémiques des grosses artères, 10% d’AVC lacunaires et 5% d’infarctus cérébraux d’autres causes. En dehors de la classification TOAST, on pouvait également répertorier 5% d’infarctus cérébraux « probables » et 2% d’infarctus cérébraux de causes multiples (données non présentées). Les AVC cardioemboliques et les infarctus cérébraux de cause indéterminée étaient plus fréquents chez les femmes que chez les hommes (p<0,01), tandis que les AVC des grosses artères étaient plus fréquents chez les hommes (p<0,01).
2008-2017
 Agrandir l'image
Agrandir l'imageLes femmes étaient 4 à 9 ans plus âgées que les hommes en moyenne (p<0,05) pour tous les types d’AVC hormis pour les AVC ischémiques d’autres causes. On note par ailleurs que l’âge moyen des patients après un AVC d’autres causes était inférieur à l’âge moyen des autres patients victimes d’un AVC ischémique (61±16 ans vs 75±14 ans, p<0,0001).
La figure 1A montre les courbes de survie à 28 jours après un AVC ischémique ou hémorragique. La survie était inférieure après un AVC hémorragique comparativement à l’AVC ischémique (p log-rank test <0,0001). Aucune différence de survie à 28 jours n’était observée entre les hommes et les femmes après un AVC hémorragique, alors qu’elle était inférieure chez les femmes par rapport aux hommes après un AVC ischémique (p log-rank test <0,0001). La figure 1B montre la distribution du délai (en jours) entre l’AVC et le décès, chez les patients décédés à 28 jours. Parmi les patients décédés d’un AVC hémorragique, 75% des décès survenaient avant 6 jours. Après un AVC ischémique, 75% des décès survenaient avant 16,5 jours (p Kruskal-test ischémiques vs hémorragique <0,0001). Ces délais ne différaient pas significativement par sexe.
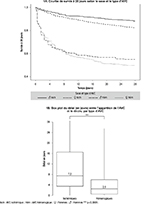 Agrandir l'image
Agrandir l'imageLe tableau 2 montre les taux de létalité à 28 jours par sexe et par âge. Ce taux étaient de 48% après un AVC hémorragique et de 15% après un AVC ischémique (p<0,0001). Ils ne différaient pas entre les hommes et les femmes après un AVC hémorragique (46% et 51% respectivement, p=0,24), et étaient sensiblement plus élevés chez les sujets de plus de 75 ans que chez les sujets de moins de 75 ans (54% et 41% respectivement, p<0,01), sans différence entre les hommes et les femmes en fonction de l’âge (figure 2). Après un AVC ischémique, les taux de létalité à 28 jours étaient, respectivement, de 12% et 18% parmi les hommes et les femmes (p<0,0001) et, en stratifiant sur l’âge 75 ans, les taux étaient sensiblement plus élevés chez les sujets de plus de 75 ans que chez les sujets de moins de 75 ans (21% et 8% respectivement, p<0,0001). La différence de létalité entre les hommes et les femmes n’était observée qu’après 75 ans (17% chez les hommes et 23% chez les femmes après 75 ans, p<0,01, p interaction <0,05) (figure 2). Après ajustement sur l’âge, la différence de létalité selon le sexe disparaissait.
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageLa figure 3A montre les courbes de survie à 28 jours par type d’AVC ischémique. Les survies à 28 jours étaient plus faibles après un AVC cardioembolique, de cause indéterminée ou d’autres causes, comparées aux survies après un AVC des grosses artères ou un AVC lacunaire. En effet, les taux de létalité à 28 jours étaient de 16%, 18% et 19%, respectivement, pour les AVC cardioemboliques, les AVC de causes indéterminées et les AVC d’autres causes (tableau 2). Les taux de létalité à 28 jours après un AVC ischémique des grosses artères et un AVC lacunaire étaient les plus faibles (3%, p<0,0001 comparés au taux létalité des AVC cardioemboliques).
Les délais entre l’AVC et le décès étaient significativement différents selon l’étiologie de l’AVC ischémique (p Kruskal-test <0,05) (figure 3B). Les analyses en sous-groupes montrent une différence significative entre les AVC lacunaires et les infarctus cérébraux des grosses artères (p<0,05). En effet, parmi les individus décédés à 28 jours, la proportion de décès la première semaine était d’environ 50% pour tous les AVC ischémiques, excepté pour les victimes d’AVC lacunaires, qui décédaient majoritairement au cours de la troisième semaine.
selon le type d’AVC ischémique. Registre des AVC de Lille, 2008-2017
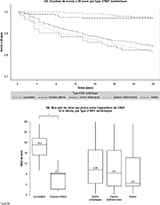 Agrandir l'image
Agrandir l'imageDiscussion
Dans le registre des AVC de Lille, entre 2008 et 2017, les AVC hémorragiques et les AVC ischémiques représentaient 16% et 84% des événements respectivement. Le taux de létalité à 28 jours était de 48% pour les hémorragiques et de 15% pour les ischémiques. Ces résultats sont en accord avec les données de la littérature qui montrent une surmortalité après un AVC hémorragique comparativement à un AVC ischémique en Europe et en France 4,8,12. En outre, nos données ont montré que les décès du premier mois (28 jours) survenaient très rapidement (75% avant 6 jours pour les AVC hémorragiques et 75% avant 16,5 jours pour les AVC ischémiques). Une récente étude de survie réalisée à Dijon en France, montre que ces profils de survie différents entre AVC ischémiques et hémorragiques, persistent à long terme 13.
Dans notre étude, l’âge moyen était 4 à 9 ans plus élevé chez les femmes que chez les hommes pour tous les sous-types d’accident vasculaire cérébral, ce qui suggère que les femmes sont protégées contre les événements cérébrovasculaires à un âge plus jeune. Cependant, la proportion plus élevée de femmes dans les catégories d’âges les plus élevées de la population et l’augmentation du risque vasculaire avec l’âge se traduisent, en nombre absolu, par un plus grand nombre de décès par AVC chez les femmes dans la population. La létalité à 28 jours après un AVC hémorragique ne différait pas entre les femmes et les hommes quel que soit l’âge. Ces résultats sont cohérents avec la littérature qui montre que la létalité à 28 jours après un AVC hémorragique ne diffère pas selon le sexe 14.
À l’inverse, des différences de létalité ont été observées selon le sexe et l’âge pour les AVC ischémiques, avec des taux légèrement plus élevés chez les femmes que chez les hommes, après 75 ans. Des taux de létalité à 28 jours plus élevés chez la femme étaient déjà observés par les trois registres d’AVC français entre 2008 et 2012 15. Cependant, une analyse plus approfondie des évènements après 75 ans a montré que la différence de sexe disparaissait après ajustement sur l’âge, ce qui suggère que l’âge était le principal déterminant de cette différence de sexe. Ces données concordent avec des données récentes de l’AVC ischémique dans lesquelles la mortalité plus élevée observée chez les femmes par rapport aux hommes, était principalement liée à leur âge avancé 13,16.
Les AVC cardio-emboliques et de causes indéterminées représentaient 34% et 33% de l’ensemble des AVC, suivis par les AVC des grosses artères (11%) et les AVC lacunaires (10%). Les AVC cardioemboliques et de causes indéterminées étaient plus fréquents chez les femmes, alors que l’inverse était observé pour les grosses artères. L’âge moyen de survenue était plus élevé chez les femmes que chez les hommes pour toutes les formes d’AVC, sauf les AVC d’autres causes. Ces différences peuvent s’expliquer par la supériorité numérique des femmes dans les tranches d’âges plus élevées et l’augmentation de la prévalence de la fibrillation atriale avec l’âge 17. À l’inverse, les AVC d’autres causes sont plus fréquents chez les jeunes en raison de la part plus élevée de dissections cervicales qui surviennent généralement chez des sujets plus jeunes 18.
La létalité variait aussi selon l’étiologie des AVC ischémiques. Les taux étaient plus élevés après un AVC cardio-embolique, un AVC de cause indéterminée et un AVC d’autre cause (16%, 18% et 19% respectivement) qu’après un AVC des grosses artères ou un AVC lacunaire (de l’ordre de 3%). Les données de létalité à 1 mois par sous-types d’AVC ischémiques sont rares 19,20,21,22. Dans notre étude, le taux de létalité à 28 jours pour les AVC des grosses artères (3%) fait partie des taux rapportés les plus bas (entre 3% et 17%), tandis que le pronostic favorable des AVC lacunaires est comparable à ceux retrouvés dans la littérature et ailleurs en France (entre 1% et 4%) 4,20. Enfin, une étude libanaise récente a retrouvé une létalité à 1 mois similaire pour les AVC cardioembolique (9 sur 53, 17%) et un taux plus faible pour les AVC de cause indéterminée (6 sur 45, 13%) 21. Par ailleurs, les décès du premier mois (28 jours) survenaient très rapidement, 50% au cours de la première semaine pour tous les AVC ischémiques, excepté pour les victimes d’AVC lacunaires, qui décédaient majoritairement au cours de la troisième semaine. Ces différences de létalité peuvent s’expliquer en partie par la physiopathologie de chaque AVC. Les AVC des grosses artères affectent des vaisseaux d’un diamètre supérieur à 1,5 cm et sont caractérisés par une sténose progressive de l’artère carotide interne extra-crânienne et les AVC lacunaires sont des occlusions de petites artères cérébrales d’un diamètre inférieur à 1,5 cm. Les AVC cardio-emboliques, quant à eux, sont caractérisés par une source embolique cardiaque de survenue plus soudaine 10.
L’étude de la survie limitée à 28 jours constitue une des limites de l’étude. Bien que la mortalité soit précoce après un AVC, d’autres études ont montré que 47% des décès suite à un AVC ischémique survenaient entre le 1er et le 12e mois mettant en évidence la nécessité de poursuivre la surveillance au-delà de 28 jours 8. Notons également que le registre ne recueille les AVC qu’au-delà de 24 heures, alors que certains s’observent après un déficit transitoire de 10 minutes.
Ensuite, nous n’avons pas pu corréler la létalité avec la gravité de l’AVC, appréciée au moyen d’un score, le NIHSS (National Institute of Health Stroke Score), car ces données ne sont recueillies dans le registre que depuis 2014. De même, les AVC de la tranche d’âge 18-35 ans n’étant recueillis que depuis 2016, leur effectif est encore trop faible pour pouvoir être étudié. Enfin les effectifs sur 10 ans sont encore relativement peu élevés limitant la puissance statistique pour l’analyse de l’évolution des taux de létalité, notamment en fonction du sexe, de l’âge et de l’étiologie des AVC. Notons cependant une augmentation de la prise en charge par thrombolyse (11% en moyenne sur la période 2008-2012 vs 16% entre 2013 et 2017, p<0,001) cohérente avec les restructurations organisées dans le cadre du Plan national AVC 23.
Le registre assure néanmoins un recueil exhaustif des évènements sur une aire géographique donnée incluant les cas extra– et intra-hospitaliers et le statut vital à 28 jours est extrêmement bien renseigné (seulement 4 personnes perdues de vue à 28 jours sur l’ensemble de la période).
Ces données sur une période récente de 10 ans permettent de compléter avec précision les informations existantes sur la mortalité par AVC en France. Elles contribuent à affiner les projections à l’échelle nationale obtenues à partir de statistiques de mortalité. À Lille, comme en Europe, le pronostic vital des AVC hémorragiques est plus grave que celui des AVC ischémiques chez les hommes et les femmes de 35 ans et plus. Parmi les AVC ischémiques, la létalité est plus importante après un AVC cardioembolique, de cause indéterminée et d’autres causes comparativement aux AVC des grosses artères et aux AVC lacunaires.
Remerciements
Nous tenons à remercier les enquêteurs pour leur précieuse contribution à la collecte et à la validation minutieuses des données, les médecins et les neurologues qui ont contribué à ce processus.
Liens d’intérêts
Les auteurs n’ont pas d’intérêts concurrents et ne se trouvent pas en situation de conflit d’intérêts par rapport au contenu de l’article.
Financements
Ces travaux ont été financés par Santé publique France, l’Inserm et l’Institut Pasteur de Lille.
Références
publiquefrance.fr/beh/2017/5/2017_5_2.html
A community-based incidence study. Lancet Neurol. 2007;6(2):140-8.
publiquefrance.fr/beh/2018/5/2018_5_2.html




