Évaluation de l’impact sur la santé reproductive masculine et des coûts associés de deux phtalates : le DEHP et le DINP
// Evaluation of the impact on male reproductive health and the associated costs of two phthalates: DEHP and DINP
Résumé
Les perturbateurs endocriniens (PE) sont suspectés d’engendrer un impact économique important pour la société en raison, entre autres, de leur toxicité sur le système reproducteur mâle. Cependant, la nature des coûts et leur estimation peuvent varier considérablement d’une étude à l’autre et les bases scientifiques qui sous-tendent ces estimations ne sont pas toujours explicites. Ainsi, des hypothèses fortes sont souvent partiellement justifiées par les auteurs, notamment en ce qui concerne la part des pathologies attribuables aux PE.
Pour cette étude, partant de l’hypothèse d’un lien de causalité établi entre une exposition in utero au DEHP et au DINP sur le système reproducteur masculin, nous proposons d’utiliser des données épidémiologiques propres à ces deux phtalates afin d’estimer l’impact, en France et en Europe, d’une exposition prénatale sur la santé reproductive masculine ainsi que les principaux coûts associés. Les paramètres de santé considérés sont une baisse de la qualité du sperme et une augmentation du risque de cryptorchidie et hypospadias. L’estimation de l’exposition s’appuie sur des données récentes d’imprégnation chez des femmes enceintes.
Les coûts annuels estimés à ce stade de l’étude sont inférieurs à ceux rapportés dans d’autres études. De plus, même si les données actuelles sont limitées, nos résultats montrent que l’impact sanitaire du DINP sur le système reproducteur mâle et le coût global associé pourraient être comparables à ceux du DEHP.
Ces résultats, si le lien de causalité est renforcé par des études complémentaires, peuvent questionner la pertinence de substituer le DINP au DEHP.
Abstract
Endocrine disruptors (EDCs) are suspected to induce a heavy economic burden on society due to costs associated with adverse effects on male reproduction. However, the type of costs and amounts reported in published assessments may considerably vary from one study to the other and the rationale behind these estimates is not always easy to understand. Some key assumptions made by the authors may be only partially justified, in particular concerning the estimated attributable fractions.
In this study, assuming a causal link between in utero exposure to DEHP and DINP and toxicity on the male reproductive system, we rely on recent epidemiological studies to evaluate the burden of diseases due to prenatal exposure to these two phthalates and the associated costs, in France and in Europe. The adverse effects on the male reproductive system considered for this study are a decrease in semen quality and an increased risk of cryptorchidism and hypospadias. Exposure assessment is based on results from recent biomonitoring studies measuring concentrations of phthalates in pregnant women.
On the basis of our hypothesis, the annual estimated costs are below those reported in other studies. Our results also show that, even if the data are still limited, the impact of DINP on the male reproductive function and the overall associated costs may be comparable to those induced by DEHP. These results, if the causality link is confirmed, may question the relevance of substituting DEHP for DINP.
Introduction
Les preuves concernant les effets des phtalates sur la fonction de reproduction masculine après une exposition in utero s’accumulent, notamment chez les rongeurs. Les effets des phtalates tels que cryptorchidie, hypospadias, infertilité et cancer du testicule sont généralement regroupés sous le terme de « syndrome de dysgénésie testiculaire » 1. Certains phtalates sont ainsi classés reprotoxiques selon le règlement Classification, Labelling, Packaging (CLP) en raison de cette reprotoxicité, à l’image du di(2-éthylhexyl) phtalate (DEHP). Son usage a de ce fait largement diminué depuis de nombreuses décennies et d’autres phtalates sont venus le remplacer, notamment le di-iso-nonyl phtalate (DINP). Or, des études récentes montrent que le DINP ne serait pas non plus dénué de toxicité sur la fonction de reproduction, ce qui peut soulever la question de l’intérêt de son utilisation comme substitut au DEHP.
Plusieurs approches sont possibles pour évaluer le bénéfice d’un substitut mais, dans le cadre du règlement Reach, l’approche bénéfice/risque est la plus utilisée. Cette approche vise à calculer l’ensemble des coûts liés à la substitution d’une molécule par une autre (ou par un procédé alternatif), ainsi que les bénéfices espérés en termes de santé publique, comme par exemple l’évitement de certaines pathologies ou une diminution de leur incidence. Pour estimer cette diminution, il est nécessaire de connaître la part attribuable de cette pathologie au phtalate incriminé, ce qui, idéalement, peut se faire à l’aide de données épidémiologiques propres à cette substance.
Or, dans la plupart des études qui ont jusqu’à présent calculé les coûts liés à une exposition aux phtalates, la part attribuable repose sur des hypothèses par défaut allant de 5% à 40% sans autre justification et sans être spécifique d’une substance donnée. Elles sont de ce fait difficilement utilisables dans un contexte réglementaire où un coût par substance doit être estimé. Seuls Hauser et coll. ont calculé une fraction attribuable à une exposition au dibutyl-phtalate (DBP) et au butylbenzyl-phtalate (BBzP) sur les problèmes de fertilité masculine et les coûts associés en Europe 2. Toutefois le rationnel qui sous-tend leur calcul n’est pas clairement explicité.
L’objectif de cette étude est double. Il s’agit, d’une part, de proposer une méthode spécifique pour estimer l’impact sanitaire en lien avec une exposition à des substances chimiques et évaluer les coûts associés à cet impact. Puis, d’autre part, d’appliquer la méthode retenue au DEHP et au DINP. Une analyse systématique de la littérature scientifique concernant les effets des phtalates sur la fonction de reproduction avait été conduite par l’Anses dans le cadre de ses travaux sur les perturbateurs endocriniens (1). La présente étude s’est basée sur cette revue. Des données épidémiologiques propres au DEHP et au DINP ont été utilisées pour estimer l’impact sanitaire, en France et en Europe, d’une exposition in utero sur la santé reproductive masculine et les principaux coûts associés. Les paramètres de santé considérés sont une baisse de la qualité du sperme et une augmentation du risque de cryptorchidie et hypospadias (tableau 1).
Méthodes
Calcul de l’impact sur la fertilité
L’approche retenue consiste à estimer l’impact par la charge attribuable de la maladie, calculée selon l’équation utilisée par Trasande et coll. 3.
Équation 1
Charge de la maladie attribuable (CMA) = Taux de la maladie × part attribuable × population à risque
Où :
Part attribuable (PA) = Prévalence expo*(RR-1)/ [1 + (prévalence expo*(RR-1))]
RR = OR / ((1-taux de la maladie) + (taux de la maladie*OR))
Pour estimer l’exposition de la population française de femmes enceintes au DEHP et au DINP, les données de l’étude Elfe ont été utilisées 4. Pour estimer l’imprégnation aux phtalates à l’échelle européenne, il n’a pas été possible d’utiliser les résultats de l’étude Democophes (http://www.eu-hbm.info/democophes) portant sur 17 pays européens, car elle n’incluait pas les métabolites du DINP. La stratégie a donc été de vérifier que, pour le DEHP, les niveaux d’exposition mesurés dans la cohorte Elfe et dans l’étude Democophes étaient comparables, dans l’objectif d’extrapoler pour le DEHP et le DINP les valeurs d’imprégnation de Elfe à l’ensemble des femmes enceintes en Europe. Pour le calcul de l’impact, pour chaque intervalle de percentiles, la concentration en métabolites du DEHP ou du DINP observée à la borne inférieure de l’intervalle a été appliquée à l’ensemble de la population de cet intervalle. Pour le calcul du nombre d’hommes infertiles suite à une exposition in utero au DEHP ou au DINP, le raisonnement suivi comprend trois étapes :
1) Calcul de l’excès de risque d’une réduction de la distance anogénitale (DAG) suite à une exposition in utero au DEHP et au DINP
Une diminution de la DAG est un effet fréquemment associé à une exposition aux phtalates pendant la grossesse et est un facteur de risque d’une diminution de la fertilité 5. Dans la publication de Swan et coll. 6, une diminution de 4,87% de la DAG est rapportée entre le groupe le plus exposé (90e percentile) et le groupe de référence (10e percentile) au MEHHP (métabolite du DEHP). Bornehag et coll. 7 ont également mesuré l’association entre l’exposition prénatale à 10 métabolites de phtalates, incluant le DEHP et le DINP, et la DAG chez 196 garçons suédois âgés de 21 mois. Des associations statistiquement significatives ont été mesurées pour la somme des métabolites du DINP (tableau 1). La diminution de la DAG attendue pour chacun des groupes pour lesquels les concentrations urinaires de phtalates correspondent aux 25e, 50e, 75e et 90e percentiles de la population de l’étude Elfe a été calculée.
2) Calcul de la baisse du nombre de spermatozoïdes
Le nombre de spermatozoïdes perdus en lien avec une diminution de la DAG a été calculé à partir des résultats de l’étude de Mendiola et coll. 8. Ces derniers ont rapporté une association entre la diminution de la DAG et une baisse de la concentration en spermatozoïdes chez 126 jeunes recrues de l’université de Rochester (NY). Une diminution de 1 mm de la DAG était associée à une baisse de la concentration de spermatozoïdes de 1,022 106/mL. Cette valeur a été utilisée pour calculer, pour chaque percentile d’exposition, la baisse de spermatozoïdes attendue après la puberté chez les garçons issus de mères exposées au DEHP/DINP pendant leur grossesse.
3) Calcul du nombre d’hommes infertiles suite à une exposition in utero au DEHP/DINP
L’oligospermie est la première cause d’infertilité masculine mais le risque de stérilité n’est pas connu 9. Bonde et coll. 10 ont estimé l’association entre la qualité du sperme et la probabilité de concevoir. Parmi les couples dont l’homme avait une concentration spermatique inférieure à 20 106/mL, seulement 36,4% ont pu concevoir pendant la durée du suivi de cette étude, ce qui correspond à un risque relatif d’être infertile de 1,8. Cette valeur a été retenue pour calculer le nombre d’hommes infertiles, en considérant une incidence basale de l’infertilité masculine en France à 12 mois de 8% 11. L’incidence basale correspond à l’incidence de la pathologie quelle que soit la cause.
Calcul de l’impact sur les malformations congénitales du système reproducteur masculin : cryptorchidie et hypospadias
Peu d’études épidémiologiques ont mesuré l’association entre une exposition prénatale aux phtalates et l’augmentation de l’incidence de cryptorchidies et d’hypospadias. Swan et coll. 12 et Jensen et coll. 13 ont rapporté une augmentation de l’incidence de garçons cryptorchides au sein de deux cohortes de mères exposées respectivement au DEHP (mesures urinaires) et au DINP (concentrations mesurées dans le liquide amniotique). Dans l’étude de Jensen et coll., une augmentation de l’incidence d’hypospadias a également été observée 13. Toutefois il convient de souligner que l’association rapportée n’était pas statistiquement significative (1,69 [0,73-3,67]). Aucune étude n’a, à notre connaissance, rapporté d’association positive avec le DEHP et une augmentation de l’incidence d’hypospadias.
Ces deux études ont été utilisées pour calculer, selon l’équation 1 ci-dessus, les parts attribuables de cryptorchidies et d’hypospadias pour le 90e percentile de la population exposée au DEHP et pour le 66e percentile de la population la plus exposée au DINP. Ces percentiles correspondent aux niveaux d’exposition supérieurs ou égaux à ceux ayant conduit à une association positive dans les deux études précitées 12,13 (tableau 1).
 Agrandir l'image
Agrandir l'imageLes chiffres illustrant le taux de base de ces pathologies dans la population sont issus des récents travaux de Santé publique France 14.
Estimation des coûts associés aux effets sur le système reproducteur masculin
Les coûts associés à l’augmentation de l’incidence de chacun de ces évènements de santé en lien avec une exposition au DEHP et au DINP ont été estimés à l’aide de l’équation suivante tirée de Trasande et coll. 3 :
Équation 2
Coûts attribuables = Charge de la maladie attribuable × coûts par cas
Les coûts attribuables résultent des hypothèses et calculs décrits ci-dessus. La population à risque correspond au nombre de garçons issus de mères exposées pendant leur grossesse au DEHP ou au DINP, à des concentrations susceptibles d’induire une toxicité sur leur descendance. Le nombre considéré de garçons nés en France en 2014 est de 400 000 (Ined (2)) et de 2 600 000 en Europe (Eurostat (3)).
Pour l’hypospadias et la cryptorchidie, les coûts directs correspondant aux traitements chirurgicaux subis par les garçons
atteints, les coûts indirects liés à l’absentéisme des parents devant s’occuper de leurs enfants et les coûts intangibles
liés aux conséquences sur la qualité de vie ont été estimés. Pour les cas d’infertilité, les coûts directs et indirects liés
à la mise en place d’une procréation médicalement assistée (PMA) ont été considérés, ainsi que les coûts intangibles liés
aux problèmes de fertilité masculine.
La figure 1 décrit les divers types de coûts pris en compte.
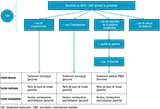 Agrandir l'image
Agrandir l'imageLes valeurs économiques utilisées pour ces calculs sont tirées de rapports récents 3,15,16,17,18 et sont résumées dans le tableau 2.
 Agrandir l'image
Agrandir l'imageRésultats
Infertilité : calcul de l’impact et des coûts associés
Comme le montre le tableau 3, le nombre de garçons nés chaque année de mères exposées pendant la grossesse au DEHP et pouvant présenter à l’âge adulte une concentration spermatique inférieure à 20×106/mL est de 3 110 en France et 27 990 en Europe. Ces effectifs s’élèvent, pour le DINP, à 3 503 hommes en France et 31 523 en Europe (tableau 4). Parmi ces hommes, le nombre estimé d’hommes infertiles est de 102 en France et 922 en Europe pour le DEHP, et 115 et 1 038 pour le DINP. Les coûts annuels associés sont estimés, en France, à 1,6 million € pour le DEHP et 1,8 million € pour le DINP et, en Europe, à 14,3 millions € et 16,1 millions €, respectivement.
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageCryptorchidie et hypospadias
Le nombre de garçons susceptibles chaque année d’être atteints d’une cryptorchidie suite à une exposition au DEHP et au DINP pendant la grossesse est présenté dans le tableau 5. Les coûts associés sont estimés en France à 8 millions € pour le DEHP et à 3 millions € pour le DINP et, en Europe, à 51 millions € pour le DEHP et 17 millions € pour le DINP.
Le nombre de garçons susceptibles de souffrir d’hypospadias suite à une exposition au DINP pendant la grossesse est présenté dans le tableau 6. Les coûts annuels associés sont estimés à 2 millions € en France et 11 millions € en Europe.
Ces résultats indiquent qu’une exposition fœtale au DEHP ou au DINP est susceptible d’engendrer des coûts annuels pour la société, en France, d’un total de 9,4 millions € pour le DEHP contre 6,1 millions € pour le DINP, et en Europe de 65,3 millions € contre 44,1 millions € (figures 2a et 2b), suite aux possibles anomalies du système reproducteur masculin pouvant être induites.
 Agrandir l'image
Agrandir l'imageLes chiffres estimés dans cette étude montrent par ailleurs que, même si les coûts liés au DINP sont plus faibles que ceux liés au DEHP, ils restent importants, ce qui pose la question de l’intérêt d’un remplacement du DEHP par le DINP.
Discussion
Ce travail fournit pour la première fois une estimation spécifique des nombres de cas et des coûts attribuables à l’exposition prénatale au DEHP et au DINP, de par ses effets sur la santé reproductive de l’homme. L’étape préalable à une telle estimation consiste à s’assurer de l’existence d’un réel lien causal entre exposition prénatale aux phtalates et santé reproductive masculine. Le lien de causalité entre une exposition prénatale aux phtalates classés reprotoxiques, comme c’est le cas pour le DEHP, semble fortement suggéré. La plausibilité d’une telle relation ne s’appuie toutefois pas uniquement sur des données épidémiologiques, qui sont aujourd’hui encore insuffisantes pour conclure à un lien de causalité. Le recours à des données animales permet de renforcer le poids des preuves de l’existence d’un tel lien.
L’estimation économique de l’impact sanitaire d’une exposition in utero au DEHP et au DINP telle que réalisée dans cette étude s’appuie sur les calculs de parts attribuables issues d’études épidémiologiques récentes, propres à ces deux substances. Cependant, une limite de ce travail est de s’appuyer sur un risque extrait d’une seule étude épidémiologique, parfois sans significativité statistique 13. Cette situation s’explique par le nombre insuffisant de données épidémiologiques de bonne qualité sur ces questions. Ainsi, il est possible que ceci ait conduit à une majoration des coûts estimés.
Nos estimations sont compatibles avec celles publiées dans d’autres rapports 15,16 sous l’hypothèse basse d’une fraction attribuable de 2%, mais beaucoup plus faibles que celles avancées par Hauser et coll. 2 qui considèrent que, suite à une exposition au DBP ou au BBzP, 618 000 hommes infertiles auront recours à une PMA, pour un coût annuel total de 4,7 milliards €. Cet écart important est certainement dû à la manière différente d’estimer la fraction attribuable pour l’infertilité.
Les associations positives entre une exposition au DINP et une augmentation de l’incidence des cas de cryptorchidies et hypospadias ont été mesurées à partir de concentrations dans le liquide amniotique 13. Or pour estimer l’exposition de la population française et européenne au DINP et calculer l’impact sanitaire, nous avons utilisé les concentrations urinaires publiées dans Elfe. En effet, chez l’Homme, les mesures de concentration de phtalates et métabolites dans le liquide amniotique sont anciennes et assez peu nombreuses. Les données disponibles sur le DEHP montrent une bonne corrélation chez l’Homme comme chez l’animal 19,20.
Si une origine fœtale de malformations congénitales telles que l’hypospadias et la cryptorchidie semble assez évidente, il en va différemment pour une diminution de la fertilité qui survient à l’âge adulte. Le syndrome de dysgénésie testiculaire reste à ce jour non démontré chez l’homme mais les preuves de son existence s’accumulent 21. Une diminution de la DAG a d’ailleurs été, chez l’Homme comme chez l’animal, reliée à une diminution de la qualité du sperme 5.
Il subsiste toutefois une incertitude forte quant au lien entre la qualité du sperme et le risque d’infertilité au sein d’un couple. Il convient donc d’interpréter ces résultats avec prudence. L’un des paramètres sensibles dans l’estimation de la fraction attribuable est l’incidence basale de ces pathologies parmi la population française et européenne. Or les données publiées sur ce sujet montrent des valeurs très disparates. Par exemple, l’infertilité en France varie beaucoup selon qu’on la mesure à 6 mois, 12 mois ou 24 mois ; l’incidence des cryptorchidies varie également selon que l’on comptabilise celles traitées chirurgicalement ou non, selon l’âge de l’enfant, etc. Ce paramètre étant directement relié au calcul de la fraction attribuable (équation 1 ), il constitue un paramètre sensible dans cette étude et mériterait de ce fait d’être consolidé au niveau européen.
Pour estimer les coûts directs et indirects de ces pathologies, nous avons utilisé les données issues d’études scandinaves et reprises dans des rapports récents chiffrant les coûts des PE pour la société 3,15,16,17. Disposer de valeurs représentatives de toute l’Europe aurait permis d’améliorer la précision des estimations. De plus, les coûts directs et indirects ne permettent pas de capturer tous les coûts liés à ces évènements de santé, c’est pourquoi nous avons choisi d’inclure aussi les coûts intangibles qui ont été estimés selon la méthode du consentement à payer 17. Une force de ce travail est aussi d’avoir inclus ces coûts intangibles, non seulement pour la cryptorchidie et l’hypospadias mais aussi pour l’impact sur la fertilité, ce qui est novateur. Un certain niveau d’incertitude associée à ces estimations demeure néanmoins. Il serait utile à l’avenir de disposer de nouvelles données afin d’affiner les estimations à l’échelle européenne.
En plus des effets sur le système reproducteur masculin, une exposition aux phtalates pendant la grossesse pourrait induire d’autres effets sur les enfants tels que des désordres métaboliques, des problèmes de comportement, des cancers hormono-dépendants. Nos estimations n’incluent pas les coûts associés à ces effets et les résultats sont de ce fait probablement sous-estimés.
En conclusion, outre la valorisation économique des effets sur la santé, l’intérêt de ce travail a été également de proposer une méthode d’analyse de l’impact des substances chimiques, pouvant être appliquée dans un cadre réglementaire, tel que le règlement Reach par exemple.
La question de l’intérêt de substituer le DINP au DEHP peut se poser, en raison du coût que ce dernier pourrait faire peser sur la société si ses effets sur le système reproducteur des garçons exposés pendant leur vie fœtale étaient confirmés. Avant d’engager le remplacement d’un composé considéré reprotoxique par une autre substance, il conviendrait de systématiquement s’assurer que les bénéfices attendus de cette substitution, en termes de réduction de l’impact sur la santé, sont supérieurs aux coûts engendrés par la substitution.
Remerciements
Les auteurs tiennent à remercier Sandrine Fraize-Frontier (Anses) pour son appui sur les calculs statistiques.
Références
outcomes_2_en.pdf
Citer cet article
/files/SUBCHIM2009sa0331Ra-106.pdf






