L’incidence de la puberté précoce centrale idiopathique en France révèle une hétérogénéité géographique importante*
// The incidence of idiopathic central precocious puberty in France indicates a marked geographic pattern
Résumé
Introduction –
La puberté précoce est suspectée d’être favorisée par une exposition aux perturbateurs endocriniens (PE) et son incidence a été retenue, par un panel de scientifiques au niveau international, comme étant un indicateur-clé à surveiller. Elle se manifeste par des signes de puberté avant l’âge de huit ans chez les filles et de neuf ans chez les garçons. Les filles sont 10 fois plus souvent atteintes que les garçons. La forme la plus fréquente est la puberté précoce centrale idiopathique (PPCI) et son traitement est spécifique, par agonistes de la GnRH. L’objectif était d’estimer, pour la première fois, l’incidence de la PPCI en France métropolitaine et d’en analyser les tendances géographiques.
Méthodes –
Un indicateur reflétant les cas incidents d’enfants traités par agonistes de la GnRH a été construit à partir des données du Sniiram pour la période 2011-2013. Quatre modèles spatiaux prédictifs ont été testés pour analyser les tendances spatiales et estimer les taux d’incidence.
Résultats –
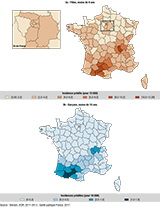
Le taux d’incidence national était de 2,68 [IC95%: 2,55-2,81] pour 10 000 filles (1 173 nouveaux cas/an) et de 0,24 [0,21-0,27] pour 10 000 garçons (117 nouveaux cas/an). Chez les filles et chez les garçons, on observe une hétérogénéité spatiale structurée (écarts d’incidence de 1 à 12 chez les filles), géographiquement concordante, avec des surincidences marquées en Midi-Pyrénées et Rhône-Alpes.
Conclusions –
Les estimations d’incidence de la PPCI en France sont comparables à celles d’autres études à l’étranger. L’hétérogénéité spatiale observée suggère qu’il existe des facteurs de risque environnementaux qui justifient des investigations plus poussées.
Abstract
Introduction –
Endocrine disruptors (EDs) exposure is suspected to promote precocious puberty (PP) and an international panel of experts highlighted PP incidence as a core reproductive outcome for monitoring in the context of ED exposure. This disease is defined by the occurrence of pubertal development before the age of eight years in girls and nine years in boys. It is ten times more frequent in girls than in boys. The most frequent subtype is idiopathic central precocious puberty (ICPP), specifically treated with GnRH agonists. Our aim was to estimate for the first time ICPP incidence in France and to analyze its spatial trends.
Methods –
We analyzed an indicator reflecting incident child cases treated with GnRH agonists, recorded in the national insurance database (SNIIRAM) between 2011 and 2013 in mainland France. We tested four predictive spatial models to analyze spatial trends and estimate incidence rates.
Results –
The national annual incidence was 2.68 [95%CI: 2.55-2.81] per 10,000 girls (1 173 new cases annually) and 0.24 [95%CI: 0.21-0.27] per 10,000 boys (117 new cases annually). Incidence rates in girls and boys conformed to a pure spatial heterogeneity model, geographically consistent, with incidence peaks in the Midi-Pyrénées et Rhône-Alpes regions.
Conclusion –
Estimated of ICPP incidence rates in France are comparable to the data reported in studies abroad. The spatial heterogeneity suggests environmental risk factors and justifies further investigations.
Introduction
La puberté précoce (PP) pathologique se manifeste par des signes de puberté avant l’âge de huit ans chez les filles et de neuf ans chez les garçons. Elle se traduit chez les filles par le développement des seins et des caractères sexuels secondaires puis par la survenue des règles et, chez les garçons, par l’augmentation du volume des testicules puis par la survenue de la mue vocale et le développement de la pilosité pubienne. La puberté précoce entraine une accélération de la vitesse de croissance et une accélération de la maturation osseuse, avec risque de soudure prématurée des cartilages de croissance et réduction de la taille à l’âge adulte. Elle expose aussi à une augmentation du risque de troubles psychologiques, et des études épidémiologiques ont mis en évidence une augmentation du risque de cancers des organes reproductifs et de maladies cardiovasculaires 1.
Les filles sont 10 fois plus souvent atteintes que les garçons 2. Il existe très peu de données épidémiologiques au niveau international sur cette maladie, dont on suspecte l’augmentation d’incidence. Une telle augmentation a été observée par exemple en Corée du Sud 3.
La PP peut être d’origine centrale (figure 1), par activation prématurée de l’axe hypothalamo-pituitaire due à une affection cérébrale (tumeur, irradiation, traumatisme), ou périphérique, liée à des mutations génétiques rares, des tumeurs ovariennes ou surrénaliennes ou une hyperplasie congénitale des surrénales 2. La forme la plus fréquente de PP est la puberté précoce centrale idiopathique (PPCI), c’est-à-dire d’origine centrale, sans cause identifiée. Elle représente plus de 90% des cas chez les filles 2 et son traitement spécifique par agonistes de la GnRH permet d’interrompre la puberté jusqu’à l’âge normal. Chez les garçons, les PP périphériques sont plus fréquentes que chez les filles, mais les données épidémiologiques sont encore plus rares.
Les facteurs de risque connus de la PP sont le surpoids, un contexte d’adoption internationale et des mutations génétiques spécifiques 1. La PP est suspectée d’être favorisée par une exposition précoce aux PE et son incidence a été retenue, par un panel de scientifiques au niveau international 4, comme étant un indicateur-clé à surveiller.
L’objectif de cette étude était d’estimer pour la première fois l’incidence de la PPCI en France et d’en analyser les tendances géographiques.
Méthodes
Données
Les données sont issues du Système national d’information inter-régimes de l’Assurance maladie (Sniiram) et plus particulièrement du DCIR (Datamart des consommations inter-régime). Le DCIR couvre l’ensemble des données de remboursements de soins d’environ 98% de la population française, tous régimes confondus 5. Il permet de repérer les délivrances des médicaments remboursés, identifiés par leurs dates et leurs classifications ATC (anatomique, thérapeutique et chimique). L’âge, le sexe, le département et la commune de résidence sont également disponibles pour chaque bénéficiaire. L’appariement avec les données d’hospitalisation du Programme de médicalisation des systèmes d’information (PMSI) permet de récupérer des informations médicales codées selon la CIM-10 (Classification internationale des maladies – 10e révision) 5. L’accès aux données du Sniiram a été autorisé par l’Institut des données de santé et par la Commission nationale de l’informatique et des libertés.
Indicateur de la PPCI
Un indicateur 6,7 a été construit pour refléter les cas incidents d’enfants traités pour une puberté précoce centrale, à partir de la première délivrance d’agoniste de la GnRH remboursée, chez les filles âgées de moins de 9 ans et les garçons de moins de 10 ans, soit un an de plus que l’âge limite de la PP, en prenant en compte un délai possible d’un an –au plus– entre le début des signes de PP et la mise en place du traitement. Un cas était considéré comme incident l’année n s’il n’avait pas eu de délivrance d’agoniste de la GnRH l’année n-1. Les cas dont l’appariement avec les données du PMSI a identifié un séjour hospitalier avec un code CIM-10 relatif à des lésions du système nerveux central ou périphérique 2 ont été exclus, ainsi que les cas traités par hydrocortisone pour une cause périphérique (hyperplasie congénitale des surrénales). Le chaînage a été réalisé selon les règles de l’art préconisées par la CnamTS, et les traitements ont été supervisés par un référent de Santé publique France extérieur à l’étude. Les limites techniques potentielles ont été examinées 6, par exemple les doublons possibles pour un enfant assuré à la fois par son père et sa mère, et elles ont été estimées négligeables sur l’ensemble des cas. L’indicateur de PPCI ainsi construit a été analysé sur la période 2011-2013 chez les enfants résidant en France métropolitaine.
Analyse des données
Les données ont été décrites selon le sexe et le groupe d’âge sur l’ensemble de la période, en considérant trois groupes d’âge : [0-7], ]7-8], ]8-9] ans pour les filles et [0-8], ]8-9], ]9-10] ans pour les garçons. L’âge était défini au moment de la première délivrance d’agoniste de la GnRH.
Une analyse spatiale de l’incidence des PPCI a été réalisée à l’échelle départementale (département de résidence des cas) sur l’ensemble de la période 2011-2013. Trois analyses ont été menées : tous âges chez les filles, tous âges chez les garçons, et par groupe d’âge chez les filles. Quatre modèles spatiaux prédictifs ont été testés 8 pour analyser les tendances spatiales et estimer les taux d’incidence : (1) une simple moyenne basée sur une hypothèse d’homogénéité sur l’ensemble du territoire ; (2) une hétérogénéité non structurée ; (3) une hétérogénéité structurée purement spatiale ; (4) un modèle combinant les deux modèles précédents. Le DIC (critère d’information de déviance) a été utilisé pour sélectionner le modèle qui correspond le mieux aux données.
Les incidences nationale et départementale (rapport du nombre de cas sur la population de référence) ont été prédites (intervalles de crédibilité (IC) à 95%), avec le meilleur modèle selon le DIC et en utilisant le nombre de personnes-années (population moyenne annuelle) de l’Insee. Les résultats obtenus avec le modèle ont été intégrés au logiciel ArcGIS version 10.0 (ESRI©), pour être cartographiés.
Entretiens semi-directifs
Afin d’identifier d’éventuelles différences géographiques dans les pratiques de prise en charge de la PP, des entretiens semi-directifs ont été réalisés en mars 2016 auprès de cinq équipes hospitalières de pédiatres-endocrinologues. Ces équipes ont été sélectionnées sur des critères uniquement géographiques, dans des zones d’incidence variée (faible, moyenne ou forte incidence) et dans différentes zones de la France métropolitaine, pour couvrir diverses parties du territoire. Chaque entretien, d’une durée de deux heures, a été mené au moyen d’un guide standardisé développé avec l’aide d’un anthropologue-sociologue. Les entretiens abordaient toutes les étapes de la prise en charge : recrutement des patients, pratiques diagnostiques et thérapeutiques et les facteurs qui les déterminent dans chacune des régions concernées. Les contenus recueillis ont permis de discuter les résultats.
Résultats
Description des cas
Nous avons identifié 3 519 filles et 352 garçons avec une PPCI traitée sur la période 2011-2013 en France métropolitaine, ce qui correspond à 1 173 nouveaux cas par an chez les filles et 117 chez les garçons. Les cas de PPCI étaient 10 fois plus fréquents chez les filles que chez les garçons. Dans les deux sexes, le groupe d’âge le plus jeune représentait environ 16% des cas (tableau). Le nombre de cas augmentait avec l’âge dans les deux sexes (figure 2).
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageTaux d’incidence annuelle estimés
Le taux national d’incidence de PPCI chez les filles âgées de 0 à 9 ans, modélisé et moyenné sur trois années (2011-2013) pour la France métropolitaine, était estimé à 2,68/10 000 filles [IC95%: 2,55-2,81]. Les taux d’incidence pour 10 000 filles augmentaient avec l’âge : 0,62 [0,57-0,69] chez les ]0-7] ans ; 9,56 [8,84-10,26] chez les ]7-8] ans ; 11,7 [10,89-12,57] chez les ]8-9] ans.
Chez les garçons âgés de 0 à 10 ans, le taux d’incidence était de 0,24/10 000 garçons [0,21-0,27]. Le faible nombre de cas chez les garçons n’a pas permis d’appliquer le modèle par groupe d’âge.
Analyse spatiale
Pour les trois analyses spatiales, le meilleur modèle identifié par le DIC était une hétérogénéité géographique structurée ou « pure ». Le motif géographique était identique dans les deux sexes, et cohérent chez les filles dans les différentes tranches d’âge, avec des excès d’incidence dans les zones Midi-Pyrénées et Rhône-Alpes (figure 3). Les écarts d’incidence étaient particulièrement marqués dans les deux sexes : de 0,96 à 12,39 (filles) et de 0,117 à 1,72 (garçons) pour 10 000. Les écarts étaient croissants en fonction des tranches d’âge chez les filles (figure 4).
 Agrandir l'image
Agrandir l'image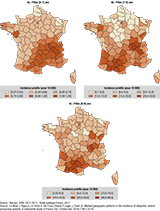 Agrandir l'image
Agrandir l'imageDiscussion
Cette étude a estimé, pour la première fois en France, l’incidence annuelle de la PPCI pour la période 2011-2013 et ses tendances géographiques en France métropolitaine. Elle repose sur un indicateur spécifique de la PPCI, construit à partir de données de délivrance de médicaments exhaustives et couvrant l’ensemble du territoire 6,7. La force de cette étude est l’utilisation d’une modélisation spatiale à l’échelle départementale, qui a permis d’observer une hétérogénéité géographique structurée. Elle se traduit par un motif géographique, similaire chez les filles et les garçons, ce qui suggère des facteurs de risque communs dans les deux sexes.
Taux d’incidence national
Le taux d’incidence national chez les filles de notre étude (2,68/10 000) est dans la fourchette de celui obtenu par simple extrapolation aux États-Unis, de 1/5 000 à 1/10 000 9. Au niveau mondial, seulement trois études ont estimé l’incidence de la PPCI au moyen de données nationales 3,10,11. Nos résultats sont proches de ceux d’une étude danoise 10, qui a utilisé les données de registres nationaux, avec les mêmes critères d’inclusion pour l’âge sur la période 1993-2001. Le sexe ratio filles/garçons était de 15. Une autre étude, menée en Espagne 11 à partir des données de 34 services d’endocrinologie pédiatrique, a estimé l’incidence annuelle de la PP centrale, les deux sexes confondus, entre 0,002 et 0,107/10 000 pour la période 2008-2009, ce qui est très inférieur à nos résultats. L’exhaustivité des données n’était pas assurée puisque la participation reposait sur le volontariat. De plus, les critères d’inclusion pour l’âge étaient inférieurs d’un an aux nôtres, ce qui peut expliquer en partie cette différence car 49% des cas féminins étaient dans la dernière tranche d’âge dans notre étude. La troisième étude, sud-coréenne 3, a utilisé comme la nôtre les données de délivrance de médicaments du système d’assurance maladie pour estimer le taux annuel d’incidence nationale de la PP centrale, sur la période 2004-2010. Ce taux augmentait chez les filles de 0,33 à 5,04/10 000, et chez les garçons de 0,03 à 0,12/10 000 sur la période. En 2010 les résultats sont du même ordre de grandeur que les nôtres, les différences pouvant au moins en partie s’expliquer dans l’étude sud-coréenne par des critères d’âges plus restrictifs et le fait que les causes connues de PPC n’ont pas été exclues.
Tendances spatiales
En ce qui concerne l’interprétation des tendances géographiques, plusieurs hypothèses peuvent être discutées. Tout d’abord, il est à noter que la région Île-de France, la plus peuplée du territoire et qui concentre aussi d’importantes ressources hospitalières, présente une incidence faible/moyenne pour la PPCI, ce qui n’oriente pas vers une hypothèse liée aux pratiques médicales, qui seront discutées dans les limites.
La puberté précoce peut être liée à des facteurs génétiques spécifiques 2, et des facteurs ethniques/populationnels pourraient aussi jouer un rôle. En effet, un gradient Nord-Sud a été observé en Europe pour l’âge des règles et l’âge de développement des seins 12 et il y a eu une forte immigration espagnole en zone Midi-Pyrénées 13. Même si l’incidence de la PPC en Espagne ne paraît pas élevée 11, ce facteur mériterait d’être exploré. La zone Rhône-Alpes a également une forte population d’immigrants d’origines diverses, bien qu’en moindre proportion qu’en Île-de-France 13.
Les résultats pourraient en partie refléter, à l’échelle nationale, ce gradient Nord-Sud, lequel pourrait aussi être en relation avec des causes environnementales. Une étude française a récemment suggéré que l’exposition à la lumière dans l’enfance influencerait la maturation sexuelle chez les femmes 14. Ce facteur n’a pas été étudié chez les garçons. Toutefois, le motif géographique de la PPCI est discordant dans le sud-est de la France et il est peu probable que ce facteur seul puisse expliquer les importants écarts d’incidence observés.
Les autres facteurs de risque connus pour la PP sont le surpoids et l’adoption internationale 2,15. Les zones à forte incidence de PPCI ne sont pas connues pour être à forte incidence de surpoids 16. Il n’a pas été possible dans cette étude d’analyser le contexte d’adoption.
L’hétérogénéité spatiale structurée suggère une distribution géographique particulière des facteurs de risques, compatible avec des facteurs environnementaux présents sur des surfaces étendues. Le rôle d’une exposition environnementale à des substances potentiellement perturbatrices endocriniennes et pouvant être d’origine anthropique est à prendre en considération, sans exclure des facteurs environnementaux non encore identifiés. En effet, la zone Midi-Pyrénées est riche en cultures variées (vignes, fruits, légumes, céréales) et élevage. Elle détient la première place en France en termes de nombre d’exploitations agricoles, avec une proportion élevée de petites propriétés, et la deuxième en termes de surface agricole utile 17. La zone Rhône-Alpes, densément peuplée comme la précédente, présente un profil similaire du point de vue agricole : considérée comme « le verger de la France » 18, elle est aussi industrielle avec le « couloir de la chimie ». Mais l’hypothèse des liens entre pression agricole ou industrielle et incidence de pathologies n’est pas simple à démontrer. On peut aussi remarquer que d’autres zones riches en cultures permanentes (vignes, arboriculture), comme les zones Aquitaine, Provence-Alpes-Côte-d’Azur ou Languedoc-Roussillon, ne présentent pas de surincidence marquée en PPCI.
Limites
L’indicateur d’incidence utilisé reposant sur la première délivrance d’agoniste de la GnRH, il ne prend pas en compte les PPCI non diagnostiquées ou non traitées. Inversement, certaines filles traitées, incluses dans la tranche d’âge ]8-9] ans, peuvent avoir eu les premiers signes de puberté dans leur 8e année : il peut donc s’agir de pubertés avancées et non de pubertés précoces, de même pour certains garçons de la tranche d’âge ]9-10] ans. Cependant, le délai maximal que nous avons considéré, d’un an entre le début des signes de puberté et la première délivrance d’agoniste de la GnRH, prend aussi en compte les diagnostics retardés, particulièrement fréquents chez les garçons.
Les entretiens cliniques ont établi que le consensus sur la prise en charge de la PP 19 était globalement suivi de façon homogène en France chez les garçons et les filles de moins de 7 ans. Cependant, chez les filles dans les tranches d’âge ]7-8] ans et ]8-9] ans, quelques différences de prise en charge qui ont pu jouer un rôle en surévaluant ou sous-évaluant l’incidence ont été identifiées : différences relatives au circuit de recrutement des patients ou de surveillance avant traitement. Toutefois, il est difficile de cerner si ces différences sont la cause ou la conséquence (adaptation des équipes) d’un nombre particulièrement important/faible de cas. De plus, dans une des zones à forte incidence, une équipe utilisait, pour le diagnostic de la PP centrale, le dosage des hormones à partir des urines des 24h – au lieu du test de stimulation LH-RH préconisé – ceci pouvant conduire à traiter jusqu’à 10% de cas en plus 20, ce qui est peu par rapport aux écarts d’incidence observés.
En conclusion, les tendances spatiales sont donc particulièrement robustes pour les garçons et les filles avant 7 ans. Le motif géographique marqué est concordant dans les différentes tranches d’âge chez les filles et chez les garçons. L’hétérogénéité spatiale observée suggère qu’il existe des facteurs de risque environnementaux qui justifient des investigations plus poussées afin de recenser ces différents facteurs.
Déclaration d’intérêt
Jean-Claude Carel a reçu une subvention de recherche d’Ipsen et un financement de Sandoz pour un déplacement professionnel.