Analyse combinée des quatre indicateurs du syndrome de dysgénésie testiculaire en France, dans le contexte de l’exposition aux perturbateurs endocriniens : cryptorchidies, hypospadias, cancer du testicule et qualité du sperme
// Combined analysis of the four indicators of testicular dysgenesis syndrome in France, in the context of exposure to endocrine disruptors: cryptorchidias, hypospadias, testicular cancer and sperm quality
Résumé
Introduction –
Le syndrome de dysgénésie testiculaire (testicular dysgenesis syndrome, TDS) est un trouble du développement des testicules pouvant conduire à des malformations congénitales (hypospadias, cryptorchidies) chez le garçon, un risque accru de cancer du testicule et une mauvaise qualité du sperme à l’âge adulte, qui constituent les quatre composantes du syndrome. Il pourrait-être favorisé par une exposition précoce aux perturbateurs endocriniens (PE) et a été listé par un panel de scientifiques au niveau international comme l’un des indicateurs-clés à surveiller dans le contexte de l’exposition aux PE.
Méthodes –
Nous avons analysé les variations temporelles et géographiques de quatre composantes du TDS. Des indicateurs épidémiologiques relatifs à ces composantes ont été construits à partir de bases de données nationales existantes (Programme de médicalisation des systèmes d’information – PMSI, et Registre national des fécondations in vitro de l’association Fivnat) et étudiés sur des périodes comparables, afin de discuter le rôle d’une exposition environnementale aux PE.
Résultats –
Les variations temporelles des quatre indicateurs sont convergentes. Elles montrent, sur les périodes d’étude, une détérioration marquée, et pas de tendance nette pour les hypospadias. En revanche les variations géographiques sont globalement non convergentes.
Conclusions –
Les résultats reflètent une altération globale de la santé reproductive masculine en France, cohérente avec la littérature internationale. Ils sont compatibles avec des changements environnementaux ou de modes de vie, parmi lesquels l’exposition croissante aux PE de la population générale. À ce stade, ils ne permettent pas d’argumenter un rôle éventuel d’expositions géographiquement déterminées.
Abstract
Introduction –
Testicular dysgenesis syndrome (TDS) is a testicular development disorder that can lead to congenital malformations (hypospadias, cryptorchidias) in boys, an increased risk of testicular cancer, and poor semen quality at adulthood, which constitute the four components of the syndrome. It could be stimulated by early exposure to endocrine disruptors (ED) and has been listed by a panel of international scientists as one of the key indicators to monitor in the context of exposure to endocrine disruptors.
Methods –
We analyzed the temporal and geographical variations of the four components of the TDS. Epidemiological indicators for these components were constructed from existing national databases (Medicalized information System Program – PMSI), and the Fivnat Association’s National Registry of In Vitro Fertilization) and studied over comparable periods to discuss the role of environmental exposure to EDs.
Results –
The temporal variations of the four indicators are convergent. Over the study periods, they show a marqued deterioration and no clear trend for hypospadias. On the other hand, the geographical variations are globally non-convergent.
Conclusions –
The results reflect an overall deterioration of male reproductive health in France, consistent with the international literature. They are conform to environmental or lifestyle changes, including increasing exposure to EDs in the general population. At this stage, they do not allow to argue a possible role of geographically determined exposures.
Introduction
Le syndrome de dysgénésie testiculaire (testicular dysgenesis syndrome ou TDS) a été introduit par le Danois Niels Skakkebaek 1 pour décrire un trouble du développement des testicules pouvant conduire chez le garçon à : des malformations congénitales – hypospadias (malformation de l’orifice urétral) et cryptorchidies (non descente des testicules) –, un risque accru de cancer du testicule et une mauvaise qualité du sperme à l’âge adulte. Il pourrait être favorisé par une exposition précoce (vie intra-utérine et périnatale) aux perturbateurs endocriniens (PE), et des arguments biologiques, expérimentaux et épidémiologiques appuient cette hypothèse 2,3. En dehors des pays scandinaves, peu de données épidémiologiques sont disponibles à une échelle nationale sur les composantes de ce syndrome qui est encore controversé 4, et dont les contours mêmes évoluent selon ses concepteurs 5. Les indicateurs du TDS ont été listés, par un panel de scientifiques, parmi les indicateurs-clés de santé reproductive à surveiller dans le contexte de l’exposition aux PE, sur la base du poids des preuves pour leur lien possible avec l’exposition aux PE 6 (voir encadré). En France, les autorités sanitaires ont saisi en 2009 Santé publique France pour analyser les variations spatiales et temporelles de ces indicateurs, et ils sont désormais suivis à l’échelle nationale au moyen des bases de données existantes disponibles. La surveillance des indicateurs de santé en lien possible avec les PE est inscrite dans la Stratégie nationale sur les perturbateurs endocriniens et le Programme national santé environnement ; elle est également recommandée par l’Organisation mondiale de la santé 3.
Est présentée ici une analyse combinée temporelle et spatiale des quatre indicateurs du TDS (qualité du sperme, cryptorchidies, hypospadias, cancer du testicule) à l’échelle nationale, pour se doter d’une vue globale de la santé reproductive masculine, confronter les résultats avec l’hypothèse de l’exposition aux PE et discuter d’éventuelles autres hypothèses. Ces résultats constituent un premier bilan des informations disponibles, appelé à être complété et affiné avec la poursuite de la surveillance. Les résultats concernant la qualité du sperme sont issus d’articles princeps publiés en anglais, pour les tendances temporelles 7 et pour les tendances temporo-spatiales 8. Le lecteur pourra s’y reporter pour davantage de détails.
Surveillance des indicateurs de santé reproductive dans le contexte de l’exposition aux perturbateurs endocriniens : quel cadre et quels indicateurs ?
Les scientifiques du réseau international Hurgent (Human Reproductive Health and General Environment Network) (i) ont défini le cadre et les objectifs de la surveillance épidémiologique d’indicateurs de santé reproductive dans le contexte de l’exposition aux perturbateurs endocriniens (PE) et ont priorisé les indicateurs à surveiller. L’ensemble de ces résultats a fait l’objet d’une publication scientifique (ii).
La finalité de cette surveillance est de fournir des connaissances scientifiques robustes, en appui aux politiques publiques de gestion, en particulier pour aider à estimer l’impact sanitaire et les coûts de l’exposition aux PE, et d’être capable, dans le futur, d’évaluer l’impact des interventions. Les objectifs opérationnels sont de quantifier les problèmes, analyser les tendances temporelles et spatiales des indicateurs surveillés, discuter les hypothèses causales et documenter ou pas une altération globale de la santé reproductive.
Le périmètre de la surveillance découle de la définition de la santé reproductive de l’Organisation mondiale de la santé (OMS) (iii), et il englobe les pathologies des organes reproductifs, dont les cancers et les malformations urogénitales, les caractéristiques biologiques et les effets reproductifs transgénérationnels. Deux critères ont été retenus pour sélectionner les indicateurs à surveiller : d’une part la pertinence quant au lien possible avec une exposition aux PE (avec un focus sur les indicateurs pouvant cadrer avec le concept de l’origine développementale de la santé et des maladies) et, d’autre part, la faisabilité, à examiner pour les indicateurs pertinents.
La sélection des indicateurs pertinents a été faite à partir de 23 indicateurs potentiels (iv) de santé reproductive. Deux rapports institutionnels sur l’état des connaissances entre les PE et leurs effets sanitaires ont été utilisés pour estimer le poids des preuves : le rapport conjoint de l’OMS et du Programme des Nations Unies pour l’environnement (Unep) (v) et le rapport Kortenkamp publié par la Commission européenne (vi). Les indicateurs-clés retenus sont : incidence du cancer de la prostate, du sein, sex-ratio à la naissance, incidence de l’endométriose et des fibromes utérins, composantes du syndrome de dysgénésie testiculaire (qualité du sperme, incidence du cancer du testicule, des cryptorchidies et hypospadias), incidence de la puberté précoce, niveaux biologiques des hormones reproductives.
Dans la perspective d’un travail collaboratif international, l’étape suivante est d’examiner la faisabilité en vue d’une mise en œuvre. Pour sa part, Santé publique France met déjà en place au niveau français une surveillance épidémiologique des indicateurs priorisés, à partir de bases de données existantes, si possible pérennes, couvrant l’ensemble du territoire. Cette démarche est inscrite dans la Stratégie nationale sur les perturbateurs endocriniens et le 3e Plan national santé environnement, et elle fait l’objet de recommandations de l’OMS (vii). Certains des indicateurs priorisés sont déjà étudiés au sein de l’agence (cf. articles de J. Le Moal et A. Rigou dans ce BEH), d’autres font l’objet de travaux exploratoires (endométriose et fibromes utérins, sex-ratio). De plus, un élargissement à d’autres fonctions endocrines à surveiller dans le contexte de l’exposition aux PE est en cours : troubles thyroïdiens et du neuro-développement notamment.
(i) À la suite d’un atelier international organisé par Santé publique France : Human reproduction disorders ans exposure to endocrine
disrupting cheminals (EDC): which reproductive health monitoring systems for the future? http://invs.santepubliquefrance.fr/Actualites/Agenda/Human-reproduction-disorders-ans-exposure-to-endocrine-disrupting-cheminals-EDC-which-reproductive-health-monitoring-systems-for-the-future
(ii) Le Moal J, Sharpe RM, Jørgensen N, Levine H, Jurewicz J, Mendiola J, et al. Toward a multi-country monitoring system of reproductive health in the context of endocrine disrupting chemical exposure.
Eur J Public Health. 2016;26(1):76-83.
(iii) World Health Organization. Reproductive health. [Internet]. http://www.who.int/topics/reproductive_health/en/
(iv) Santé publique France. Dossier thématique. Reproduction humaine et environnement. [Internet]. http://invs.santepubliquefrance.fr/Dossiers-thematiques/Environnement-et-sante/Reproduction-humaine-et-environnement/Contexte-et-enjeux-de-la-surveillance
(v) Bergman A, Heindel JJ, Jobling S, Kidd KA, Zoeller RT. State of the science of endocrine disrupting chamicals-2012. World
Health Organization/United Nations Environment Programme, 2013. 296 p. http://www.who.int/ceh/publications/endocrine/en/
(vi) Kortenkamp A, Evans R, Martin O, McKinlay R, Orton F, Rosivatz E. State of the art asessment of endocrine disrupters. Annex 1.
Summary of the state of the science. 2012. 486 p. http://ec.europa.eu/environment/chemicals/endocrine/pdf/annex1_summary_state_of_science.pdf
(vii) World Health Organization. Identification of risks from exposure to endocrine-disrupting chemicals at the country level.
WHO 2014. 24 p. http://www.euro.who.int/en/publications/abstracts/identification-of-risks-from-exposure-to-endocrine-disrupting-chemicals-at-the-country-level
Méthodes
Sources de données et indicateurs
La qualité du sperme a été évaluée en utilisant la base de données Fivnat sur l’aide médicale à la procréation (AMP), qui a enregistré de 1989 à 2005 en France métropolitaine les tentatives d’AMP, avec une exhaustivité estimée entre 40 et 70% selon les années. La population source retenue était composée des partenaires masculins de couples faisant une première tentative d’AMP, à partir du sperme éjaculé du conjoint. L’échantillon d’étude était composé de 26 609 hommes partenaires de femmes totalement stériles (ayant les deux trompes absentes ou bouchées). Il n’y avait donc pas d’a priori sur la fertilité des hommes sélectionnés et ils étaient originaires de l’ensemble de la France métropolitaine, ce qui incite à les considérer comme un échantillon proche de la population générale. Pour chaque homme, deux spermogrammes, réalisés à quelques mois d’intervalle dans des laboratoires distincts, étaient disponibles. Nous avons étudié le spermogramme réalisé au centre d’AMP le jour de la tentative d’AMP. L’autre spermogramme, réalisé le plus souvent en ville dans les 6 mois précédents mais pour lequel nous n’avions pas la date précise, a permis d’effectuer des études de sensibilité pour tester la robustesse des résultats. Les indicateurs étudiés étaient : la concentration spermatique en millions de spermatozoïdes/ml, le pourcentage de spermatozoïdes mobiles et le pourcentage de spermatozoïdes de forme normale. Les données de la base Fivnat n’indiquaient les méthodes utilisées que pour la qualité morphologique (méthode Kruger ou David). Le délai d’abstinence n’était pas non plus disponible, mais la recommandation – dont on peut penser qu’elle était suivie dans une population de couples cherchant à procréer – était une abstinence de 3 à 5 jours. La localisation des hommes, non disponible, a été estimée à partir de la région du centre d’AMP. Les données du Programme de médicalisation des systèmes d’information (PMSI) montraient que 80 à 97% des couples avaient recours à l’AMP dans un centre situé dans leur région, sauf dans trois régions où ce taux avoisinait 76% 8.
Les indicateurs d’incidence pour les autres composantes du TDS ont été construits à partir des données hospitalières du PMSI-MCO mises à disposition par l’Agence technique de l’information sur l’hospitalisation. Ces données couvrent l’ensemble du territoire (métropolitain et ultramarin) avec une exhaustivité estimée à partir de 2002 à 97,3%, calculée par comparaison de l’activité mesurée par le PMSI et la statistique annuelle des établissements gérée par la Direction de la recherche, des études, de l’évaluation et des statistiques 9. Les cas ont été localisés par le code géographique PMSI, qui correspond la plupart du temps au code postal de résidence des patients au moment de l’intervention.
Pour les cryptorchidies et hypospadias, nous avons identifié, sur la période 2002-2014 chez les garçons de moins de 7 ans, les séjours chirurgicaux relatifs à ces pathologies en utilisant un algorithme spécifique pour chaque malformation, mis au point dans une étude antérieure 10 et amélioré ensuite 11. Puis nous avons sélectionné la première hospitalisation, en chaînant les séjours d’un même patient grâce son identifiant.
Pour les cancers du testicule, nous avons repéré sur la même période les séjours chirurgicaux relatifs à cette pathologie selon un algorithme mis au point précédemment 12. Nous avons considéré que ces séjours reflétaient les cas incidents, car le nombre de séjours par patient était proche de 1 (1,02) et les réinterventions à court terme sont rarissimes.
Analyses statistiques
Qualité du sperme
Un modèle additif généralisé, prenant en compte l’effet de l’âge et de la saison à l’aide d’une fonction spline pénalisée 13, a permis une analyse des tendances temporelles sur la période 1989-2005 en France métropolitaine. Une transformation Box-Cox a été réalisée pour la concentration spermatique. Pour décrire les tendances spatio-temporelles, les données ont été agrégées par mois et par région (22 anciennes régions), en excluant la Corse car il n’était pas possible d’étudier de corrélation spatiale du fait de son insularité. Un modèle spatio-temporel bayésien 14 ajusté sur l’âge, avec prise en compte de la corrélation spatiale, de l’effet temporel et de leur interaction a été utilisé.
Les trois autres indicateurs
Les trois autres indicateurs ont été analysés selon les mêmes méthodes, différentes des précédentes. Les cryptorchidies et hypospadias ont été étudiés sur la période 2002-2014. .Le cancer du testicule a été étudié sur une période plus longue, 1998-2014, car un chaînage entre les différents séjours hospitaliers n’était pas nécessaire. Pour chacun des trois indicateurs, des taux d’incidence bruts ont été calculés, par département et par année, à partir du nombre de nouveaux cas divisé par le nombre de personnes-années. Pour décrire les tendances temporelles, spatiales et spatio-temporelles de chaque indicateur, nous avons sélectionné le modèle statistique le mieux adapté, à partir du critère d’information de déviance DIC (deviance information criteria). Pour chaque analyse, la tendance des taux d’incidence bruts a été estimée (taux prédits par le modèle) par une fonction spline afin de capturer de potentielles variations non monotones, lorsque les corrélations spatiales étaient capturées par un modèle de Besag, York and Mollié 15.
Résultats
Qualité du sperme
Entre 1989 et 2005, une baisse significative et continue de 32,2% [26,3-36,3] de la concentration spermatique a été observée. Pour un homme de 35 ans (âge moyen de l’échantillon), la concentration moyenne est passée de 73,6 millions de spermatozoïdes/ml [69,0-78,4] en 1989 à 49,9 millions/ml [43,5-54,7] en 2005, soit une diminution d’environ 1,9%, (soit 1,4 million de spermatozoïdes) par an (figure 1). On observait aussi une diminution significative non quantifiable – car non ajustable sur de possibles modifications de pratiques – du pourcentage de spermatozoïdes de morphologie normale. Pour la mobilité totale, la tendance était stable jusqu’en 1995, puis il y avait une légère augmentation jusqu’en 1998, suivie d’une stabilité jusqu’en 2005.
 Agrandir l'image
Agrandir l'imageL’analyse des variations spatio-temporelles a montré une diminution de la concentration spermatique, avec des pentes moyennes estimées négatives dans la plupart des régions françaises durant la période d’étude (figure 2). L’ex-région Aquitaine affichait la pente négative la plus importante, significativement différente de la pente nationale (figure 2) et l’ex-région Midi-Pyrénées affichait, du début à la fin de la période d’étude, une concentration moyenne en spermatozoïdes inférieure à toutes les autres régions (figure 3).
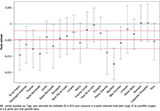 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageConcernant la qualité morphologique des spermatozoïdes, l’effectif des hommes étudiés était nettement plus faible que pour la concentration (près de la moitié), car cet indicateur était moins souvent disponible dans l’échantillon d’étude. Seules trois régions affichaient des pentes moyennes positives, significativement différentes de zéro (Franche-Comté et Bretagne) ou non (Pays de la Loire). Toutes les autres régions affichaient des pentes moyennes négatives. Les régions Midi-Pyrénées et Aquitaine affichaient les pentes négatives les plus fortes, significativement plus basses que la pente nationale, avec les régions Bourgogne, Centre et Rhône-Alpes, elles-mêmes à la limite de la significativité (figure 4).
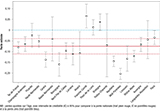 Agrandir l'image
Agrandir l'imageConcernant la mobilité spermatique, l’analyse spatio-temporelle montre que la plupart des pentes moyennes estimées sont au-dessus de 0 à quelques exceptions près, notamment en Bourgogne qui affiche la pente négative la plus forte (figure 5).
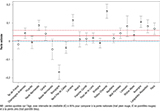 Agrandir l'image
Agrandir l'imageCancer du testicule
Le taux brut moyen d’incidence dans la période d’étude était de 6,5/100 000, avec une augmentation de 1,52% par an (figure 6).
 Agrandir l'image
Agrandir l'imageLes tendances spatiales prédites pour l’incidence du cancer du testicule montraient une hétérogénéité à l’échelle nationale, avec des incidences élevées à l’extrême ouest et l’extrême est et des incidences globalement inférieures dans la moitié sud par rapport à la moitié nord de la France. On observait aussi des incidences très faibles dans toutes les régions ultramarines (figure 7).
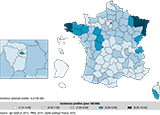 Agrandir l'image
Agrandir l'imageCryptorchidies
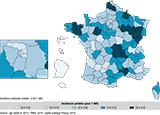
Le taux moyen prédit d’incidence des cryptorchidies chez les garçons de moins 7 ans durant la période d’étude était de 2,57/1 000. Il y avait une augmentation de 2,64%/an (figure 8).
 Agrandir l'image
Agrandir l'imageLes tendances spatiales prédites montraient une hétérogénéité en 2014, sans motif géographique particulier (figure 9). On observait une incidence élevée en Bretagne, comme pour le cancer du testicule, mais pas à l’extrême est. L’incidence la plus élevée était observée dans les départements du nord de l’Auvergne et de la Franche-Comté. Le taux d’incidence était faible dans les régions ultramarines, comme pour le cancer du testicule.
 Agrandir l'image
Agrandir l'imageHypospadias
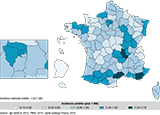
Le taux brut moyen prédit d’incidence des hypospadias traités chirurgicalement chez les garçons de moins de 7 ans sur la période d’étude était de 1,01/1000. Il n’y avait pas de tendance temporelle à l’augmentation ou à la diminution (figure 10).
 Agrandir l'image
Agrandir l'imageConcernant les tendances spatiales (figure 11), on observait également une hétérogénéité spatiale pour cet indicateur, avec des incidences particulièrement élevées dans trois départements : Hérault, Loire et Var. Des incidences faibles étaient également observées dans les régions ultramarines.
 Agrandir l'image
Agrandir l'imageDiscussion
Les quatre indicateurs du syndrome de dysgénésie testiculaire ont pu être étudiés à l’échelle nationale en France, ce qui, à notre connaissance, n’a été réalisé dans aucun autre pays. En effet, les données sur la qualité du sperme ne sont le plus souvent disponibles que sur de faibles échantillons localisés. L’exploitation que nous avons pu réaliser à partir de la base Fivnat, sur un échantillon de 26 609 hommes proche de la population générale, répartis sur l’ensemble du territoire, avec deux spermogrammes réalisés dans des laboratoires distincts à 6 mois d’intervalle et disponibles pour chaque homme, est à notre connaissance unique. Pour le cancer du testicule, il existe dans certains pays des registres de cancer couvrant la totalité du territoire, notamment dans les pays scandinaves. Pour les malformations urogénitales du garçon, les données à l’échelle nationale sont rares, car les registres de malformations congénitales ne couvrent généralement que des zones limitées du territoire. De plus, les cryptorchidies ne sont pas systématiquement enregistrées.
Estimations nationales et tendances temporelles
Qualité du sperme
Les tendances temporelles montrent un déclin continu de la qualité du sperme en France sur 17 ans depuis 1989, et il est possible que cette baisse ait débuté dans les années 1970 si l’on prend en compte une étude précédente réalisée en région parisienne de 1973 à 1992 16 sur un échantillon de 1 351 donneurs de sperme.
Trois méta-analyses ont montré une détérioration de la qualité du sperme dans les pays développés 17,18,19. La plus récente 18 confirme une baisse linéaire de la concentration spermatique dans les pays occidentaux (Amérique du Nord, Europe, Australie et Nouvelle-Zélande) entre 1973 et 2011 et la quantifie à 1,4% par an. Il est intéressant de constater que cette baisse est dans le même ordre de grandeur que nos résultats. Il en va de même pour l’estimation de la concentration spermatique moyenne (47,7 spermatozoïdes/ml en 2011), les résultats étant obtenus avec des données et une méthode différentes, ce qui va dans le sens d’une confirmation. En effet, l’étude a porté sur des spermogrammes obtenus « à la source », ce qui n’était pas notre cas à partir de la base Fivnat, car nous n’avions pas directement accès aux spermogrammes mais à des fiches d’AMP où figuraient des données extraites des spermogrammes. Fait préoccupant, cette méta-analyse n’observe aucune atténuation de la baisse dans les années les plus récentes (jusqu’à 2011). Outre les conséquences en termes de fertilité, les auteurs rappellent que la qualité du sperme est un indicateur global de santé publique. En effet aujourd’hui, trois larges études font le lien entre une mauvaise qualité du sperme et une augmentation de la mortalité et de la morbidité chez les hommes, toutes causes confondues 20,21,22.
Cancer du testicule
L’augmentation de l’incidence du cancer du testicule dans les populations d’origine nord-européenne depuis plusieurs décennies est un fait connu 2,23 et encore inexpliqué. En effet le cancer du testicule, qui touche plus fréquemment l’adulte jeune (20-40 ans), est diagnostiqué cliniquement et traité en première intention par la chirurgie au cours d’une hospitalisation. Notre estimation nationale du taux brut d’incidence à partir des données du PMSI est égale à celle réalisée en utilisant comme corrélat l’incidence observée dans les registres généraux de cancer 24. Le taux annuel d’évolution de l’incidence observé dans notre étude (1,5%) est comparable à celui estimé à partir des données de registres de cancer (1,6%) entre 2005 et 2012 25. Ce taux annuel d’évolution est faible par rapport à l’Espagne (6%) et la Finlande (4%) et comparable à l’Allemagne (1,4%) et à la Suisse (1,7%) 26. Par ailleurs, il existe un gradient européen décroissant nord-sud des taux d’incidence de cancer du testicule 2 et la France se situe dans la moyenne des pays européens du nord.
Cryptorchidies
Concernant les cryptorchidies, d’une part, comme indiqué précédemment, peu de données d’incidence sont disponibles et, d’autre
part, tout dépend de l’âge pris en compte pour quantifier les cas. Un certain nombre de cryptorchidies présentes à la naissance
(cryptorchidies congénitales) se normalisent ensuite, et il existe aussi des cryptorchidies qui apparaissent plus tardivement
(cryptorchidies acquises) alors que les testicules étaient en place à la naissance. Comptabiliser les cryptorchidies opérées
jusqu’à 6 ans permet de prendre en compte toutes les situations de cryptorchidies non spontanément résolutives. Une étude
coréenne 27
a utilisé une méthode proche de la nôtre pour estimer l’incidence nationale des cryptorchidies chez les enfants de moins
de 5 ans et ses variations sur la période 2000-2005 à partir des données d’assurance maladie. Elle a également montré une
augmentation du taux d’incidence qui a plus que triplé durant la période. L’estimation du taux d’incidence en 2005 (1,743/1 000)
est comparable au nôtre de 2014. Une augmentation du taux d’incidence des cryptorchidies a également été observée au Royaume
Uni et au Danemark 3.
Hypospadias
Même si les hypospadias sont pris en compte dans les registres de malformations congénitales, il est très difficile d’en estimer la prévalence à la naissance. Ce terme de prévalence est utilisé par les registres plutôt que l’incidence, car les enregistrements ne prennent en compte que les malformations des enfants nés vivants (en revanche, dans notre étude, il s’agit bien d’incidence des hypospadias opérés). Dans les registres, les modalités d’enregistrement varient considérablement, et il n’y a pas de procédure standardisée, ce qui biaise les comparaisons et le suivi des tendances, au niveau national comme international 28. En Europe, la prévalence des hypospadias estimée à partir des publications des registres de 1910 à 2013 était de 19,9/10 000 naissances vivantes, mais avec une énorme dispersion (1 à 464/10 000) et il n’y a pas de consensus sur la tendance temporelle des hypospadias, considérée par certains comme en augmentation et par d’autres comme stable 28. La plus récente étude colligeant les données de 23 registres européens 29 conclut à une stabilité sur la période 2001-2010. Si nous comparons nos résultats à ceux de l’étude sud-coréenne précédemment citée pour les cryptorchidies 27, qui donne une estimation d’incidence des hypospadias en 2005 de 0,328/1 000 garçons de moins de 5 ans, notre résultat en 2014 est supérieur, mais comparable en ordre de grandeur. L’étude coréenne ne montre pas de tendance temporelle nette.
Au total, l’analyse combinée des tendances temporelles des indicateurs du TDS en France brosse un tableau d’altération globale de la santé reproductive masculine, cohérent avec les données existantes dans les pays occidentaux, à modérer en ce qui concerne les hypospadias pour lesquels la tendance temporelle est incertaine. Diverses hypothèses causales peuvent être évoquées, notamment les expositions aux PE, présents de façon croissante et ubiquitaire dans l’environnement et les produits de consommation depuis plusieurs décennies 3, et retrouvés notamment chez les femmes enceintes 30. D’autres causes sont possibles ou peuvent être intriquées avec les précédentes, comme le tabagisme chez les femmes enceintes qui est un facteur de risque suspecté pour les cryptorchidies 31 comme pour la qualité du sperme 32, des facteurs nutritionnels ou métaboliques, la pollution atmosphérique ou des modifications de mode de vie (sédentarité, stress, chaleur, sommeil) pour la qualité du sperme 2,33.
Tendances spatiales
Les résultats spatio-temporels sur la qualité du sperme sont compatibles avec un changement global en termes d’exposition environnementale ou de mode de vie (augmentation de poids, sédentarité, stress) ayant touché l’ensemble de la population française durant la période d’étude, car pratiquement toutes les régions sont touchées, même si deux régions affichent des variations plus marquées.
À ce stade, les résultats obtenus pour chacun des indicateurs ne montrent pas de convergences spatiales évidentes en métropole. Les régions affichant une détérioration plus marquée de la qualité du sperme sur la période 1989-2005 sont différentes de celles où l’on observe des surincidences de cancer du testicule, de cryptorchidie et d’hypospadias en 2014. Néanmoins, on ne peut exclure des convergences partielles (en région Bretagne essentiellement) entre les tendances spatiales pour les cryptorchidies et le cancer du testicule, ce qui serait cohérent, l’un étant le principal facteur de risque de l’autre.
La faible incidence observée dans les régions ultramarines est convergente entre les indicateurs du cancer du testicule, des cryptorchidies et hypospadias. Malheureusement, la qualité du sperme n’a pas pu être étudiée dans ces régions. Le cancer du testicule, plus fréquent dans les populations d’origine caucasienne que noire-africaine, a une forte composante génétique, ce qui pourrait contribuer à cette faible incidence. Plusieurs gènes prédisposants, souvent liés au développement des testicules, ont été identifiés 2. Concernant les cryptorchidies et hypospadias, les arguments en faveur de composantes génétiques s’accumulent, avec des pistes diverses 34. Toutefois, deux études de cohorte danoises ne retiennent pas d’arguments en faveur d’une origine génétique commune à ces deux malformations 35 ni avec le cancer du testicule 35.
Les études expérimentales montrent que les cryptorchidies et hypospadias résultent d’une insuffisance d’imprégnation hormonale en androgènes lors du développement fœtal, ce qui pourrait dépendre de perturbations endocriniennes directes (expositions in utero à des PE anti-androgènes et estrogènes) ou de mécanismes épigénétiques 2. Une récente étude prospective française cas-témoins a trouvé des associations entre certaines expositions intra-utérines aux PE et le risque d’hypospadias 36. Une autre étude cas-témoins française a apporté des arguments en faveur d’une association entre le risque de cryptorchidie à la naissance et l’exposition fœtale aux PCB 37. Concernant les mécanismes épigénétiques, la possibilité d’effets sur plusieurs générations au-delà de celles exposées, par transmission de marques épigénétiques via les gamètes, est à envisager. Les tendances de santé reproductive masculine observées aujourd’hui pourraient ainsi refléter les expositions de générations antérieures, par exemple au DDT et aux dioxines 38.
Par ailleurs, les résultats spatiaux ne permettent pas d’argumenter un gradient Est-Ouest du TDS, comme cela a été observé dans les pays scandinaves 3, ni des corrélations géographiques entre ses différents indicateurs, comme une étude française l’a montré au niveau international 39. Toutefois, selon une publication récente des concepteurs du TDS 5, seule une fraction des cas d’hypospadias (20 à 40%) pourrait s’expliquer par ce syndrome, de même pour la mauvaise qualité du sperme.
Limites
Les résultats en termes de valeurs et de tendances temporelles sur la qualité du sperme sont relativement robustes et en cohérence avec la littérature. Une analyse de sensibilité approfondie utilisant en particulier le deuxième spermogramme a permis de minimiser les biais liés aux pratiques de laboratoire et à la variabilité intra-individuelle, et d’argumenter la robustesse des résultats concernant la concentration, indicateur jugé le plus fiable, et la mobilité spermatique. Pour la qualité morphologique, les résultats sont à prendre avec plus de précaution, notamment du fait d’une amélioration de la précision observateur-dépendante – qui ne suffit pas à expliquer la tendance – et c’est pourquoi la baisse n’a pas été quantifiée 7.
Pour le cancer du testicule, les résultats sont également robustes, car les pratiques diagnostiques et de prise en charge n’ont pas varié au cours du temps, et ils sont en cohérence avec la littérature.
Pour les cryptorchidies et les hypospadias, la prudence s’impose pour diverses raisons : il n’est pas exclu que des évolutions de pratiques de prise en charge puissent influencer les résultats ; peu de comparaisons sont possibles dans la littérature en termes d’incidence ; nos indicateurs ne reflètent que les cas ayant été traités chirurgicalement.
En termes de tendances spatiales, il faut ajouter à ces limites de possibles différences géographiques de pratique pour cryptorchidies et hypospadias, ce qui ne joue pas en principe pour le cancer du testicule. Pour la qualité du sperme, la localisation des hommes est moins robuste dans quelques régions, ce qui peut impacter un peu les résultats, essentiellement en périphérie d’Île-de-France et, par manque de données, les tendances spatio-temporelles ne sont pas significatives dans certaines régions.
Par ailleurs, du fait de la disponibilité/qualité des données, nous n’avons pas pu étudier les mêmes périodes pour la qualité du sperme (1989-2005) et les autres indicateurs (1998-2014 pour le cancer du testicule, indicateur qui ne nécessitait pas un chaînage des données, et 2002-2014 pour les autres, période où le chaînage était plus fiable). Pour argumenter une origine fœtale du syndrome de dysgénésie testiculaire, il serait préférable de pouvoir analyser les différents indicateurs en fonction de la date et du lieu de naissance des hommes. Malheureusement, les données disponibles ne permettent pas d’obtenir un recoupement suffisant des périodes de naissance. Pour la qualité du sperme, une grande partie des hommes (âge moyen 35 ans, médian 34 ans) sont nés entre 1954 et 1970 et, pour le cancer du testicule (âge moyen 37 ans, médian 35 ans), entre 1965 et 1977. Il y a un faible recoupement qui pourrait expliquer la convergence partielle entre les deux indicateurs. Pour les cryptorchidies et hypospadias, les naissances s’échelonnent entre 1995 et 2007. Concernant le lieu de naissance, les données n’étaient pas disponibles à partir des sources utilisées.
Conclusion
Les résultats reflètent une altération globale de la santé reproductive masculine en France, cohérente avec la littérature internationale, probablement depuis les années 1970 pour la qualité du sperme. Les tendances observées à cette échelle géographique et de temps semblent plus compatibles avec des changements environnementaux, incluant l’exposition ubiquitaire croissante depuis les années 1950 aux PE 3, ou de modes de vie comme l’augmentation du tabagisme chez les mères, qu’avec des variations génétiques de la population française. À ce stade, les résultats ne permettent pas d’argumenter un rôle éventuel d’expositions géographiquement déterminées dans l’association particulière des composantes du TDS, peut-être du fait des limites des données disponibles. Par la suite, des analyses spatio-temporelles à une échelle infra-départementale apporteront peut-être des éléments supplémentaires.




