Surveillance du vecteur de la borréliose de Lyme, Ixodes ricinus, en Alsace de 2013 à 2016
// Surveillance of the tick Ixodes ricinus, the vector of Lyme borreliosis in Alsace (France) from 2013 to 2016
Résumé
La borréliose de Lyme est la pathologie à transmission vectorielle la plus fréquente des zones tempérées de l’hémisphère Nord chez l’homme. Les espèces de bactéries responsables appartiennent au groupe Borrelia burgdorferi sensu lato et sont transmises par une tique dure du genre Ixodes, surtout à la stase nymphale. La surveillance vectorielle est donc essentielle pour évaluer les risques pour la population et diffuser des messages de prévention.
Dans le cadre des missions du Centre national de référence (CNR) des Borrelia, la surveillance acarologique effectuée de 2013 à 2016 a eu pour objectifs d’étudier : (1) la densité du vecteur Ixodes ricinus en Alsace et (2) le risque acarologique en Alsace pour les espèces de Borrelia responsables de la borréliose de Lyme. Ont été également recherchés Borrelia miyamotoi, un agent pathogène émergent, et Anaplasma phagocytophilum, responsables de syndromes fébriles après piqûre de tique. Quatre sites aux écosystèmes différents ont été suivis (zones rurales vs zones urbaines ou périurbaines ; zones de plaine vs zones de montagne).
Selon les sites investigués au cours des quatre années d’étude, de larges variations ont été observées dans les densités en nymphe, entre 4 et 143 par 100 m2. La densité en nymphes infectées variait également, allant de moins d’une nymphe infectée à plus de 8 par 100 m2. Un site de moyenne montagne (altitude : 520 m), Murbach, était particulièrement à risque, mais les zones périurbaines autour de Strasbourg n’étaient pas non plus dénuées de risque. L’Alsace reste donc une zone géographique de fortes densités en tiques, avec des densités en nymphes importantes, associées à la présence d’agents pathogènes transmissibles à l’homme significativement élevée par rapport au reste de la France.
Abstract
Lyme borreliosis is the most frequent arthropod borne disease in temperate regions of the Northern hemisphere. The bacteria responsible for this disease are transmitted by a hard tick Ixodes, mainly the nymph stage. Surveillance of the tick vector is thus essential to estimate the risks for the population and develop messages of prevention.
Within the framework of the missions of the Borrelia National Surveillance Centre (CNR), the objectives of tick surveillance performed from 2013 till 2016 were to study: (1) the density of the vector Ixodes ricinus in Alsace, and (2) the density of infected nymphs in Alsace for Borrelia responsible for Lyme borreliosis. Two other pathogens were investigated: Borrelia miyamotoi, an emerging bacterium, and Anaplasma phagocytophilum, both responsible for fever in patients after a tick bite. We selected four sites with different ecosystems (rural vs. suburban areas, and lowland vs. mountainous areas).
During the four study years, according to the investigated sites, high variations in nymph density were observed, between 4 and 143 by 100m2. The density of Borrelia-infected nymphs also varied widely, from less than 1 infected nymph to more than 8 per 100 m2. A site of low mountain range, Murbach (altitude: 520 m), was particularly at risk, but suburban areas around Strasbourg were not without risk either. The Alsace region remains a geographic area with a high tick density with an important infection rate of pathogens, compared to the rest of France.
Introduction
Parmi les 900 espèces de tiques qui sévissent à travers le monde 1, environ 40 peuvent être rencontrées en France 2. Le genre Ixodes est particulièrement bien représenté de par sa répartition sur pratiquement l’ensemble du territoire français, excepté sur le pourtour méditerranéen qui est trop sec. Cependant, il est à noter qu’en Corse, l’intérieur de l’île héberge des tiques Ixodes 2. Les tiques du genre Ixodes font partie des tiques dures. Elles ont comme caractéristique de prendre un repas sanguin de longue durée et plutôt diurne, par opposition aux tiques molles (Argas, Ornithodoros) qui ont des repas sanguins courts et plutôt nocturnes. Le développement d’Ixodes ricinus se caractérise par trois stases : larve, nymphe et adultes mâles et femelles (figure 1a). Toutes sont strictement hématophages, sauf le mâle, qui ne se nourrit pas. Ces tiques ne prennent à chaque stase qu’un unique repas sanguin sur des hôtes très variés. On comptabilise plus de 300 espèces animales susceptibles d’être piquées par Ixodes ricinus, dont des lézards, des rongeurs, des oiseaux et des grands mammifères 3.
La plupart de ces tiques attendent leur hôte à l’affût sur la végétation. Étant très sensibles à la dessiccation, les tiques I. ricinus montent sur les herbes et restent à l’affût pour la recherche d’un hôte, puis vont régulièrement se réhydrater en redescendant au niveau du sol (figure 1b). En zone tempérée, comme en France, la tique observe une diapause en hiver et sa période d’activité s’étend de mars à octobre en général, selon les conditions climatiques. Si l’hiver est doux, elle peut rester active toute l’année. La tique se nourrissant exclusivement de sang, la recherche de l’hôte est donc vitale. Pour cela, elle possède entre autres des pédipalpes et des organes sensoriels, dont l’organe de Haller sur sa première paire de pattes, qui lui permettent de repérer son hôte. Le dioxyde de carbone dégagé par l’hôte, la chaleur et les odeurs vont jouer un rôle très attractif sur la tique. Une fois accrochée à son hôte, le repas sanguin dure, selon les stases, de trois à 10 jours 4.
 Agrandir l'image
Agrandir l'imageDe manière générale, les tiques dures sont vectrices de microorganismes, dont certains peuvent être pathogènes pour l’être humain : des bactéries (Borrelia, Anaplasma, etc.), des virus (encéphalite à tiques) voire des parasites (Babesia). La borréliose de Lyme, la plus importante, est avant tout une zoonose et l’homme constitue un hôte accidentel. Concernant I. ricinus, la stase la plus incriminée dans la transmission d’agents infectieux à l’homme est la nymphe (1 mm environ), car elle a une répartition dans l’environnement plus large que les larves, lesquelles restent concentrées sur le site de ponte des tiques femelles. Pour cette stase, le repas sanguin dure environ cinq jours. Les adultes femelles, plus grosses, sont plus facilement visibles sur la peau et donc extraites souvent plus tôt que les nymphes, qui peuvent passer inaperçues. Les mâles ne transmettent pas d’infection, mais ils peuvent être trouvés sur les hôtes.
La surveillance entomologique du Centre national de référence (CNR) des Borrelia 5 consiste à collecter les tiques du genre Ixodes dans des zones aux écosystèmes différents (zones rurales vs zones urbaines ou périurbaines ; zones de plaine vs zones de montagne). La surveillance d’I. ricinus a été réalisée pendant la période 2013-2016 en Alsace principalement, et ce pour plusieurs raisons. D’une part, cette région géographique est un modèle pour l’épidémiologie vectorielle et pour le risque acarologique, car elle demeure une région de forte densité en tiques I. ricinus, avec des taux d’infection élevés. Les fortes densités en tique I. ricinus sont liées à son écosystème forestier et à sa faune sauvage, notamment sa forte densité en grands gibiers (suidés et cervidés). D’autre part, l’Alsace avait fait l’objet en 2003 et 2004 d’une étude sur l’épidémiologie vectorielle, qui avait fait suite à une étude en épidémiologie humaine 6. Nous avons voulu étudier si des modifications de cette épidémiologie vectorielle étaient apparues 10 ans après. Par ailleurs, la Cellule d’intervention de Santé publique France (Cire) en région Grand-Est a conduit en 2014-2015 une nouvelle étude épidémiologique humaine sur les cas de borréliose, d’anaplasmose et d’encéphalite à tique (voir l’article de S. Raguet et coll. dans ce numéro). Il nous a semblé essentiel de suivre en parallèle sur plusieurs années la population de tiques et d’essayer de corréler la densité en tiques infectées et les cas humains pour ces trois pathologies (études en cours d’analyse).
L’objectif de cet article est de présenter les résultats de la surveillance entomologique des nymphes d’Ixodes ricinus menée par le CNR Borrelia en Alsace, pour la période 2013-2016. La présence de Borrelia burgdorferi sensu lato a été particulièrement étudiée, mais aussi celles d’Anaplasma phagocytophilum et Borrelia miyamotoi, également susceptibles de donner des pathologies cliniques chez l’homme.
Méthodes
Mesure de la densité des tiques
Pour collecter les tiques à l’affût, la technique est celle dite « du drapeau ». Elle consiste à traîner sur la végétation un tissu blanc en éponge d’un mètre sur un mètre. Tous les 10 m, le tissu est retourné et les tiques accrochées sont collectées et transférées dans un tube qui sera ramené au laboratoire (figure 2).
 Agrandir l'image
Agrandir l'imageLes collectes ont été effectuées dans quatre sites : deux sites de moyenne montagne (Murbach et Niedermunster), un site de plaine (Dannemarie) et un site périurbain en plaine (Illkirch). Un transect de 30 tirs était réalisé sur chaque site, localisé et tracé par GPS. Les 30 tirs ne sont pas réalisés en continu afin de couvrir un espace plus grand et plus diversifié en végétation pour chaque site. Ces sites sont suivis mensuellement ; la température et le degré hygrométrique sont relevés également. Les tiques sont ramenées vivantes au laboratoire, puis congelées à -80°C jusqu’à la recherche d’agents infectieux par PCR. Un échantillonnage est pris pour identification des nymphes Ixodes par spectrométrie de masse MALDI-TOF 7.
Densité en nymphes infectées en B. burgdorferi sl et taux d’infection
Sur l’ensemble des nymphes d’I. ricinus collectées à l’affût, et lorsque leur nombre le permet, un échantillonnage de 60 tiques par site et par date de collecte est réalisé. Chaque tique est testée individuellement. Pour chaque zone géographique étudiée, le taux d’infestation des tiques et la diversité des espèces de Borrelia hébergées par ces nymphes sont établis 5.
Les tiques collectées sont analysées au laboratoire par biologie moléculaire pour la recherche d’agents infectieux. La stase nymphale étant la plus répandue dans l’environnement et la plus incriminée dans les piqûres chez l’homme, c’est elle qui est analysée pour la recherche de ces agents infectieux. Les espèces du complexe Borrelia burgdorferi sensu lato sont recherchées par PCR en temps réel, en ciblant le gène de la flagelline B. Puis les extraits positifs sont soumis à une deuxième PCR permettant de faire un typage moléculaire en se basant sur une technique de FRET (Fluorescence Resonnance Energy Transfert) où la température de fusion est spécifique à chaque espèce de Borrelia 8.
Anaplasma phagocytophilum (autre bactérie transmise potentiellement à l’homme par Ixodes ricinus) est recherchée par PCR en temps réel en ciblant le gène msp2/p44 9.
Borrelia miyamotoi, agent de fièvres récurrentes, est détectée en ciblant le gène ARN16s 10 ; les extraits positifs sont séquencés. Jusqu’à présent, l’analyse des séquences a permis de mettre en évidence uniquement la présence d’ADN de B. miyamotoi.
Analyses statistiques
La normalité des distributions des densités en nymphes et des densités en nymphes infectées a été testée à l’aide du test de Shapiro-Wilk. Les densités moyennes en nymphes et en nymphes infectées au sein des quatre sites de collecte sont exprimées avec leur intervalle de confiance à 95% (IC95%). Elles ont été analysées à l’aide d’un test de Kruskal-Wallis, puis les moyennes ont été comparées 2 à 2 en utilisant le test de Dunn pour les comparaisons multiples. Une valeur de p≤0,05 a été retenue comme significative. Ces analyses ont été effectuées à l’aide du logiciel GraphPad Prism version 5.
Une modélisation statistique utilisant un modèle linéaire généralisé a été réalisée pour évaluer la prévalence des nymphes infectées par B. burgdorferi sl dans les quatre sites différents. Les données ont été analysées en utilisant R Studio R version 3.4.0 (2017-04-21, https://cran.r-project.org/).
Résultats
Densité des nymphes d’Ixodes ricinus et en nymphes infectées par B. burgdorferi sl
Les nymphes collectées présentaient un pic majeur d’activité, généralement de mars à juin (figure 3), parfois un deuxième beaucoup plus faible en septembre-octobre.
Les densités en nymphes I. ricinus par site sont présentées dans le tableau. La densité moyenne sur quatre ans pour tous les sites était de 30,9 ([IC95%: 16,4-45,3]) nymphes par 100 m2. Le site de Murbach, avec 81,9 nymphes par 100 m2 [27,1-136,0] présentait une densité statistiquement plus élevée que les autres sites (Test de Dunn, p<0,05).
La densité en nymphes infectées est le paramètre clé représentant le risque acarologique. Elle variait de 0,6 nymphe par 100 m2 [0,2-1,0] pour le site de Dannemarie à 12,3 nymphes par 100 m2 [3,9-20,8] pour le site de Murbach. La densité en nymphes infectées était statistiquement plus élevée pour le site de Murbach (p<0,05, test de Dunn) que pour les autres sites.
Aucune augmentation significative de la densité de tiques n’est observée sur une période de 10 ans (manuscrit soumis à publication). En 2013, une augmentation ponctuelle de la densité de tiques a été observée pour le site de Murbach (figure 3) sans qu’une explication ait pu être apportée à ce phénomène jusqu’à présent (hypothèse : hiver long et printemps pluvieux avec possible variation des densités de rongeurs – étude en cours). Pour ces différents sites, un inventaire de la végétation a été réalisé et l’impact éventuel sur les tiques est en cours d’analyse (Rapport d’activité annuel du CNR 5).
 Agrandir l'image
Agrandir l'image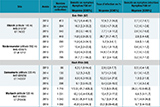 Agrandir l'image
Agrandir l'imageTaux d’infection des tiques avec Borrelia et Anaplasma
Le taux d’infection était variable selon les sites, avec une moyenne de 11,8% [9,2%-14,3%]. Le modèle généralisé linéaire révèle une disparité dans la prévalence des nymphes infectées par B. burgdorferi sl entre les quatre sites de collectes. En effet, l’odds ratio de la prévalence des nymphes infectées par B. burgdorferi sl était statistiquement supérieur à 1 pour les sites de Murbach et le site péri-urbain d’Illkirch (banlieue de Strasbourg) (p<0,001 pour Murbach et p=0,001 pour Illkirch). Cet odds ratio était le plus élevé pour le site de Murbach (OR=2,31 [1,69-3,1]).
En ce qui concerne les espèces de Borrelia circulant chez les tiques, B. afzelii était l’espèce majoritaire avec environ 40% de tiques infectées (les rongeurs en sont le réservoir), puis B. garinii avec environ 34% de tiques infectées (réservoir principal : les oiseaux) et enfin B. burgdorferi ss (moins de spécificité d’hôtes) avec 10,7%. Les autres espèces de Borrelia étaient détectées de façon plus marginale 5.
Concernant les deux autres bactéries pathogènes détectées, le taux d’infection des tiques avec A. phagocytophilum variait de 0,36% en 2015 à 1,35% en 2016, avec de légères variations selon les sites. Pour B. miyamotoi, le taux d’infection des tiques variait de 0,75% en 2014 à 4,2% en 2016, avec également de légères variations selon les sites.
Il est à noter que, alors que des cas cliniques d’anaplasmose sont détectés tous les ans 9, aucun n’a été rapporté en France jusqu’à présent pour B. miyamotoi (manuscrit soumis à publication). Les cas cliniques associés à cette dernière espèce sont rares en Europe et ils sont retrouvés essentiellement chez des patients immunodéprimés 10,11. Les co-infections sont peu fréquentes dans l’ensemble entre deux espèces de Borrelia : entre 4 et 7%.
Le CNR Borrelia développe également une approche protéomique par spectrométrie de masse pour identifier les espèces de tiques (avec mise en place d’une banque de données) et les agents infectieux associés.
Discussion – conclusion
La densité en tiques infectées est souvent plus élevée en moyenne montagne, comme sur le site de Murbach qui demeure un site de forte densité en tiques. Les raisons en sont multiples : densité en rongeurs et en grands mammifères plus importante, écosystème forestier particulier. Cependant, on peut noter que le site d’Illkirch, proche de Strasbourg, considéré comme périurbain, présente une densité aussi importante que le site de moyenne montagne de Niedermunster. La présence de tiques en zones urbaines et périurbaines n’est pas nouvelle 12,13 mais elle tend à s’intensifier avec le développement d’espaces végétalisés sauvages 14.
La densité en nymphes infectées par les Borrelia agents de la borréliose de Lyme n’est pas négligeable. Une précédente étude réalisée en 2003 et 2004 dans le Haut-Rhin avait montré des taux d’infection et de densité en nymphes similaires à ceux obtenus ici 6.
Par ailleurs, la détection d’ADN de microorganismes dans les tiques ne signifie pas forcément une infection chez l’homme, pour plusieurs raisons. Les trois agents infectieux, B. burgdorferi sensu lato, A. phagocytophilum et B. miyamotoi sont des bactéries dont la transmission a lieu généralement 24 heures après le début de la piqûre 15. Une extraction précoce de la tique empêche donc la transmission. De plus, des études épidémiologiques chez l’homme ont montré que la transmission et la détection des microorganismes (diagnostic indirect par sérologie) n’impliquent pas forcément une pathogénicité, grâce à une réponse immunitaire efficace contre l’agent infectieux 16,17.
Des études complémentaires, conduites seulement en Alsace pour l’instant, sont en cours pour rechercher d’autres agents pathogènes émergents et mieux définir les agents responsables de syndromes fébriles après piqûre de tique, lorsque la sérologie ciblant Borrelia, agent de borréliose de Lyme, est négative. En outre, le CNR des Borrelia continue à collecter les tiques sur différents sites en Alsace, mais aussi en Bretagne actuellement, et tente de mieux apprécier les facteurs biotiques (rongeurs et grands mammifères, nature des sols, écosystèmes forestiers, etc.) et abiotiques (température, humidité, exposition, etc.) qui permettent de définir les zones à risque de piqûre de tique afin d’informer les autorités sanitaires et le grand public du risque potentiel acarologique.
Remerciements
Nous remercions Lisa Baldinger du CNR des Borrelia pour son aide technique au traitement des données, et Jean-Claude George pour son assistance technique dans la collecte des tiques en 2013.




