Borréliose de Lyme : estimation de l’incidence hospitalière en France de 2005 à 2016
// Lyme Borreliosis: Estimated hospital incidence in France from 2005 to 2016
Résumé
La borréliose de Lyme (BL) est la maladie à transmission vectorielle la plus fréquente en France. Depuis 2009, sa surveillance est réalisée en métropole par le réseau Sentinelles, réseau de médecins généralistes. En complément, une surveillance des cas de BL hospitalisés en France a été mise en place à partir de la base du Programme de médicalisation des systèmes d’information. L’objectif de cette étude était d’estimer l’incidence et les tendances des cas de BL hospitalisés sur la période 2005 à 2016 et de décrire leurs manifestations cliniques.
En moyenne, 799 cas de BL ont été hospitalisés annuellement, avec un pic observé pendant l’été. Les taux annuels d’incidence hospitalière variaient de 1,1 cas pour 100 000 habitants en 2005 à 1,5 en 2011, sans tendance significative. Des variations interrégionales importantes de l’incidence étaient observées, avec un taux plus élevé dans les régions à haute incidence estimées par le réseau Sentinelles. La distribution par âge était bimodale, avec des pics d’incidence chez les 5-9 ans et les 70-79 ans. Parmi les cas hospitalisés, la manifestation clinique de BL la plus fréquente était la neuroborréliose (51%). Après une période d’incidence stable (2009-2015), l’augmentation d’incidence de la BL observée par le réseau Sentinelles en 2016 n’est pas observée en milieu hospitalier.
Les stratégies de prévention, axées en particulier sur les groupes d’âge les plus à risque et les régions à forte incidence, doivent continuer à promouvoir les mesures de prévention telles que les moyens de protection contre les piqûres de tiques, la recherche de tiques sur le corps après l’exposition et leur retrait rapide.
Abstract
Lyme borreliosis (LB) is the most frequent vector-borne disease in France. Since 2009, surveillance of LB is conducted by a sentinel network of general practitioners (Sentinelles network). In addition, a surveillance of hospitalized LB cases was implemented using the national hospitalization database. In the present study, we estimate the incidence of hospitalized LB cases from 2005 to 2016, its trends and we describe their characteristics.
A mean of 799 cases per year were hospitalized with LB associated diagnoses with a peak during the summer. The hospitalization annual incidence rate (HIR) ranged from 1.1 cases per 100,000 inhabitants in 2005 to 1.5 in 2011, with no significant trend. Inter-regional variations in LB hospitalization rates were observed with higher rates in regions with high incidence estimated by the Sentinelles network. The age distribution was bimodal with HIR peaks in 5-9 years old and in 70-79 years old. The most common clinical manifestation was neuroborreliosis (51%). After a period of stable incidence (2009-2015), an increase in the incidence of LB was observed by the Sentinelles network in 2016. This increase at the primary care level was not observed at hospital level.
Public health strategies with a particular focus on the high-incidence age groups and regions should continue to promote preventive measures such as protective measures against tick bites, check for ticks on the body after exposure, and their prompt removal.
Introduction
La borréliose de Lyme (BL) est causée par des spirochètes du complexe Borrelia burgdorferi sensu lato, transmis par des tiques dures du genre Ixodes 1. Sa manifestation clinique la plus fréquente est l’érythème migrant (EM), qui peut disparaître même sans traitement antibiotique. Cependant, lors de la bactériémie qui suit l’EM, les agents pathogènes infectants peuvent se propager à d’autres tissus et organes, provoquant des manifestations plus graves pouvant toucher en particulier la peau, le système nerveux, les articulations ou le système circulatoire 1. La BL est la maladie infectieuse transmise par les tiques la plus fréquente en Amérique du Nord 2,3 et dans les pays à climat tempéré d’Europe 4,5. Son incidence a augmenté dans plusieurs pays européens 6,7,8,9,10,11,12 et certains auteurs suggèrent que l’impact en santé publique de la BL pourrait augmenter dans les années à venir, notamment sous l’effet de l’impact possible du changement climatique sur la densité des tiques 4.
En France métropolitaine, depuis 2009, la surveillance de la BL est réalisée par le réseau Sentinelles, réseau de médecins généralistes (MG). Elle permet des estimations nationales et régionales des taux d’incidence de la BL. Au cours de la période 2009-2015, les taux annuels d’incidence nationale des cas diagnostiqués en médecine générale étaient stables ; une augmentation significative de l’incidence a été observée en 2016 13.
En complément de la surveillance en médecine générale, une surveillance des cas de BL hospitalisés en France a été mise en place à partir de la base du Programme de médicalisation des systèmes d’information (PMSI). Le taux d’hospitalisation annuel moyen associé à une BL a été estimé à 1,55 personne hospitalisée pour 100 000 habitants au cours de la période 2004-2009. Des variations régionales importantes des taux d’hospitalisation ont été observées, avec les taux les plus hauts dans les régions ayant les incidences, estimées par le réseau Sentinelles, les plus élevées 14.
Dans la présente étude, nous avons estimé l’incidence et les tendances des cas de BL hospitalisés sur la période 2005-2016 et décrit leurs manifestations cliniques avec un point particulier sur les cas de neuroborréliose.
Méthodes
Les données d’hospitalisation du 1er janvier 2005 au 31 décembre 2016 ont été extraites des bases nationales du PMSI en médecine, chirurgie, obstétrique (PMSI-MCO 15). Dans un premier temps, tous les résumés de sortie anonymes (RSA) de patients hospitalisés en France comportant en diagnostic principal (DP), relié (DR) ou associé (DA) des codes relatifs à la BL de la 10e révision de la Classification internationale des maladies (CIM-10) ont été sélectionnés : A69.2 pour la maladie de Lyme, M01.2 pour arthrite au cours de la maladie de Lyme et L90.4 pour l’acrodermatite chronique atrophiante (ACA). Ont ensuite été inclus les séjours hospitaliers répondant aux critères suivants : (i) un diagnostic spécifique de BL (M01.2 ou L90.4) en DP, DR ou DA ; (ii) un code A69.2 en DP en l’absence de tout autre diagnostic ou (iii) un code A69.2 associé à un ou des codes compatibles avec les symptômes de formes disséminées de la BL (manifestations neurologiques, cardiaques, articulaires et oculaires listées dans le tableau). Ces critères et l’algorithme de sélection ont été développés par un groupe d’experts constitué de cliniciens hospitaliers et d’épidémiologistes. Les séjours sans identifiant de patient et ceux de patients résidant hors France métropolitaine ont été exclus.
Un cas de BL a été défini comme une personne hospitalisée pour la première fois en France métropolitaine pour BL (selon les critères ci-dessus) au cours de la période 2005-2016. Seul le premier séjour a donc été sélectionné pour une personne hospitalisée plusieurs fois pour BL.
Un cas de neuroborréliose a été défini comme une personne hospitalisée avec au moins une des manifestations neurologiques spécifiques énumérées dans le tableau, associée à un code de BL.
 Agrandir l'image
Agrandir l'imageLe poids de la maladie a été décrit en termes de nombre de cas hospitalisés et de nombre de séjours hospitaliers, ainsi que par répartition géographique selon le lieu de résidence, ou lieu d’hospitalisation si le lieu de résidence n’était pas renseigné. La saisonnalité a été étudiée en prenant en compte le mois de sortie, seule variable disponible dans le PMSI pour étudier le mois d’hospitalisation.
Les taux d’incidence hospitalière pour BL ont été calculés en divisant le nombre de cas par les données de population annuelles et régionales. Les données de population utilisées sont celles qui ont été publiées au niveau national et régional par l’Institut national de la statistique et des études économiques (Insee) 16 de 2005 à 2016. Les taux d’incidence hospitalière ont également été calculés par classe d’âge, en prenant la population française de 2010 comme population de référence. Ils sont exprimés pour 100 000 habitants.
L’évaluation des tendances des incidences hospitalières au cours du temps a fait appel à une régression binomiale négative incluant le nombre de cas en tant que variable dépendante et les populations annuelles comme population d’exposition. Afin de mesurer l’effet de l’âge sur le risque de développer une neuroborréliose, des calculs d’odds ratios ont été effectués.
Résultats
Hospitalisations pour borréliose de Lyme, 2005-2016
Parmi les 29 331 dossiers extraits avec un code de BL, 11 551 répondaient aux critères d’un séjour hospitalier pour BL. Sur la période d’étude, 15 séjours de personnes ne résidant pas en métropole ont été exclus. Pour 0,6% des séjours, l’information sur le département de résidence était manquante et a alors été remplacée par le département d’hospitalisation.
Entre 2005 et 2016, le nombre annuel de séjours à l’hôpital a varié de 846 en 2005 à 1 129 en 2006, avec une moyenne de 963 séjours pour BL par an (figure 1). Au total, 9 594 cas ont été hospitalisés au moins une fois sur la période 2005-2016. Le nombre annuel de cas hospitalisés variait de 649 en 2005 à 937 en 2011, avec une moyenne de 799 cas hospitalisés par an. Le nombre séjours hospitaliers par cas variait de 1 à 40, avec un nombre médian de séjours par cas de 1 (intervalle interquartile : 1-1), 83,4% des cas n’ayant eu qu’un seul séjour hospitalier. Parmi les cas, 15% ont eu une hospitalisation de moins de 24 heures. La durée médiane d’hospitalisation était de 4 jours (de 0 à 239 jours) ; elle était de 7 jours pour les cas avec manifestations cardiaques et de 5 jours pour les manifestations neurologiques.
 Agrandir l'image
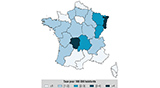
Agrandir l'imageLe taux d’incidence hospitalière moyen sur la période a été estimé à 1,3 pour 100 000 habitants par an en France métropolitaine. Ce taux fluctuait de 1,1 pour 100 000 habitants en 2005 à 1,5 pour 100 000 habitants en 2011, sans tendance significative (p=0,260) (figure 1). Ces taux variaient également par région, allant de 0,3 en Corse et en Provence-Alpes-Côte d’Azur à 4,1 en Alsace et 4,2 cas pour 100 000 habitants par an en Limousin (figure 2).
 Agrandir l'image
Agrandir l'imageLes motifs d’hospitalisation des cas étaient, pour la majorité, des manifestations neurologiques (n=4 906, 51%), puis des arthrites (n=1 250, 13%), des complications cardiaques (n=639, 7%), des manifestations oculaires (n=177, 2%) et des ACA (n=231, 2%). Pour 27% des cas, un code de maladie de Lyme a été signalé en l’absence de tout autre diagnostic.
Parmi les cas, 57% étaient des hommes. Deux pics d’incidence ont été observés en fonction de l’âge : pour le groupe d’âge 5-9 ans, avec 1,9 cas hospitalisés pour 100 000 habitants, et pour les 70-79 ans avec 2,2 cas hospitalisés pour 100 000 habitants (figure 3). L’âge médian était de 51 ans (de 1 à 95 ans). La même répartition selon l’âge et le sexe a été observée sur toute la période d’étude (données non présentées). Parmi les 1 805 cas âgés de 0 à 15 ans, 62% ont été hospitalisés pour manifestations neurologiques vs 45% (2 058/4 601) dans le groupe d’âge 15-59 ans et 54% (1 725/3 188) dans le groupe 60 ans et plus (p<0,001). Les cas âgés de 60 ans et plus étaient plus souvent hospitalisés pour des manifestations cardiaques (11%, n=320) que les cas âgés de 0 à 15 ans (0,7%, n=12) et de 15 à 59 ans (7%, n=304) (p<0,001). La même répartition selon l’âge et le sexe a été observée sur toute la période d’étude (données non présentées).
 Agrandir l'image
Agrandir l'imageLes cas ont été plus souvent hospitalisés pour BL entre juin et novembre (figure 4), avec un pic chaque année en août ou en septembre. Sur l’ensemble de la période, les cas avec des manifestations neurologiques ont été plus souvent hospitalisés pendant l’été, avec un pic en septembre (16%, p<0,001). Les cas hospitalisés pour arthrite ou manifestations oculaires ont été hospitalisés tout au long de l’année.
 Agrandir l'image
Agrandir l'imageHospitalisations pour neuroborréliose, 2005-2016
Parmi les 4 906 cas hospitalisés avec des manifestations neurologiques, 58% étaient des hommes et l’âge médian était de 52 ans (de 1 à 94 ans). Le taux d’incidence hospitalière annuel moyen pour neuroborréliose était de 0,6 cas pour 100 000 habitants, allant de 0,5 pour 100 000 en 2005 à 0,8 pour 100 000 en 2011. Le Limousin et l’Alsace étaient les régions où les taux d’hospitalisation pour neuroborréliose étaient les plus élevés, avec 2,4 cas hospitalisés pour 100 000 habitants.
Parmi les cas, 37% présentaient des affections du nerf facial (dont 27% une paralysie faciale périphérique), 35% une méningite, 9% une polyneuropathie et 9% une encéphalite, myélite ou encéphalomyélite.
Les taux d’incidence de la neuroborréliose différaient significativement selon l’âge (figure 3) avec une distribution bimodale : un premier pic chez les enfants âgés de 5 à 9 ans (1,3 cas pour 100 000 habitants) et un second pic chez les adultes de 70 à 79 ans (1,3 cas pour 100 000 habitants). Parmi les cas hospitalisés, les jeunes enfants (5-9 ans) et les personnes âgées (70-79 ans) étaient respectivement 3 fois (OR=3,02; IC95%: [2,41-3,78]) et 1,9 fois (OR=1,94; [1,58-2,39]) plus à même d’avoir été hospitalisés pour une neuroborréliose, que les cas du groupe d’âge 20-29 ans.
Discussion
Entre 2005 et 2016 en France métropolitaine, 9 594 cas de borréliose de Lyme ont été hospitalisés, soit un taux d’hospitalisation de 1,3 pour 100 000 habitants avec un pic observé au cours de l’été. On observe dans cette étude une stabilité du taux d’hospitalisation sur la période et de fortes disparités régionales, avec un taux d’hospitalisation plus important dans les régions de l’est et du centre de la France. Les taux d’hospitalisation étaient plus élevés chez les enfants de 5 à 9 ans et les adultes âgés de 70 à 79 ans.
En France, entre 2011 et 2015, les taux d’incidence nationaux estimés par le réseau Sentinelles étaient stables, avec un taux d’incidence moyen estimé à 46 cas pour 100 000 habitants [40-52] 13. En 2016, une augmentation de l’incidence a été notée, avec une incidence estimée à 84 [70-98] cas pour 100 000 habitants 13. Cette augmentation d’incidence des cas de BL observée en 2016 en médecine générale ne l’est pas en milieu hospitalier, que ce soit au niveau national ou dans les régions dites de fortes incidences. Cette discordance des tendances pourrait s’expliquer par plusieurs hypothèses. En 2016, suite au lancement du Plan national de lutte contre la maladie de Lyme et les maladies transmissibles par les tiques, des actions de sensibilisation, d’information et de formation ont été menées auprès du grand public et des professionnels de santé. Par ailleurs, les médias ont largement couvert ce sujet. Il est possible que ces actions aient conduit à une meilleure sensibilisation de la population, une meilleure détection des piqûres de tiques et des lésions cutanées ayant conduit à une augmentation des consultations en médecine générale. L’augmentation d’incidence observée en 2016 par le Réseau Sentinelles serait alors le résultat d’un artefact de surveillance en raison d’une meilleure détection de cas, et l’incidence aurait pu être sous-estimée les années précédentes. Il est aussi possible que l’incidence des formes précoces ait réellement augmenté en 2016, mais qu’en raison d’un meilleur recours aux soins et d’une meilleure prise en charge en médecine générale, cette augmentation ne se soit pas traduite par une augmentation du nombre de cas hospitalisés. En effet, un traitement précoce par antibiothérapie, ayant pour objectif l’éradication des Borrelia burgdorferi sensu lato, évite la progression vers des formes disséminées. L’augmentation de l’incidence observée par le réseau Sentinelles et la stabilité de l’incidence hospitalière estimée par le PMSI seront à confirmer pour l’année 2017.
Dans notre étude, plus de la moitié des cas hospitalisés pour BL ont présenté des manifestations neurologiques, et cette proportion est encore plus élevée chez les jeunes enfants (5-9 ans) et les personnes âgées (70-79 ans). Les méningoradiculites sont actuellement les tableaux les plus fréquents de neuroborréliose 17. Dans notre étude, plus d’un tiers des patients hospitalisés avec des manifestations neurologiques présentaient une atteinte du nerf facial et un tiers des patients présentaient une méningite, en cohérence avec les données de la littérature 17. Toujours selon la littérature, les symptômes de neuroborréliose apparaissent généralement 1 à 12 semaines après la piqûre de tique, seuls 40 à 50% des cas se rappellent avoir été piqués par une tique et entre 20 à 30% ont remarqué un érythème migrant 17. D’après les données du réseau Sentinelles, la majeure partie des cas de BL a été diagnostiquée entre mars et octobre, avec un pic en juillet, alors que les admissions à l’hôpital pour BL étaient plus importantes en septembre. Cette différence pourrait être due au délai entre la (les) morsure(s) de tique infectée(s) et le développement d’une forme disséminée de BL nécessitant une hospitalisation. Pour les patients, ce délai peut être difficile à estimer en raison d’un biais de mémoire, en particulier sur la date de la ou des piqûres de tique et en cas de non constatation d’un EM.
Les taux d’hospitalisation les plus élevés au cours de la période d’étude étaient relevés dans les régions de l’est et du centre de la France métropolitaine, correspondant aux zones de plus fortes incidences estimées par le réseau Sentinelles 13. En effet, le vecteur, la tique Ixodes ricinus, est présent dans la majeure partie de la France métropolitaine, sauf au-dessus de 1 200-1500 mètres et dans les zones sèches de Méditerranée 18. Enfin, les nymphes, principalement responsables de la transmission de Borrelia à l’homme, sont plus actives du printemps à l’automne 4,19,20. Ceci peut expliquer les incidences hospitalières plus élevées entre juillet et septembre.
L’utilisation des données du PMSI comporte certaines limites, notamment des erreurs de diagnostic et de codage, des omissions involontaires, le codage de conditions préexistantes non liées au séjour, le manque d’informations sur les diagnostics biologiques et les traitements. Il est possible que cet algorithme ait surestimé le nombre de cas hospitalisés pour BL lorsque les codes n’étaient pas directement liés à une hospitalisation pour BL. Il est également possible que la BL ne soit pas toujours diagnostiquée ou que les diagnostics de BL ne soient pas codés, conduisant à une sous-estimation du taux d’hospitalisation. Ces biais sont inhérents à l’utilisation de la base de données du PMSI, puisqu’elle a été initialement créée comme un outil d’allocation des ressources 15. L’algorithme de sélection utilisé pour définir un séjour pour neuroborréliose, développé par une équipe de cliniciens et d’épidémiologistes, a aussi ses limites. Nous pouvons surestimer le nombre de cas de neuroborréliose si les définitions de cas ont une faible spécificité. Néanmoins, sachant qu’une étude française antérieure sur les dossiers hospitaliers estimait que la valeur prédictive positive de la définition de cas basée sur la présence d’au moins un code de Lyme spécifique de la CIM 10 (A69.2 ou M01.2) n’était que de 65%, nous avons décidé d’établir une définition de cas plus spécifique 21. Nous avons cherché à réduire le bruit de fond lié à l’inclusion de « faux positifs » pouvant impacter l’interprétation des tendances. Cependant, nous ne pouvons exclure d’avoir inclus des cas non confirmés ou que nous sous-estimions l’incidence réelle par manque de sensibilité. De plus, les recommandations existantes pour le diagnostic de la neuroborréliose de Lyme en Europe reposent sur des symptômes cliniques et des analyses de laboratoire, en particulier la production d’anticorps spécifiques intrathécaux 17,22. Une étude sera mise en place afin de confronter les données du PMSI aux données cliniques et de laboratoire afin de valider davantage les algorithmes.
En attendant, malgré ses limites, la base de données du PMSI fournit des données utiles et permet de suivre les tendances dans le temps, de déterminer la saisonnalité, les régions à haut risque et les caractéristiques des patients hospitalisés. En effet, la méthode et la base de données utilisées sont stables, attributs essentiels à l’analyse des tendances. L’utilisation du PMSI comporte de plus des règles de codage strictes permettant de minimiser les erreurs et les variations entre les établissements. Le potentiel du PMSI (stabilité, fiabilité et moindre coût) pour la surveillance des maladies infectieuses a par ailleurs été démontré depuis plusieurs années, permettant ainsi de réaliser des études au niveau national 23.
Conclusion
Les données du PMSI montrent des incidences hospitalières pour la BL et pour la neuroborréliose stables sur la période 2005 à 2016, malgré une augmentation significative en 2016 de l’incidence des cas vus en médecine générale estimée par le réseau Sentinelles. Ces données, couplées à celles du réseau Sentinelles, permettent de suivre deux indicateurs-clés complémentaires : la neuroborréliose et l’érythème migrant. Malgré ses limites, le PMSI sera régulièrement analysé pour le suivi des tendances des cas hospitalisés de borréliose de Lyme. Les résultats confirment que les stratégies de prévention doivent continuer à mettre l’accent sur les mesures de prévention individuelle, en particulier pour les personnes les plus à risques et dans les régions à incidence élevée : renforcement des messages de prévention concernant notamment les moyens de protection contre les piqûres de tiques (par exemple le port de vêtements longs), le contrôle régulier sur tout le corps de la présence de tique après une exposition à risque et le retrait rapide de la tique après piqûre.
Remerciements
Nous souhaitions remercier Thomas Hanslik pour ses conseils et discussions sur cette étude, Julien Durand et Marjorie Boussac pour leur aide dans l’extraction des données du PMSI et Lucie Leon pour les discussions sur le modèle de régression.




