Évaluation médico-économique du dépistage du cancer du col de l’utérus en France
// Cost-effectiveness evaluation of cervical cancer screening in France
Résumé
Introduction –
L’Institut national du cancer a conduit une étude médico-économique de la généralisation du dépistage du cancer du col de l’utérus (CCU) afin d’évaluer l’efficience de différentes stratégies de dépistage organisé (DO).
Méthodes –
L’étude est fondée sur un modèle de microsimulation qui reproduit l’histoire naturelle du CCU. Les stratégies de DO incluaient la situation actuelle et des stratégies de DO avec invitation des femmes non-participantes au dépistage. Différents tests (frottis cervico-utérin (FCU), test HPV, double marquage immunochimique p16/Ki67) et plusieurs intervalles de dépistage (3, 5 et 10 ans) ont été évalués.
Résultats –
Toutes les stratégies de DO testées permettent d’améliorer la couverture du dépistage du CCU et de diminuer l’incidence et la mortalité qui lui sont liées. Les réductions d’incidence et de mortalité étaient comprises entre 13% et 26% et les gains d’espérance de vie atteignaient 35 à plus de 60 ans pour 10 000 femmes. Les stratégies de « rationalisation de la participation du dépistage spontané », « DO par FCU triennal avec auto-prélèvement HPV » et « DO par test HPV tous les 5 ans » constituaient la frontière d’efficience.
Conclusion –
Conformément au Plan cancer 2014-2019, l’étude confirme l’intérêt de déployer en France un programme de DO du CCU (incluant l’invitation et la relance des femmes ne participant pas spontanément au dépistage) par FCU triennal puis, à terme, par test HPV tous les 5 ans.
Abstract
Introduction –
The French National Cancer Institute conducted a medico-economic study of the implementation of cervical cancer (CC) screening to evaluate the cost-effectiveness of various organized screening (OS) strategies.
Methods –
The study is based on a microsimulation model that replicates the natural history of CC. OS strategies included the current situation, and OS with mailed invitations to non-participating women. Various screening tests (Pap test, HPV, p16/Ki67 dual stain) and different OS intervals (3, 5 and 10 years) were assessed.
Results –
All OS strategies tested improve screening coverage and reduce CC incidence and CC-related mortality. Incidence and mortality reductions related to CC were between 13% and 26%, and life expectancy gains of 35 to 60 years for 10,000 women. The efficiency frontier consisted of the following strategies: limitation of CC over-screening by strict compliance with the recommended 3-year interval, OS based on Pap-tests every 3 years + HPV self-sampling, and OS based on HPV testing every 5 years.
Conclusion –
Consistent with the 2014-2019 French Cancer Plan, the study shows that switching to a Pap-test based OS (with a call-recall system for non-participating women) every three years remains a cost-effective alternative, and could lead the way to implementing HPV-testing in the forthcoming years in France.
Introduction
L’histoire naturelle du cancer du col de l’utérus (CCU) se déroule sur une durée de 15 à 20 ans, selon un continuum de lésions histologiques précancéreuses (les néoplasies cervicales intraépithéliales ou CIN) qui font suite à la persistance de l’infection par un papillomavirus humain (HPV) oncogène à haut risque.
En France, le dépistage du CCU est avant tout un dépistage spontané (ou individuel) fondé sur un dépistage par frottis cervico-utérin (FCU) chez les femmes de 25 à 65 ans selon un rythme triennal, après deux FCU normaux réalisés à un an d’intervalle 1. Le taux de couverture global du FCU triennal a été estimé à 56,6% des femmes sur la période 2006-2008. Ce taux, qui peut paraître élevé, masque d’importantes disparités en termes d’âge, de situation socioéconomique et au plan géographique. Ainsi, 40 à 50% des femmes concernées ne participent pas du tout ou de façon irrégulière au dépistage 1,2 (voir aussi l’article de S. Barré et coll. dans ce même numéro).
Des expérimentations de dépistage organisé (DO) menées en France ont montré, pour la période 2010-2012, une augmentation du taux de couverture du dépistage global de 5 à 15 points 3. En 2010, la Haute Autorité de santé a recommandé de considérer les places du test HPV et du double marquage immunochimique p16/Ki67 en DO et d’évaluer l’impact au long terme de la vaccination anti-HPV sur les stratégies de dépistage 1.
Le Plan cancer 2014-2019 s’est donné pour objectif de permettre à chaque femme de 25 à 65 ans l’accès à un dépistage régulier du CCU via un programme national de dépistage organisé (DO) (action 1.1). Il prévoit également d’évaluer sous l’angle médico-économique la stratégie de lutte contre le CCU pour guider et réajuster les dispositifs (action 1.4) 4. Dans ce cadre, l’Institut national du cancer (INCa) a conduit une étude évaluant, au plan médico-économique, la généralisation du dépistage du CCU. Cette étude avait pour objectif d’évaluer l’efficience des différentes modalités de DO sur un horizon temporel long, en tenant compte du contexte actuel, des expérimentations françaises, des alternatives possibles de prélèvement (auto-prélèvement) et d’analyse des tests (recherche d’HPV, double marquage immunochimique p16/Ki67) ainsi que des évolutions attendues en termes de caractéristiques de la population cible et de démographie médicale.
Matériel et méthodes
L’étude s’est déroulée d’octobre 2014 à juin 2016. Elle a consisté à élaborer un modèle de simulation reproduisant l’histoire naturelle du CCU et permettant de comparer, de façon systématique et quantitative, les options et les conséquences de stratégies en termes de résultats attendus et de coûts. Des analyses de type coût-efficacité et coût-utilité (encadré 1) ont été conduites à partir des résultats de la modélisation.
Un comité de pilotage scientifique a été constitué pour apporter des avis sur les choix méthodologiques, la mise en œuvre et les résultats de l’évaluation. Les membres de ce comité ont communiqué leurs déclarations d’intérêts à l’INCa, qui les a analysées et publiées sur son site internet.
Structure du modèle
La structure du modèle est celle initialement développée par Demarteau et coll. 5, adaptée au contexte français. La simulation de l’histoire naturelle de la maladie s’appuie sur le passage des femmes à travers des états de santé mutuellement exclusifs et collectivement exhaustifs, pour des cycles d’une durée de un an (figure 1).
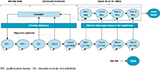 Agrandir l'image
Agrandir l'imageLa population d’analyse est générée selon ses caractéristiques d’âge, de statut CMUc (Couverture maladie universelle complémentaire), d’infection HPV, de présence de lésions précancéreuses et de cancers.
Les probabilités de transitions sont dérivées des risques de progression de la maladie issus de la littérature 5.
La vaccination anti-HPV est intégrée au modèle par le biais de la couverture vaccinale spécifique par âge et son effet par la réduction de l’incidence de l’infection HPV associée.
Les états cancéreux sont doublés d’un état diagnostiqué et sont associés à un risque de mortalité spécifique. Dans chaque état, les patientes peuvent décéder selon la probabilité de mortalité générale de la population de femmes françaises issue des tableaux de mortalité de l’Insee (Institut national de la statistique et des études économiques).
Stratégies et modalités de dépistage
Les stratégies et modalités de dépistage interviennent à chaque cycle de la simulation, permettant une prise en compte des facteurs d’adhésion aux pratiques de dépistage, de la sensibilité et de la spécificité des différentes modalités de dépistage mises en œuvre et des parcours de soin des femmes dépistées.
La fréquence de dépistage spontané des femmes est déterminée au début de la simulation. Le délai entre deux FCU et la probabilité de participer (ajustée en fonction du risque relatif de participation lié aux caractéristiques d’âge et de statut CMUc) ont été estimés à partir d’analyses réalisées dans le cadre de précédents travaux (tableau 1) 2. À chaque cycle, les femmes n’ayant pas réalisé le dépistage ou n’ayant pas reçu d’invitation au cours des trois dernières années sont invitées à participer au dépistage.
 Agrandir l'image
Agrandir l'imageLe délai de participation après un test HPV négatif est fixé par la modalité évaluée (3, 5 ou 10 ans).
Les femmes participantes réalisent un test de dépistage dont les résultats dépendent de l’état dans lequel se trouve la femme et des performances des tests (sensibilité et spécificité).
Les modalités de prise en charge après un dépistage positif ont été déterminées, selon les stratégies évaluées, soit à partir des données des expérimentations françaises, reflétant la pratique en vie réelle, soit en fonction des algorithmes de prise en charge recommandés 6.
Population simulée
La population simulée dans le modèle correspond à l’ensemble des femmes âgées de 25 à 65 ans présentant les caractéristiques de la population françaises 2,6. La répartition par âge des femmes parmi les différents états associés à l’évolution naturelle de l’infection par HPV a été obtenue à l’aide du modèle en réalisant une simulation pour une cohorte de femmes âgées de 14 ans. Ceci a permis de déterminer pour chaque âge le taux de femmes infectées, porteuses de lésions CIN 1, 2/3 ou 2/3 persistantes et porteuses de cancer de grade FIGO I, II, III ou IV (figure 2).
 Agrandir l'image
Agrandir l'imageChoix structurant de l’évaluation
Les critères de résultats principaux étaient la survie et la survie ajustée par la qualité de vie (QALY). Le nombre de cancers diagnostiqués, de colposcopies et de conisations réalisées constituaient des critères secondaires. L’efficience des stratégies de dépistage étudiées a été appréciée au moyen du rapport différentiel coûts-résultats (RDCR) qui permet d’apprécier le coût par unité de résultat supplémentaire (coût pour une année de vie/QALY gagné(e), par lésion précancéreuse diagnostiquée, par décès/cancer du col/hystérectomie évités, etc.).
L’analyse s’est placée dans un cadre cohérent avec les objectifs du Plan cancer 2014-2019 de réduction de l’incidence et de la mortalité associées au cancer, en excluant les stratégies susceptibles de conduire à une détérioration de la situation actuelle sur ces deux critères.
L’analyse a été conduite vie entière jusqu’à la disparition de la cohorte et la perspective était la perspective collective tous payeurs (incluant l’État, l’Assurance maladie, les assurances complémentaires de santé et les femmes).
L’évaluation des coûts a identifié toutes les ressources mobilisées dans le cadre du dépistage et du traitement de la population dépistée et/ou malade. Les ressources ont été valorisées selon leur coût de production (coûts directs uniquement).
Les coûts et les résultats ont été actualisés au taux annuel de 4% et, après 30 ans, à 2%.
Les coûts de prise en charge des cancers par stade de sévérité sont issus du modèle de Dervaux et coll. 7. La valorisation des autres coûts et consommation de ressources a été effectuée à partir des tarifs de l’Assurance maladie et des données issues des expérimentations. Les valeurs d’utilités et désutilités associées aux états de santé, aux actes diagnostiques réalisés et à l’attente des résultats des tests de dépistage sont issues de la littérature 5,8,9. Enfin, par hypothèse, les femmes ayant un CCU voient leur qualité de vie affectée à partir du diagnostic ou de l’apparition des symptômes du cancer pendant 15 ans.
En outre, en complément de l’analyse de référence, des analyses en scénario et en sous-groupes de la population-cible (femmes de plus de 50 ans, femmes de 25 ans, femmes bénéficiaires de la CMUc, femmes en sur-risque d’infection) ont été réalisées, ainsi que des analyses de sensibilité déterministes et probabilistes.
Interventions comparées
L’INCa a comparé des stratégies possibles de DO à la situation actuelle (dépistage spontané par FCU triennal). Les stratégies de DO étaient définies par le test de dépistage primaire et de confirmation en cas de résultat positif (FCU, test HPV, double marquage immunochimique p16/Ki67) (encadré 2) et la fréquence associée (3,5 et 10 ans). Elles incluaient systématiquement la participation spontanée au dépistage et une modalité d’invitation et de relance pour les femmes non spontanément participantes. Les stratégies de DO testées comprenaient une modalité d’amélioration du suivi des femmes dépistées positives par une réduction des taux de perdues de vue (missions dévolues aux structures de gestion des DO).
La stratégie de DO triennal par invitation et relance des femmes non-participantes à réaliser un FCU a fait l’objet de variantes : ciblage spécifique des bénéficiaires de la CMUc, envoi d’auto-prélèvements HPV vaginal ou urinaire chez les femmes relancées.
La rationalisation de la participation spontanée et la généralisation de l’invitation et relance à l’ensemble des femmes éligibles, sans possibilité de dépistage spontané, ont également été testées pour évaluer l’impact et les économies potentielles associées au strict respect de l’intervalle recommandé de 3 ans.
Le FCU, le test HPV et le double marquage immunochimique p16/Ki67 ont été évalués « en dépistage primaire » ou en « confirmation après un résultat positif » pour des intervalles entre deux dépistages de 3, 5 et 10 ans.
Résultats
Calibration et validation du modèle
La calibration a été réalisée en simulant une cohorte de femmes incluses à l’âge de 14 ans et réalisant le dépistage spontané avec une participation égale à celle observée dans les bases de données de l’Assurance maladie 2. Les probabilités de transition de l’état CIN 2/3 persistant à l’état cancer FIGO I ont ensuite été ajustées dans un intervalle de données probables afin de reproduire l’incidence du cancer par âge observé. La calibration a permis d’obtenir une adéquation satisfaisante entre les données modélisées et les données observées, notamment d’incidence (figure 3).
La structure et les résultats du modèle ont été validés selon un processus de validation interne. Le modèle a été testé avec des valeurs nulles attribuées aux paramètres relatifs aux caractéristiques de la cohorte, de l’infection et du dépistage, ainsi qu’aux coûts de prise en charge. La génération de la cohorte par le modèle, l’évolution des différents paramètres liés à l’infection ou encore la succession des examens réalisés dans le cadre du dépistage ont été analysées (figure 4). Une validation externe a été réalisée en confrontant les résultats du modèle à ceux retrouvés dans la littérature 6.
Évaluation de l’efficience des stratégies de dépistage organisé
Les résultats montrent que toutes les stratégies de DO par invitation et relance des femmes non spontanément participantes au dépistage permettent d’améliorer la couverture du dépistage et de diminuer l’incidence et la mortalité liée au CCU (tableau 2).
Les stratégies visant les femmes non-participantes permettent des réductions de l’incidence et de la mortalité liées au CCU comprises entre 13% et 26%. Ces résultats se traduisent par un gain d’espérance de vie compris entre 35 et plus de 60 ans pour 10 000 femmes éligibles au dépistage. Ils suggèrent qu’il est possible d’atteindre l’objectif fixé par le Plan cancer 2014-2019 de réduction de l’incidence et du nombre de décès par CCU de 30% à 10 ans, quelle que soit la stratégie retenue.
Les tests HPV réalisés tous les 10 ou 5 ans permettent de diagnostiquer jusqu’à 26% de lésions précancéreuses supplémentaires et permettent de réduire de 8% à 19% l’incidence de ce cancer, contre 14% à 15% pour la stratégie de DO fondée sur le FCU tous les 3 ans.
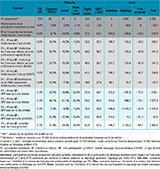 Agrandir l'image
Agrandir l'imageLes stratégies fondées sur le test HPV tous les 10 ans et tous les 5 ans avec double marquage immunochimique p16/Ki67 en confirmation, ainsi que la stratégie fondée sur le double marquage immunochimique p16/Ki67 en dépistage primaire tous les trois ans constituent la frontière d’efficience (figure 5).
 Agrandir l'image
Agrandir l'imageToutefois, deux de ces trois stratégies sont associées à des RDCR supérieurs au seuil d’efficience communément admis au plan international (30 000 à 40 000 €/QALY) 10 (tableau 3). Ainsi, la stratégie de DO fondée sur le test HPV tous les 10 ans apparaît comme la stratégie de référence au sens de l’analyse médico-économique. Cependant, son efficience est conditionnée au respect du rythme de dépistage de 10 ans, ce qui constitue une modification importante des pratiques de dépistage des professionnels et des femmes. Par ailleurs, cette stratégie est associée à une réduction de l’incidence inférieure à celles des stratégies de DO fondées sur le frottis tous les 3 ans, ce qui la rend incompatible avec les priorités du Plan cancer, malgré son efficience. En l’excluant, les résultats de l’analyse probabiliste montrent que les stratégies de DO fondé sur le FCU tous les 3 ans avec envoi de kit d’auto-prélèvement HPV à la relance et de DO fondé sur le test HPV tous les 5 ans sont les stratégies les plus efficientes pour des seuils de 30 000 et 40 000 €/QALY.
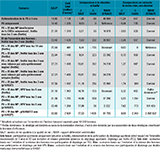 Agrandir l'image
Agrandir l'imageAnalyse de l’incertitude
Les paramètres ayant l’impact le plus important sur les résultats étaient les coûts des tests (FCU et HPV) ainsi que l’effet du suivi en DO sur la diminution des perdues de vue 6.
Dans les analyses de sensibilité, la vaccination anti-HPV ne constituait pas un paramètre susceptible de modifier la frontière d’efficience. En effet, son impact se limite aux patientes des tranches d’âge les plus jeunes dans un contexte de faible couverture vaccinale.
Quel que soit le paramètre, la stratégie d’invitation-relance avec test HPV tous les 10 ans reste efficiente au seuil de 40 000 €/QALY par rapport à la situation actuelle, même en l’absence de réduction du tarif du test et d’impact sur les perdues de vue. Des résultats similaires sont trouvés pour les stratégies d’invitation-relance avec test HPV tous les 5 ans (confirmation par FCU ou p16/Ki67).
Discussion et conclusion
L’étude a montré que la mise en place en France du DO du CCU (incluant l’invitation et la relance des femmes non spontanément participantes) constituait une amélioration de la situation actuelle, fondée sur le seul dépistage spontané, en termes de cancers évités, survie et survie ajustée par la qualité de vie des femmes.
Si le DO fondé sur un FCU tous les trois ans reste une stratégie efficiente au seuil international de 40 000 €/QALY, le passage au test HPV en dépistage primaire a été identifié comme une situation-cible pour le programme.
Les analyses de scénarios et de sensibilité ont confirmé la robustesse des conclusions du modèle. Des résultats similaires ont été retrouvés dans des publications précédentes 11,12,13.
Le modèle permet un gain de précision dans l’analyse par rapport à des modèles de cohorte de type Markov car opérant à l’échelle individuelle et alimenté par des données observées en vie réelle. Il reproduit plus fidèlement le comportement des femmes, en prenant en compte l’ensemble des éléments et paramètres possibles du dépistage.
Sa principale limite porte sur les données de probabilités de transition, la littérature étant relativement hétérogène. De plus, compte tenu de la faible prévalence des lésions, la précision des probabilités issues de la littérature est insuffisante. Toutefois, le modèle reproduit assez fidèlement les données épidémiologiques et la comparabilité avec les résultats précédemment publiés pour la France a été maintenue 6.
Enfin, dans la mesure où les inégalités de santé résultent d’un ensemble de déterminants et de leur interaction, les analyses ne captent que partiellement l’effet des stratégies sur la réduction des inégalités de santé et d’accès au dépistage. Toutefois, cette problématique a été explorée par ailleurs, montrant que, dans des populations particulièrement vulnérables et difficiles à atteindre, des gains de participation importants étaient possibles pour des impacts budgétaires très faibles au regard du coût total de la généralisation du DO 2.
En conclusion, l’étude a permis à l’INCa de formuler des préconisations de déploiement du programme national de DO du CCU (encadré 3) et les enjeux de la généralisation du dépistage ont été reprécisés : enjeu d’organisation (avec des effets non neutres sur les restes à charge pour un dépistage qui cible des femmes potentiellement en situation de vulnérabilité socioéconomique), enjeu de rationalisation des pratiques des professionnels de santé, enjeu en termes de réduction des inégalités et d’actions locales et enjeu d’organisation des parcours de santé, dans un contexte de démographie médicale des gynécologues très défavorable et de « saturation » de l’activité, mais également dans un contexte évoluant vers de nouveaux modes d’exercice ou de coopérations entre professionnels de santé.
Les analyses de décision en économie de la santé : études coût-efficacité et coût-utilité
Les analyses coût-efficacité sont menées pour évaluer les résultats à la fois économiques et de santé des technologies de santé. Elles sont conçues pour aider à la prise de décision et visent à mettre en perspective les résultats cliniques et les effets sur la santé que les interventions de santé peuvent apporter et les coûts qu’elles génèreront et/ou supprimeront.
Dans une analyse coût-efficacité, les coûts et l’efficacité d’une intervention et de ses alternatives sont estimés. Leurs différences de coûts et d’effets sont calculées et présentées sous la forme d’un ratio présentant le coût par unité de résultat de santé ou d’effet. On parle de coût différentiel, d’effet différentiel et de ratio différentiel coût-résultat (RDCR).
Dans le cas de deux stratégies de traitement a et b ayant des coûts et effets respectifs Coûta, Coûtb, Effeta et Effetb, on a la formule :
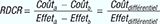
Pour comparer les effets des interventions entre les pathologies, les agences d’évaluation en santé ont souhaité disposer d’une mesure de résultats pouvant être utilisée dans toutes les disciplines.
L’unité de mesure la plus répandue répondant à ce besoin est l’année de vie ajustée par sa qualité ou QALY (Quality Adjusted Life Year). Les QALYs visent à capturer les effets des traitements en termes de survie et de qualité de vie liée à la santé simultanément.
Dans les études coût-utilité, la valeur du RDCR reflète le coût additionnel qui doit être consenti pour obtenir une année de vie ajustée par sa qualité supplémentaire.
Le plan coût-efficacité est un moyen courant de représenter graphiquement les RDCR des interventions.
– Une intervention à la fois moins coûteuse et plus efficace que le comparateur est dite dominante et est représentée au quadrant sud-est de la figure.
– Une intervention plus coûteuse et moins efficace est dite dominée et est représentée dans le quart nord-ouest du plan coût-efficacité. Une stratégie peut également être dominée par l’association de deux stratégies qui se révèlerait à la fois plus efficace et moins chère. La stratégie est dite faiblement dominée.
– Les situations représentées dans les autres quadrants du plan correspondent à des scénarios plus coûteux et plus efficaces ou moins coûteux et plus efficaces et requièrent un arbitrage en termes de décision, correspondant au seuil coût-efficacité au-delà duquel la société n’est plus encline à payer pour un QALY supplémentaire.
Tests de dépistage évalués dans le modèle
Le frottis cervico-utérin (FCU) ou frottis est un examen médical qui consiste à prélever des cellules au niveau du col utérin. Le recueil réalisé à visée
de dépistage permet, par une analyse cytologique, d’identifier des modifications cellulaires évocatrice de lésions précancéreuses ou de cancer.
Par convention dans l’article, FCU et frottis désignent l’analyse cytologique et non le prélèvement
Le test HPV (test de recherche du génome (ADN) des papillomavirus humains) est un test de biologie moléculaire réalisé à partir d’un prélèvement cellulaire au niveau du col utérin (FCU ou auto-prélèvement). Il détecte les infections HPV par identification de la présence d’ADN viral et permet de déterminer la présence de certains types viraux à haut risque oncogène (HPV-HR). Les HPV-HR constituent un facteur de risque de lésion précancéreuse ou de cancer du col de l’utérus.
Le double marquage immunochimique p16/Ki67 est une technique de marquage immunologique des cellules, utilisé en histologie ou en cytologie. p16 et Ki67 sont des témoins intracellulaires de la transformation de la cellule : la surexpression de la protéine p16 est le reflet d’une infection virale par un HPV-HR et l’antigène Ki67 est un marqueur de la prolifération cellulaire. L’analyse combinée permet d’estimer le risque évolutif des lésions précancéreuses.
Préconisations de l’Institut national du cancer (INCa) pour la généralisation du dépistage du cancer du col de l’utérus
Du fait des contraintes fortes de calendrier, des risques identifiés et des prérequis non satisfaits à ce jour pour le passage au test HPV en dépistage primaire en France (situation cible), l’INCa préconise que le programme national de dépistage organisé (DO) du CCU se mette en place :
– en créant les conditions du passage à terme au test HPV en dépistage primaire, au travers :
– de son cahier des charges et des circuits d’information entre les professionnels de santé et acteurs impliqués ;
– du système d’information du programme (en cours d’élaboration) ;
– des indicateurs d’impact et d’évaluation et des données à collecter ;
– de la généralisation du prélèvement en milieu liquide ;
– de la mise en place du système d’assurance qualité intégrant le suivi des pratiques (dépistage, suivi, prise en charge) et de la qualité des prélèvements ;
– d’une amplification des actions de diversification des préleveurs (incitations, coopérations, etc.) ;
– du renforcement de l’implication du réseau des anatomo-cytopathologistes (y compris harmonisation des tarifications).
– en tenant compte à court terme de la hiérarchisation des stratégies de DO fondée sur le FCU :
– en cas de ressources limitées, invitations et relances en direction des femmes bénéficiaires de la CMUc ne participant pas spontanément au dépistage dans l’intervalle recommandé ;
– puis extension rapide des invitations/relances à l’ensemble des femmes non spontanément participantes ;
– enfin, envoi à la relance de kits d’auto-prélèvement vaginal permettant la recherche d’ADN HPV afin d’identifier, parmi les femmes les plus réfractaires au dépistage, celles plus à risque de CCU et de concentrer les moyens dans leur direction ;
– en mettant en place les évaluations nécessaires afin :
– d’intégrer progressivement et efficacement les innovations technologiques attendues en dépistage du CCU dans un cadre organisé stabilisé ;
– de disposer d’une visibilité plus importante sur des problématiques peu explorées en population générale ou en conditions réelles (qualité et performance des tests, reproductibilité, fourniture à une échelle industrielle, etc.) ainsi que sur leurs coûts de production, de façon à autoriser une négociation tarifaire qui permette de replacer leur niveau d’efficience en deçà des seuils généralement admis au plan international et qui les rende acceptables dans un contexte de ressources limitées et budgétaire contraint.
Remerciements
Les auteurs remercient les membres du Comité de pilotage scientifique de l’étude pour leur contribution à la qualité de l’étude : Pr J-J Baldauf (CHU de Strasbourg), Dr A-S Banaszuk (Structure de gestion du Maine-et-Loire), N Beltzer (Santé publique France), Dr M-B Ben Hadj Yahia (CHRU de Lille), J Bonastre (Institut Gustave Roussy), Dr V Dalstein (CHU de Reims), Dr M Flori (Université de Lyon 1), J Gaillot (Institut national du cancer), C Gastaldi-Ménager (CnamTS), K Haguenoer (CHRU de Tours), F Hamers (Santé publique France), G Launoy (CHU de Caen, Inserm), P Lucidarme (Collège national des sages-femmes), E Ricard (Ligue nationale contre le cancer), J-P Romarin (Agence régionale de santé Occitanie), C Rumeau-Pichon (Haute Autorité de santé), E Salines (Direction générale de la santé), N Thomas (Structure de gestion de Guyane), A Trugeon (Observatoire régional de santé de Picardie), H Vandewalle (Institut national du cancer), A-S Woronoff (Registre des cancers du Doubs), L Zanetti (Haute Autorité de santé).







