Structuration évolutive d’une surveillance multi-sources pour répondre à une infection émergente : l’expérience française face à la Covid-19
// Building a dynamic, multi-source surveillance system for an emerging infectious disease: Experience with COVID-19 in France
Résumé
L’émergence de la Covid-19 a confronté l’ensemble des pays à de nombreux défis, tant sanitaires qu’économiques, sociétaux et politiques. L’un d’entre eux a été le déploiement rapide d’un système de surveillance multi-sources réactif, adaptable au cours du temps, permettant de produire les indicateurs épidémiologiques nécessaires à la gestion de l’épidémie. Cet article décrit la construction du système de surveillance de la Covid-19 en France par Santé publique France et ses partenaires à partir du mois de janvier 2020 et son évolution au cours de la pandémie. La progression rapide des connaissances sur le SARS-CoV-2, en particulier sur sa transmission, l’infection qu’il provoque, les populations qu’il affecte le plus et les différents facteurs de risque de maladie, d’hospitalisation ou de décès, a rendu le défi d’autant plus grand, nécessitant une adaptation continue des modalités de surveillance et des mesures de prévention contre la diffusion du virus.
Abstract
The emergence of COVID-19 confronted every country in the world with numerous challenges, primarily concerning health but equally involving the economic, social and political spheres. One of these challenges was the fast structuration and implementation of a responsive multi-source surveillance system, flexible to adaptation, which would provide epidemiological indicators relevant to decisions on disease control. This article describes how the national public health agency, in collaboration with its partners, proceeded to build such a system in January 2020; a system that would continue monitoring COVID-19 trends in France throughout the course of the pandemic. The rapid advances in knowledge on SARS-CoV-2, particularly its transmission, its clinical presentation, the most affected populations and the numerous risk factors associated with serious illness, hospitalisation or death, added further complexity to the task because the surveillance methods and tools required constant adaptation, as did the preventive measures to curb the spread of the virus.
Introduction
La construction d’un système de surveillance est guidée en premier lieu par des objectifs qui doivent être déterminés en amont de son élaboration 1,2. Dans les suites de l’apparition d’une maladie émergente, trois phases peuvent se succéder : l’introduction de l’agent pathogène en cause dans un territoire, sa diffusion (limitée dans un premier temps, puis soutenue au sein de la population) et sa pérennisation. Afin de mettre en place les mesures de gestion pour éviter ou ralentir le passage d’une phase à la suivante, un système de surveillance doit être déployé au plus tôt après la détection de l’émergence. Ce déploiement rapide nécessite de disposer d’une infrastructure de santé publique performante et réactive. Celle-ci doit être dotée d’une capacité de surveillance et d’investigation épidémiologique, clinique et microbiologique opérationnelle de haut niveau scientifique mobilisable à tout moment. Le premier objectif de la surveillance doit être la détection rapide des premiers cas sur le territoire à des fins d’investigation et de mise en place de mesures de contrôle rapides (ex : isolement, retrait d’un aliment potentiellement contaminé du marché, lutte anti-vectorielle, etc.). Si une transmission interhumaine est suspectée (puis documentée) lorsque les premiers cas, souvent sporadiques, sont détectés, l’objectif suivant est d’éviter l’apparition de chaînes de transmission secondaires et de cas groupés. Pour cela, l’investigation des cas doit intégrer l’identification et le suivi de l’ensemble des personnes contacts qu’ils ont pu contaminer (contact-tracing). Dans les premières phases de l’émergence, les mécanismes de transmission ne sont pas nécessairement connus (mode de transmission, période d’infectiosité au regard des manifestations cliniques, contagiosité des personnes asymptomatiques, etc.). Il est donc nécessaire d’émettre des hypothèses sur la base de la description des premiers cas et d’expériences passées, dont les plus récentes en France en lien avec des coronavirus étaient les épidémies de SARS (ou SRAS : syndrome respiratoire aigu sévère) en 2003 3 et MERS-CoV (coronavirus du syndrome respiratoire du Moyen-Orient) en 2012 4. Ces hypothèses permettent d’élaborer les premières définitions de cas et de proposer les mesures de gestion qui pourront être mises en œuvre autour des cas et de leurs contacts. Ce sont ensuite les résultats de la recherche (clinique, microbiologique, etc.) et des investigations épidémiologiques autour des premiers cas qui permettent de mieux caractériser le phénomène et d’affiner au mieux les outils de la surveillance et de gestion. Il est donc nécessaire d’impliquer dès le début les acteurs de la recherche, d’entretenir des liens privilégiés avec ceux-ci et de développer en amont les partenariats avec les acteurs au niveau territorial pour mener des actions. Lorsque des chaînes de transmission sont découvertes et qu’elles se multiplient, il est important de poursuivre l’identification des cas et de leurs contacts afin de ralentir la diffusion de la maladie sur le territoire. En effet, tous les outils de prévention à l’échelle d’une population ne sont pas nécessairement disponibles dans les premiers temps d’une épidémie (a fortiori d’une pandémie liée à un virus émergent), en particulier la vaccination. Néanmoins, dès l’identification des premiers cas, il est nécessaire d’anticiper l’évolution de la surveillance pour être en mesure d’apprécier l’ampleur de la diffusion de la maladie et en évaluer l’impact potentiel sur la population et le système de santé.
Santé publique France, Agence nationale de santé publique sous tutelle du ministère de la Santé et de la Prévention (MSP), a pour missions, entre autres, la mise en place et la coordination de la surveillance des maladies ainsi que la prévention et l’alerte sanitaire. Cette agence d’expertise scientifique est constituée d’un siège en région parisienne et d’équipes en régions, afin d’assurer la continuité entre les missions d’expertise et les mesures de gestion relatives à la santé au sein des territoires.
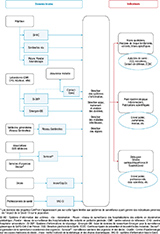
La construction du système de surveillance de la Covid-19 en France s’est fondée sur des expériences passées de surveillance épidémiologique des maladies infectieuses, qu’il s’agisse de modalités existantes concernant les risques d’importation de maladies émergentes (Ebola, SARS, MERS-CoV, grippe A(H1N1)pdm09, etc.) ou le suivi d’épidémies d’infections respiratoires saisonnières (grippe, virus respiratoire syncytial (VRS), etc.), voire d’évènements exceptionnels non infectieux tels que la canicule. Le dispositif de surveillance a également pu être influencé par les recommandations et besoins à l’échelle internationale, notamment européenne, en maintenant des liens forts avec l’ECDC (European centre for disease prevention and control) et les agences de santé publique internationales. De manière très réactive devant l’ampleur et la rapidité de la propagation de l’épidémie, des systèmes de surveillance existants ont été adaptés et complétés par la mise en place de nouvelles modalités adaptées aux caractéristiques de cette infection émergente et des besoins d’action en santé publique (figure 1). À la dimension individuelle de la surveillance initiale centrée autour des cas, s’ajoute alors une dimension populationnelle, les deux types de surveillance ayant coexisté pendant plusieurs mois.
L’objectif de cet article est de décrire la construction du dispositif de surveillance multi-sources pour l’aide à la décision (mesures de contrôle, organisation des soins, évaluation des actions etc.), son adaptation progressive, ses forces et ses limites dans un contexte de pandémie. Les résultats issus de ce dispositif ne sont pas détaillés dans cet article.
Chronologie de la construction de la surveillance de la Covid-19
Chaque méthode de surveillance est élaborée afin de produire des indicateurs devant répondre aux objectifs identifiés lors des différentes phases de l’épidémie. L’ensemble des systèmes mis en place répondent aux missions de Santé publique France et suivent les règles du Code de la santé publique français (articles L. 1413-7 and L. 1413-8) et de la Commission nationale de l’informatique et des libertés (Cnil). Certains systèmes ont été mis en place suite à la loi n° 2020-290 du 23 mars 2020 d’urgence pour faire face à l’épidémie de Covid-19 et ses différentes prolongations, et leur adaptation à la sortie de l’état d’urgence est en cours d’élaboration.
Phase précédant l’introduction du SARS-CoV-2 en France : détecter une potentielle introduction
Les premières informations concernant un cluster de pneumopathies d’origine inconnue lié à la fréquentation d’un « wet market » dans la ville de Wuhan (Chine) ont été diffusées fin décembre 2019 (message Promed n°20191230.6864153), avant que les autorités de santé chinoises n’alertent l’Organisation mondiale de la Santé (OMS) de manière formelle le 31 décembre 2019. Dès le 10 janvier 2020, Santé publique France, en lien avec le ministère des Solidarités et de la Santé (MSS) et en collaboration avec le Centre national de référence des virus des infections respiratoires (CNR‑VIR), les cliniciens experts des maladies émergentes de la mission Coreb (Coordination opérationnelle – Risque épidémique et biologique) et les infectiologues, élaborait une première définition de cas d’infection au nouveau coronavirus. Cette définition de cas, adaptée de celle utilisée pour identifier les cas d’infection par le MERS-CoV 4, constituait une première étape essentielle de la stratégie de surveillance. En effet, elle permettait de structurer et d’organiser la prise en charge des signalements de cas suspects d’infection par le SARS-CoV-2, en définissant les cas possibles, probables et confirmés. Une technique de diagnostique fiable et sensible a été mise au point par le CNR-VIR le 16 janvier 2020, grâce au partage des premières séquences par la Chine, afin de permettre la confirmation des premiers cas 5. Les enjeux du système de surveillance étaient, à ce stade, de pouvoir détecter tous les cas d’introduction de cette nouvelle infection respiratoire sur le territoire national afin d’éviter une transmission autochtone de la maladie, avec une remontée centralisée des signalements au niveau national, et d’enrichir les connaissances disponibles. Pour cette raison, la définition de cas devait être sensible pour en identifier le maximum tout en tenant compte des capacités d’hospitalisation en établissement de santé de référence pour le Risque épidémique et biologique et des capacités de diagnostic biologique. Cette surveillance nécessitait l’information et la communication d’outils (définition de cas, conduite à tenir, modalités d’envoi des prélèvements au CNR-VIR) à l’intention des professionnels de santé pour l’identification des cas suspects et leur signalement aux autorités de santé (agences régionales de santé – ARS – et Santé publique France pour centraliser les données) (1).
Phase d’introduction : éviter les chaînes de transmission autochtones
Les trois premiers cas ont été confirmés par le CNR-VIR le 24 janvier 2020 6. La définition de cas a ensuite évolué, avec les connaissances sur sa diffusion au plan international, permettant ainsi d’adapter régulièrement les zones à risque d’importation de la maladie. La surveillance est restée fondée sur le signalement des cas suspects aux ARS par les cliniciens, leur classement en cas possible par les équipes en région, puis l’envoi des prélèvements au CNR-VIR pour confirmation dans les premiers temps. Les cas possibles ont été enregistrés individuellement au niveau national dans une base de données simple où étaient collectées des informations démographiques, cliniques et d’exposition. Chaque cas confirmé a donné lieu à une investigation pour l’identification de l’ensemble des personnes contacts à risque sur le territoire afin d’éviter ou d’interrompre toute chaîne de transmission par l’isolement, le dépistage des personnes contacts asymptomatiques et le diagnostic des personnes contacts en cas de symptômes.
Premières chaînes de transmission – premiers regroupements de cas (clusters) : éviter la diffusion
Début février 2020, une première chaîne de transmission locale a été identifiée, mais les investigations réactives autour des cas et l’isolement des personnes-contacts ont permis de l’interrompre. Au total, 12 cas ont été confirmés dans une station de sports d’hiver dans les Alpes 7. Si le nombre total de cas confirmés est resté limité durant cette période en France, le système en place, très sensible, a permis l’identification d’un grand nombre de cas suspects, mettant ainsi en exergue la nécessité de faire rapidement évoluer l’outil de recueil d’informations. Un nouvel outil, « Go.Data » (initialement développé par l’OMS pour les investigations de fièvres hémorragiques virales en Afrique subsaharienne), a été adapté et mis en place, afin de recueillir au sein d’une même base de données les informations sur les cas suspects et leurs contacts. En parallèle, dans l’objectif de répondre à la nécessité d’augmenter le volume de tests diagnostiques à la suite de l’identification d’un nombre toujours croissant de cas suspects, la technique de diagnostic a été progressivement transférée par le CNR-VIR aux laboratoires hospitaliers, puis aux laboratoires de ville (avec validation initiale des premiers résultats par le CNR-VIR). Devant le nombre croissant de laboratoires acquérant la technique de diagnostic (technique du CNR-VIR, PCR « maison » pour certains laboratoires ou kits commerciaux progressivement mis sur le marché) et l’augmentation du nombre de tests réalisés, le système de surveillance a évolué : un circuit d’envoi de tous les résultats des laboratoires hospitaliers vers les ARS et Santé publique France (niveaux régional et national) a été mis en place fin février 2020. Le réseau 3-Labos, déjà utilisé pour la surveillance de plusieurs maladies infectieuses (dont les arboviroses) et composé de laboratoires privés centralisateurs, représentait une part importante des prélèvements réalisés hors-hôpitaux sur le territoire (laboratoires Pasteur-Cerba et Eurofins-Biomnis initialement, rejoints par Inovie ensuite). Il a été également sollicité et a ainsi permis une mise à disposition rapide des résultats des RT-PCR recherchant le SARS-CoV-2 prélevés, notamment dans les laboratoires de ville, dès le 14 mars 2020. Bien que ne couvrant qu’une proportion des prélèvements réalisés sur le territoire, le réseau a permis la production du taux de positivité, l’un des premiers indicateurs de circulation du virus et son suivi dans le temps.
Phase de diffusion et de circulation du virus
Un premier cluster dans l’Oise, puis un événement de super-propagation dans le Haut-Rhin, détectés fin février 2020, ont donné lieu à un nombre exponentiel de cas de Covid-19 et à des chaînes de transmission dans de très nombreuses régions. Dans ce contexte de diffusion, les outils de détection des cas et de suivi des contacts en place ont été rapidement dépassés, engendrant l’impossibilité de mener autour de chaque cas sur l’ensemble du territoire une investigation épidémiologique détaillée, des actions d’identification des contacts et la mise en place de mesures individualisées (contact-tracing). Les objectifs ont ainsi été adaptés à une surveillance populationnelle visant à suivre l’impact de la maladie en termes de dynamique temporo-spatiale et de sévérité, et ses conséquences sur le système de santé. En parallèle, l’identification des cas et de leurs contacts à risque se poursuivait pour continuer à ralentir la diffusion de l’épidémie et préserver le système de soins, mais également aider à cibler les mesures de gestion et en évaluer l’impact.
Les premiers indicateurs de surveillance ont été construits à partir de systèmes et de collaborations existants, (notamment ceux de la surveillance de la grippe) et ont été adaptés à la Covid-19 (figure 2). La surveillance syndromique, basée sur des indicateurs sanitaires non spécifiques et déjà opérationnelle à Santé publique France, a été adaptée dès fin février 2020 à la surveillance de la Covid-19. Ceci a permis d’apporter des données complémentaires aux résultats des cas confirmés des laboratoires de biologie médicale. Elle a permis une surveillance des cas suspects de Covid-19 provenant des données des associations SOS Médecins et des services d’urgence hospitaliers (réseau Oscour®) 8,9. Ces deux dispositifs, établis sur une remontée automatique des actes avec diagnostics médicaux, quasi-exhaustifs et en temps réel depuis plusieurs années, ont permis de suivre de manière plus sensible et réactive les tendances épidémiologiques dans les différentes classes d’âges et à différentes échelles géographiques en s’affranchissant du délai de confirmation virologique. Ces systèmes ont assuré en parallèle le maintien de la surveillance des pathologies autres que la Covid-19 motivant un recours aux soins d’urgence. Leur principale limite résidait, a contrario, dans le manque de spécificité de la définition de cas, reposant au moins au début de l’épidémie uniquement sur des données cliniques. Par ailleurs, pour la médecine de ville, les médecins généralistes du réseau Sentinelles ont complété la surveillance des cas suspects de Covid-19 10.
 Agrandir l'image
Agrandir l'imageAfin de suivre la dynamique épidémique et d’estimer son poids sur le système hospitalier, une surveillance des cas hospitalisés a été construite à partir d’un outil préexistant : le Système d’information pour le suivi des victimes d’attentats et de situations sanitaires exceptionnelles (SI-VIC). Cet outil, initialement conçu pour évaluer l’impact des attentats sur l’hôpital, a été adapté pour produire, dès le 18 mars 2020, des indicateurs hospitaliers quotidiens à différentes échelles géographiques. Ces indicateurs hospitaliers, basés sur un enregistrement exhaustif des cas confirmés biologiquement ou radiologiquement, ont permis, avant l’implémentation d’un outil de remontée automatisée des cas confirmés biologiquement, le suivi de la dynamique épidémique, à la différence des premiers indicateurs provenant des données de laboratoires (ces dernières étaient incomplètes avant la généralisation de l’outil Si-DEP, décrit ci-après, et très dépendantes de la capacité de tests des laboratoires, au recours au diagnostic en cas de symptômes ou aux politiques de dépistage destinées à identifier les infections asymptomatiques).
Pour répondre au besoin d’identification des nouveaux cas, un nouveau système de surveillance virologique, le Système d’information de dépistage (SI-DEP), a été conçu dans le but d’obtenir une remontée automatique de tous les tests réalisés par l’ensemble des laboratoires de biologie médicale sur le territoire français. Cette automatisation, moins contraignante pour les laboratoires, était nécessaire pour une remontée exhaustive et rapide des résultats. Le système a été développé en deux mois et activé en mai 2020 au sortir de la première vague. Pour répondre aux objectifs identifiés, des indicateurs épidémiologiques de suivi de l’évolution de l’épidémie ont été construits, produits et mis à disposition de manière quotidienne à partir du SI-DEP. Cette base de données permettait également d’alimenter celle de l’Assurance maladie (Contact-Covid, Caisse nationale de l’assurance maladie – Cnam), qui a été chargée à partir de ce moment d’assurer le contact-tracing, en relais des ARS et des équipes de Santé publique France en région. Santé publique France a également produit, analysé et restitué à différents échelons géographiques les indicateurs issus de la base de données Contact-Covid en collaboration avec l’Assurance maladie.
Le délai nécessaire à la consolidation des données de laboratoires (en moyenne trois jours) et les variations de stratégies de dépistage instaurées au cours du temps impactant les indicateurs produits à partir de SI-DEP ont imposé le maintien d’une surveillance multi-sources, afin de détecter les modifications de tendances de manière précoce.
Au-delà du suivi quotidien de l’épidémie via ces données d’observation, la mise en place, en collaboration avec l’Unité de modélisation des maladies infectieuses de l’Institut Pasteur, du suivi des nombres de reproduction effectifs des cas (i.e le nombre de cas secondaires générés par un cas source), des passages aux urgences ou des hospitalisations a permis d’apprécier en temps réel la dynamique épidémique et les tendances prévisibles pour les semaines à venir, sous l’hypothèse de l’absence de modification des comportements individuels ou des mesures de contrôle collectives 11.
Alors que le nombre de cas diminuait, à la suite de la première vague épidémique, l’attention s’est de nouveau portée sur la surveillance des clusters. En effet, lorsque l’incidence est redevenue basse, les clusters pouvaient être à l’origine de la plupart des nouvelles contaminations, et donc de reprises épidémiques, s’ils n’étaient pas maitrisés rapidement. Un outil de surveillance à visée d’alerte a été mis en place en population générale au sein de chaque région via la base de données de monitoring des clusters (Monic), permettant leur description, leur suivi, et une évaluation de leur criticité en termes de sévérité et de risques de diffusion communautaire. Ces données ont permis d’informer rapidement les autorités de santé nationales, mais également locales, pour la mise en œuvre d’actions spécifiques autour de ces situations à risque 12. La surveillance des clusters a également permis de mieux comprendre les modes de transmission et d’amplification de l’épidémie au sein de collectivités ou secteurs d’activité.
Surveillance de la sévérité et impact sur le système de soins
Parallèlement au suivi de la dynamique de l’épidémie, les systèmes mis en place ont également permis d’évaluer l’impact et le poids de la maladie sur la population et le système de santé en France.
Le système SI-VIC a permis d’évaluer en temps réel les formes sévères de la maladie et le niveau de saturation des hôpitaux français tout au long de la crise selon le type de service, notamment dans les services de soins critiques, dont les réanimations. En complément des travaux de modélisation déjà mentionnés, les indicateurs hospitaliers ainsi générés, mis à disposition en temps réel des équipes de modélisation, ont permis d’estimer la sévérité de la maladie chez les personnes infectées en début d’épidémie 13, puis de réaliser des projections sur la dynamique de l’épidémie au niveau hospitalier selon différentes hypothèses quant aux mesures de contrôle mises en œuvre au niveau individuel ou collectif. L’une des limites concernant les données issues de SI-VIC est liée aux évolutions dans le temps des modalités d’admission à l’hôpital ou en soins critiques, en particulier en fonction de l’âge et du degré de saturation des services hospitaliers. Par ailleurs, les indicateurs issus de SI-VIC ne pouvaient être déclinés qu’en régions ou départements d’hospitalisation, alors que la majorité des indicateurs de circulation du virus l’étaient en régions ou départements de résidence. De plus les transferts de patients entre régions, du fait de pressions hospitalières variables selon les territoires, ont dû être pris en compte pour interpréter l’évolution des indicateurs hospitaliers aux échelons départementaux.
Afin de limiter la charge de travail liée à la saisie des données dans le dispositif SI-VIC et en assurer la qualité et l’exhaustivité, très peu d’informations concernant les caractéristiques des cas hospitalisés y sont recueillies. Pour compléter cette surveillance avec des données plus précises sur les caractéristiques des cas graves, une surveillance sentinelle, basée sur l’expérience de la grippe et un réseau de services de réanimation volontaires a été également mise en place. Grâce à ce système sentinelle, nous avons pu obtenir des données détaillées sur les comorbidités, le degré de sévérité (modalités de prise en charge) ou le devenir des patients hospitalisés en réanimation.
Enfin, pour estimer et suivre la mortalité liée à la Covid-19, plusieurs sources de données ont été rapidement adaptées. Ainsi, les décès des patients infectés par le SARS-CoV-2 ont été rapportés par les établissements de santé (décès hospitaliers notifiés dans SI-VIC), par les établissements et services médico-sociaux (ESMS) (décès des résidents à l’hôpital ou en ESMS) et par la certification électronique des décès, qui représente un échantillon du nombre total de décès en France. En revanche, les décès survenus en milieu communautaire incluant les décès survenus à domicile n’ont pas pu être pris en compte avec réactivité, en raison de la trop faible utilisation de la certification électronique des décès en dehors des établissements de santé. Par ailleurs, la surveillance de l’excès de mortalité toutes causes à partir des données d’état civil transmises par l’Institut national de la statistique et des études économiques (Insee) 14,15 a permis de montrer, dès les premières semaines de la diffusion de la maladie, le poids direct et indirect de la propagation de la Covid-19 dans la population française en termes de mortalité, et de pointer également des différences à l’échelle régionale, ou même départementale.
Surveillances spécifiques de sous-groupes de population
Les différentes populations à risque ont été identifiées dès les premières semaines, notamment les personnes les plus âgées résidant dans les établissements d’hébergement pour personnes âgées dépendantes (Ehpad), où un nombre important de cas groupés a été détecté avec des taux de mortalité très élevés. Adaptée également de la surveillance de la grippe, une surveillance spécifique de la Covid-19 dans les collectivités de personnes âgées (Ehpad-Ehpa et autres) et les autres types d’établissements médico-sociaux (EMS) a été construite. Un outil spécifique a été mis à disposition de ces établissements par Santé publique France via le portail des signalements du ministère de la Santé à partir du 28 mars 2020.
Les personnels de santé, s’ils ne sont pas à risque de formes plus sévères, ont été nettement plus exposés que la population générale à la Covid-19 et ont représenté, de ce fait, une population à risque d’infection, en plus d’être indispensables au bon fonctionnement du système de santé. Un protocole de surveillance des professionnels salariés d’établissements de santé publics et privés incluant un outil spécifique de recueil des données, a été déployé à partir de fin avril 2020 par Santé publique France, en partenariat avec le Groupe d’étude sur le risque d’exposition des soignants aux agents infectieux (Geres) et avec l’appui des centres d’appui pour la prévention des infections associées aux soins (Cpias), des équipes opérationnelles d’hygiène et de médecine du travail.
Le système de signalement des infections associées aux soins (e-SIN) a inclus, à partir du 3 mars 2020, les cas de Covid-19 se déclarant au sein des établissements de soins, permettant ainsi d’évaluer leur impact sur le système de soins et de contribuer au dispositif de surveillance des clusters à visée d’alerte.
Fin avril 2020, en France et dans d’autres pays, des cas de myocardites évocatrices de maladie de Kawasaki chez des enfants ayant un antécédent récent de Covid-19 ont été signalés. Santé publique France et l’ensemble des sociétés savantes de pédiatrie ont mis en place, dès le 30 avril 2020, une surveillance active de ces syndromes, recensés sous l’appellation de « syndromes inflammatoires multi-systémiques pédiatriques » (Pims : Pediatric inflammatory multisytem syndrome), afin d’en évaluer l’incidence et d’améliorer les connaissances pour leur prise en charge 16. Deux réseaux de surveillance des hospitalisations des enfants ont été alors construits par les professionnels au sein de services volontaires, l’un en réanimation pédiatrique (réseau Picure) et l’autre en service de pédiatrie générale (étude Pandor), afin d’évaluer et documenter la sévérité de la Covid-19 et de ses potentielles complications chez l’enfant.
En 2021, plusieurs signalements relatifs à la survenue de complications particulièrement graves chez les femmes enceintes infectées par le SARS-CoV-2 durant la grossesse et le péri-partum, ainsi que chez les nouveau-nés ont été partagés avec Santé publique France. Un système de surveillance du nombre de nouveau-nés nés dans un contexte d’infection au SARS-CoV-2 et hospitalisés en soins critiques de niveau 3 a été mis en place en novembre 2021, en collaboration avec la Société française de néonatalogie.
Surveillance virologique (séquençage et criblage)
Après plusieurs mois de circulation du virus, l’amélioration des connaissances sur la diffusion du SARS-CoV-2 et ses caractéristiques virologiques ont permis de mieux comprendre la dynamique de son évolution et de mettre en évidence dès fin 2020 l’émergence de mutations et lignages impactant de manière significative sa transmission ou sa capacité d’adaptation au système immunitaire de l’hôte, sa sévérité et la performance des tests de diagnostic. Ainsi, l’émergence des variants Alpha fin 2020, puis Bêta et Gamma dans les départements et régions d’outre-mer (DROM), Delta au printemps 2021 et enfin Omicron fin 2021 à l’échelle mondiale ont donné lieu à des modifications épidémiologiques majeures conduisant la France à renforcer la surveillance génomique du SARS-CoV-2, initialement conduite sous l’égide du seul CNR-VIR. Le consortium Emergen (2) (consortium pour la surveillance et la recherche sur les infections à pathogènes émergents via la génomique microbienne) a donc été créé en janvier 2021 par Santé publique France et l’Agence nationale de recherches sur le sida et les hépatites virales | Maladies infectieuses émergentes (ANRS|MIE) pour fédérer l’ensemble des capacités de séquençage publiques et privées disponibles. En plus des indications de séquençage à visée interventionnelle en cas de cluster, d’échec vaccinal, de réinfection ou chez les cas au retour d’un séjour à l’étranger, ses objectifs étaient de caractériser les variants circulants, au moyen d’enquêtes représentatives répétées de manière régulière (enquêtes Flash hebdomadaires) et d’être en capacité de détecter de manière précoce tout nouveau variant émergent. Les données de cette surveillance ont été par ailleurs utilisées pour des analyses de risque conduites deux fois par mois, puis de manière mensuelle par Santé publique France et le CNR-VIR pour classifier les différents variants selon leurs caractéristiques (les variants qualifiés de préoccupants – VOC, variant of concern – faisant l’objet de mesures de gestion ciblées) et leur impact potentiel sur la santé publique.
Les délais propres au transfert des prélèvements et au séquençage (plusieurs jours) étaient toutefois incompatibles avec un rendu de résultat permettant d’orienter ces mesures de gestion. Ainsi, une stratégie de dépistage exhaustive et réactive des mutations spécifiques de certains VOC (L452R et variants Delta, 501Y et Alpha, par exemple) a été mise en place dans tous les laboratoires sur la base de RT-PCR dites « de criblage », dont le résultat est disponible en quelques heures. L’intégration des résultats de ces tests était réalisée au sein de la base SI-DEP, afin d’alimenter les données de surveillance et celles du contact-tracing, et ainsi mettre en place certaines mesures différenciées en amont des résultats de séquençage, mais également de suivre la diffusion temporo-spatiale des variants préoccupants de manière plus réactive dans les régions et territoires.
Surveillance sérologique populationnelle
La diffusion du SARS-CoV-2 dans la population, de même que la vaccination dans un second temps, ont engendré progressivement une augmentation de la séroprévalence, conférant une immunité relative naturelle à une grande partie de la population exposée. Des études de séroprévalence répétées dans le temps sur des échantillons prélevés à partir du mois de mars 2020 ont été réalisées pour connaître la part de la population exposée au virus ayant développé des anticorps contre le SARS-CoV-2 17, qu’ils soient liés à une immunité naturelle ou vaccinale. Ces études sont réalisées à partir de « fonds de tubes » issus de prélèvements sanguins effectués en laboratoires de biologie médicale privés ou publics dans le cadre d’un examen de biologie spécialisée autre que la recherche du SARS-CoV-2 (examens réalisés par les laboratoires Cerba ou Eurofins Biomnis). Ces analyses permettent de prendre en compte les formes asymptomatiques, dont seule une proportion est captée par les stratégies de dépistage, ainsi que l’ensemble des formes symptomatiques (incluant donc celles ne faisant pas l’objet d’un test diagnostic).
Surveillance de la couverture vaccinale
En parallèle du début de la campagne de vaccination contre la Covid-19, une surveillance de la couverture vaccinale dans la population française élaborée par Santé publique France a été mise en place en février 2021. La base de données VAC-SI, alimentée par les professionnels de santé pratiquant la vaccination et gérée par la Cnam, a été analysée quotidiennement pour estimer les couvertures vaccinales par classe d’âge, par lieu de vaccination, mais également par population spécifique, comme les professionnels de santé ou les résidents et les professionnels exerçant en Ehpad.
Des études de couvertures vaccinales plus ciblées ont également été mises en œuvre auprès de ces populations spécifiques et ont été reproduites à plusieurs reprises afin d’en suivre l’évolution et de guider les mesures de sensibilisation dans les territoires ou groupes de populations les moins bien vaccinés.
Enquêtes de suivi de l’évolution des comportements et de la santé mentale
Dès le 23 mars 2020, Santé publique France a mis en place une série d’enquêtes en population générale appelées « CoviPrev », par le moyen de questionnaires auto-administrés en ligne à un échantillon de 2 000 personnes, de manière répétée. Ces enquêtes visent à mesurer les comportements liés directement à la pandémie et leur degré d’adoption (gestes barrières, confinement, intention vaccinale) et ceux indirects (consommation d’alcool, de tabac, alimentation, activité physique). Un volet évalue également l’évolution au cours de la pandémie de l’état de santé mentale de la population.
Analyse intégrant l’ensemble des indicateurs et rétro information
Si chaque indicateur, de manière séparée, permet d’évaluer un aspect épidémiologique (tendance de la dynamique de circulation du virus, gravité, mortalité, etc.), leur analyse conjointe a permis d’évaluer les situations à des échelles géographiques très fines ou dans des sous-groupes de population et de contribuer à mettre en place d’éventuelles mesures de gestions ciblées (figure 3). Ainsi, l’apparition de cas groupés difficilement maîtrisables dans certaines zones géographiques ont permis de mettre en place des actions de santé publique pour en limiter la diffusion 18. L’analyse fine des indicateurs par classe d’âge parmi les enfants a permis de mettre en place des mesures ciblées en milieu scolaire, dans l’objectif de ralentir la propagation du virus, tout en maintenant au maximum les écoles ouvertes 19. Le suivi des indicateurs issus de Contact-Covid (Cnam), incluant les lieux d’exposition présumés des cas, ont permis d’appuyer certaines hypothèses sur l’interprétation des tendances évolutives (par exemple, l’augmentation du taux d’incidence chez les enfants et celle des contacts en milieu scolaire lors des rentrées des classes, ou encore l’augmentation du taux d’incidence chez les jeunes adultes avec l’augmentation de la fréquentation des bars et restaurants etc.). Ces dispositifs, ainsi que les enquêtes CoviPrev, ont permis d’apporter des éléments d’orientation pour des actions de prévention et des mesures de gestion adéquates, et d’évaluer certaines dynamiques épidémiques, ainsi que les mesures mises en place au cours de la crise.
 Agrandir l'image
Agrandir l'imageL’ensemble de ces indicateurs ont été partagés avec les autorités sanitaires sous différentes formes. Les indicateurs de circulation du SARS-CoV-2 et de couverture vaccinale étaient transmis quotidiennement dans un bilan à destination du Centre de crise sanitaire de la Direction générale de la santé et ont alimenté les décisions des Conseils de défense. Au niveau territorial, l’ensemble des indicateurs analysés par les équipes en région de Santé publique France étaient partagés en temps réel avec les ARS. Plus d’une centaine d’indicateurs produits par Santé publique France à partir des bases de données SI-DEP, SI-VIC, VAC-SI, Sursaud® (réseaux SOS Médecins et Oscour®, certification électronique des décès), étaient restitués sur l’observatoire cartographique Géodes, où les premières données de surveillance de la Covid-19 ont été partagées dès le 18 mars 2020 ainsi que sur la plateforme data.gouv.fr du gouvernement. Ces indicateurs ont également été mis en ligne sur le tableau de bord (InfoCovidFrance) (3) de l'agence à partir du 24 novembre 2022. La plupart de ces données étaient mises à jour quotidiennement, week-ends compris. Les indicateurs en open data servaient à alimenter différents outils – publics ou non – de restitution des données (tableaux de bord nationaux ou internationaux, application TousAntiCovid, etc.).
En parallèle de ces indicateurs, une analyse complète des situations nationale et régionales a été réalisée chaque semaine. Elle a été partagée publiquement dans les points épidémiologiques nationaux et régionaux disponibles sur le site internet de l’agence et accompagnée d’un temps d’échange avec les médias pour décrire la situation et rendre plus accessible la compréhension des indicateurs. Une analyse de risque territorialisée contextualisée était également menée par les cellules régionales de Santé publique France de manière quotidienne, puis hebdomadaire, pour alimenter les concertations avec les ARS et les acteurs locaux, mais également avec le ministère de la Santé (incluant le Centre de crise sanitaire, la Direction générale de l’offre de soins, la Direction générale de la cohésion sociale et la Cnam).
Par ailleurs, des bilans fréquents ont été réalisés sur différentes thématiques, comme l’évolution des contaminations chez les enfants en âge scolaire, les Pims ou l’évolution des contaminations des personnels soignants en établissement de santé. L’agence a aussi partagé l’ensemble des données épidémiologiques françaises avec l’ECDC, quotidiennement puis de manière hebdomadaire au travers du système Tessy (The European Surveillance System), par le projet EuroMomo (European mortality monitoring) pour les données d’excès de mortalité, et avec l’initiative internationale Gisaid (Global initiative on sharing avian influenza data). Elle a participé aux échanges internationaux par les différents canaux de réponse aux crises sanitaires (Early Warning and Response System, par exemple). En retour, elle a contribué par l’analyse des données internationales (ECDC et OMS) à l’évaluation de risque d’importation des virus depuis les pays étrangers et à la définition de la stratégie aux frontières.
Discussion
La mise en place de ce système de surveillance multi-sources, qui a évolué au fil du temps pour tenir compte de l’accumulation progressive des connaissances, mais aussi des mesures mises en places au fur et à mesure de l’évolution de la pandémie, a permis de produire les indicateurs nécessaires au suivi et à la compréhension de la dynamique épidémique en temps réel en France, au plus près des territoires. L’expertise de Santé publique France, ses multiples partenariats, les réseaux préexistants et un effort collectif sans précédent ont été un levier pour la mise en place de ce système complexe et pour son évolution et sa constante adaptation. Aucun indicateur seul n’étant suffisant pour interpréter les tendances observées, c’est la diversité et la complémentarité des sources qui a permis tout au long de l’épidémie, quel que soit le niveau de circulation du virus et les mesures mises en place, de pouvoir interpréter avec un niveau de confiance important les tendances épidémiologiques observées à tous les échelons géographiques. En effet, les modifications des tendances observées sur certains indicateurs ont pu être confirmées ou infirmées grâce à la concordance des données issues des autres sources. Et inversement, lorsqu’un événement pouvait être identifié comme perturbant un indicateur précis, la tendance pouvait être suivie grâce aux sources non impactées par cet événement. Par exemple, en mai 2020, alors que les systèmes spécifiques n’étaient pas encore déployés sur l’ensemble du territoire, les critères de déconfinement ont été définis sur la base des données issues du système syndromique Oscour®. Lors de la mise en place des différentes politiques de dépistages (mise à disposition des tests antigéniques, augmentation du dépistage en prévision des fêtes de fin d’année et des rassemblements, mise en place du Passe sanitaire, déremboursement des tests), qui impactaient fortement les indicateurs (taux de dépistage, d’incidence et de positivité), il était possible de focaliser l’analyse de la situation sur les surveillances syndromique et hospitalière, beaucoup moins touchées par ces événements. Ce système de surveillance mis en place en France correspond ainsi à la définition d’un système intégré en termes techniques et institutionnels, malgré quelques limites décrites ci-après. Il a aussi permis une intégration de l’évaluation de la réponse en termes de gestion et de lien avec les politiques publiques 20. Une surveillance plus large des effets de la Covid-19 sur la population générale moins développée dans ce manuscrit a également été intégrée, telle que recommandée par l’OMS 21. Parmi les limites identifiées de ce système de surveillance, certaines sont bien connues. Le temps nécessaire à la collecte et à la consolidation des données, la difficulté à intégrer les inégalités sociales et territoriales dans les indicateurs de suivi, ou les systèmes nécessitant une saisie supplémentaire d’informations par les professionnels de santé sur le terrain en sont quelques exemples. De même, l’exhaustivité était difficile à évaluer pour certaines sources, notamment dans les premières phases de l’épidémie, avant la mise en place de SI-DEP 22. L’exhaustivité globale de la surveillance dépendait aussi de la disponibilité des tests au cours du temps et de l’accès aux soins pour certaines populations, en particulier les plus précaires 23. Compte tenu des enjeux majeurs que cette crise a mis en lumière (enjeux sanitaires d’abord, mais aussi économiques, sociétaux, politiques et médiatiques), la gestion de l’épidémie a imposé à l’ensemble des acteurs un besoin de réactivité sans précédent, en s’affranchissant du mieux possible du temps réel, de la pression et des incertitudes qu’il engendre. C’est la raison pour laquelle un certain nombre d’indicateurs étaient basés sur des données à J-3 (par exemple, les indicateurs issus de SI-DEP), pour garantir la réactivité nécessaire à la prise de décision et le recul suffisant pour que les données soient consolidées. Cela a pu également amener à choisir des indicateurs plus réactifs, mais parfois moins robustes, comme, par exemple, les données par date de déclaration plutôt que par date d’événement (date de prélèvement d’un test ou date d’admission à l’hôpital). Ces choix ne permettaient pas nécessairement de toujours respecter le temps de consolidation des données avant leur partage, amenant parfois à créer des artefacts de surveillance nécessitant par la suite une correction. Par ailleurs, lors des premiers temps d’une émergence, les définitions de cas doivent respecter un difficile équilibre entre sensibilité, pour ne pas rater un cas, et spécificité, pour éviter de surcharger les laboratoires référents, les équipes spécialisées de soins et de santé publique en charge des investigations avec de « faux » cas. Ces définitions ont permis d’identifier rapidement les premiers cas symptomatiques rapportés après l’alerte lancée par la Chine. Il a cependant été montré dans les mois suivants que des patients présentant des anticorps spécifiques contre le SARS-CoV-2 dès le mois de novembre 2019 avaient été possiblement exposés dans les semaines, voire les mois précédents 24,25. Ces patients n’ont cependant pas semblé avoir contribué à une diffusion soutenue du SARS-CoV-2 dans la population avant le mois de février 2020. Ces différents éléments soulignent la difficulté de reconnaître un phénomène émergent dans les toutes premières phases de son introduction, comme cela a pu déjà être le cas 26. Cela pose également la question de la performance du dispositif d’identification des introductions durant la première phase en termes de capacité à identifier les importations. En effet, les cas importés identifiés dans les premières semaines n’ont pas été à l’origine de transmissions secondaires connues, et la plupart des « événements super propagateurs » ont été identifiés alors que les premières chaînes de transmission étaient déjà installées, indiquant qu’à l’époque, de nombreuses introductions n’avaient pas été détectées.
Enfin, l’une des limites majeures identifiées au cours de la crise Covid-19 a été la construction de systèmes de surveillance ayant peu d’interopérabilité entre eux, ou ne permettant pas l’interconnexion définissant en partie l’intégration d’un système de surveillance 27. Il est en effet important de pouvoir rapprocher les bases de données individuelles pour relier, par exemple, le statut vaccinal des cas ou le type de variant en cause avec les données d’hospitalisation et limiter au maximum les efforts de saisies multiples par les professionnels. Ces rapprochements, au sein de Santé publique France, n’ont été que ponctuels, dans des cas très précis, comme des études d’efficacité vaccinale ou sur la sévérité des cas 28. L’appariement des bases de données pour lesquelles l’identifiant était un pseudonyme créé à partir des traits d’identité (nom, prénom, date de naissance) a montré des limites importantes liées à la difficulté d’assurer le respect de la procédure de création du pseudonyme par l’ensemble des acteurs de la surveillance. Les barrières réglementaires qui n’ont pu être levées dans les temps très contraints de l’urgence liée à la diffusion rapide du SARS-CoV-2 n’ont pas permis à Santé publique France d’accéder à un identifiant unique robuste tel que l’INS (identifiant national de santé) ou un identifiant créé à partir de l’INS. Faire en sorte que cet accès soit possible pour la gestion de futures émergences, voire plus largement pour certaines surveillances de routine, apparaît comme une priorité à mettre en œuvre au décours de la crise, tout en veillant au respect strict des règles en termes de protection de l’anonymat des personnes.
Les données produites par Santé publique France ont été mises à disposition de nombreux partenaires pour l’aide à la décision ou à des fins de recherche. Les données ont été mises en open data dès le 29 février 2020, de manière quotidienne, afin d’améliorer leur transparence dans une période critique en termes de communication, et parfois de défiance envers la communauté scientifique et les autorités de santé 29. Au-delà de la rétro-information quotidienne et hebdomadaire de ces données aux autorités de santé nationales, elles ont alimenté de nombreux travaux des équipes de modélisation partenaires de l’agence et ont été partagées avec les différents comités d’experts (Haut Conseil de la santé publique, Haute Autorité de santé, Conseil scientifique de la Covid-19, etc.). Elles ont ainsi contribué à guider certaines décisions publiques (couvre-feux, confinements ou stratégies de vaccination) 30,31,32. Les données étaient également mises à disposition de l’ensemble des acteurs locaux dans les différents territoires et ont permis l’élaboration de mesures, telles que le renforcement des gestes barrières (port du masque dans différents lieux) ou les campagnes de vaccination ciblées dans le cas de situations critiques. Enfin, les données de surveillance ont pu être utilisées afin d’évaluer l’impact de ces différentes mesures de gestion tout au long de la crise 30,31,32,33.
Le système de surveillance multi-source mis en place en France a répondu aux principaux objectifs de la surveillance d’une infection respiratoire contagieuse, mais aussi aux principales attentes et standards internationaux en termes d’effets couverts (directs et indirects) et de qualité des données (4). Les choix dans les modes de surveillance dépendent de multiples facteurs, tels que l’organisation des soins, les ressources techniques et humaines disponibles, ou mêmes les pratiques diagnostiques de chaque pays. Des choix différents ont été proposés dans d’autres pays, et notamment au Royaume-Uni, où des enquêtes de prévalence répétées dans le temps ont permis une évaluation de la circulation virale populationnelle. À notre connaissance, un tel dispositif n’a pas fait l’objet d’une évaluation formelle en termes de contribution à la gestion et à la limitation du nombre de cas de Covid-19. Le suivi du taux de positivité des tests au cours du temps a permis, entre autres indicateurs moins impactés par les différentes politiques de dépistage en France, d’avoir une estimation correcte du poids et de la dynamique de l’infection dans la population.
Par ailleurs, la rétro-information du grand public et la mise à disposition très large des données de surveillance ont probablement été à l’origine d’effets directs sur la dynamique de circulation du virus. En effet, il a été observé lors des annonces d’aggravation de la situation épidémiologique que les comportements se modifiaient probablement en amont des prises de décisions telles que les couvre-feux ou confinements 33. Une étude dont l’objectif est de décrire les facteurs sociodémographiques, comportements et pratiques associés à l’infection par le SARS-CoV-2 (ComCor) a été menée par l’Institut Pasteur, en partenariat avec la Cnam, l’institut Ipsos et Santé publique France. Elle a ainsi permis d’identifier les lieux et les circonstances de contamination 34. Des études de surveillance des connaissances, attitudes et pratiques répétées dans le temps (enquête CoviPrev) ont également permis de mesurer l’impact des campagnes d’information et de la rétro-information sur la population et ses comportements (exemple : adhésion aux mesures barrière) 35. Enfin, nous récapitulons dans cet article les méthodes de surveillance de la maladie et ses impacts directs, mais de nombreuses études épidémiologiques et programmes de surveillance ont également été menés ou utilisés pour en évaluer les impacts indirects, comme ceux des mesures de contrôle sur la santé mentale 36, sur la sédentarité 37, ou sur les recours aux soins pour des pathologies cardiovasculaires 38. Une surveillance réactive des indicateurs de santé mentale a également été mise en place mi-2020 à partir des recours aux services d’urgences du réseau Oscour® et des consultations SOS Médecins. Une analyse complète de la situation est réalisée chaque semaine et partagée publiquement dans un point épidémiologique disponible sur le site Internet de l’agence.
La pandémie de Covid-19 et la situation de crise qui en a découlé ont permis d’apprécier notre capacité à penser et mettre en œuvre un système de surveillance pour produire de nombreux indicateurs, mais également de tirer des leçons quant à ses faiblesses. Certaines difficultés ont pu être surmontées, et des systèmes de grande envergures ont été élaborés en un temps très contraint, comme SI-DEP, qui a notamment permis de contourner le problème d’accès généralisé à des données structurées des laboratoires. La pérennisation et l’extension d’un tel outil devrait permettre d’améliorer la surveillance de nombreuses autres maladies infectieuses ou non transmissibles dans le futur. De la même manière, les activités de séquençage se sont développées en France depuis plusieurs années, notamment au sein des CNR (ex : salmonelles, méningocoques), mais l’absence de recensement de ces capacités sur le territoire et leur coordination insuffisante ne permettaient pas, dans un contexte de crise comme celle de la Covid-19, de les coordonner autour d’un même pathogène et objectif. La mise en place du consortium Emergen a permis de mettre en commun ces compétences, les développer et les coordonner pour produire de nouveaux indicateurs utiles à la surveillance de la Covid-19. Sa pérennisation devra ouvrir la voie à un élargissement de son utilisation pour la surveillance génomique d’autres agents pathogènes dans le futur.
L’un des points mis en exergue par la crise est également la nécessité d’intégrer la Covid-19 à celle des infections virales saisonnières (virus de la grippe, de la bronchiolite, de la gastro-entérite). Une telle surveillance est désormais en cours d’élaboration. Enfin, la pandémie de Covid-19 rappelle l’importance du partage des données et des méthodes de recueil de ces dernières afin de mieux comprendre les dynamiques épidémiologiques nationales, mais également internationales des infections émergentes et le besoin permanent d’adapter les outils. Il est notamment nécessaire de développer des systèmes d’information automatisés s’appuyant sur les logiciels métiers existants qui anticipent leur interopérabilité. Il paraissait également nécessaire de déployer plus largement la certification électronique des décès afin de permettre une surveillance de la mortalité réactive par causes en tout lieu de décès incluant l’hôpital, les Ehpad, le domicile et la voie publique. À ces fins, le décret n° 2022-284 en date du 28 février 2022 renforce l’obligation d’établir les certificats de décès par voie électronique, en précisant que l’élaboration ou la transmission du certificat de décès sur support papier sera possible à titre exceptionnel. Le système présenté ici a donc vocation à poursuivre son évolution dans les mois et années à venir afin d’être en capacité de répondre aux nouveaux enjeux qui se présenteront. L’expérience accumulée au cours des dernières décennies à la faveur de plusieurs crises majeures (canicule de 2003, pandémie grippale de 2009, Ebola en 2014, etc.) et l’existence d’un réseau national de santé publique solide ont permis de construire ce dispositif complexe impliquant de nombreux acteurs. Il est nécessaire d’anticiper la survenue d’autres maladies émergentes dans le futur, qui continueront à mobiliser l’ensemble de ces acteurs. Pour cela, il nous faudra maintenir, voire renforcer la robustesse de notre système de santé et de santé publique pour y répondre dans les meilleures conditions.
Remerciements
Les équipes de Santé publique France remercient l’ensemble de leurs partenaires impliqués dans la surveillance depuis le début
de la pandémie de Covid-19 :
Le Centre national de référence-virus des infections respiratoires (Institut Pasteur, Hospices civils de Lyon), le ministère
des Solidarités et de la Santé (Direction générale de la santé, Direction générale de l’organisation des soins, Direction
générale de la cohésion sociale, Direction de la recherche, des études, de l’évaluation et des statistiques), les agences
régionales de santé, la Caisse nationale d’assurance maladie, l’Institut national de la santé et de la recherche médicale
(Inserm, Centre d’épidémiologie sur les causes médicales de décès, CépiDc), l’Institut national de la statistique et des études
économiques (Insee), la Fédération des observatoires régionaux des urgences (Fedoru), le Groupe d’étude sur le risque d’exposition
des soignants aux agents infectieux (Geres), les établissements hospitaliers, la Coordination opérationnelle – Risque épidémique
et biologique (Coreb), les médecins hospitaliers, libéraux (SOS Médecins, Réseau Sentinelles), le Service d’aide médicale
urgente (Samu), le Centre 15, les laboratoires de biologie médicale hospitaliers et de ville, les sociétés savantes d’infectiologie
(Spilf), de réanimation, de médecine d’urgence (SFMU), de pédiatrie, le réseau de laboratoires de l’Agence nationale de recherches
sur le sida et les hépatites virales | Maladies infectieuses émergentes (ANRS|MIE), les partenaires du consortium pour la
surveillance et la recherche sur les infections à pathogènes émergents via la génomique microbienne (Emergen), et tous les professionnels de santé impliqués dans la surveillance et la prise en charge
de la Covid-19.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.





