Fréquence de la maladie de Parkinson en France en 2015 et évolution jusqu’en 2030
// Frequency of Parkinson’s disease in France in 2015 and trends to 2030
Résumé
Objectifs –
En France, les fréquences publiées de la maladie de Parkinson (MP) concernent le plus souvent une seule zone géographique ou des populations spécifiques. L’objectif de cet article est d’estimer la fréquence de la MP en France, au niveau national, régional et départemental, pour l’ensemble de la population.
Méthodes –
À partir des données de remboursement de médicaments antiparkinsoniens, une approche validée a été utilisée pour identifier les personnes traitées pour une MP entre 2010 et 2015. Le nombre de personnes nouvellement traitées durant une année a également été estimé. Les fréquences ont été décrites par âge, sexe et département. En utilisant un modèle multi-états, le nombre de personnes de plus 45 ans qui seront traitées en 2030 a été estimé.
Résultats –
Fin 2015, 166 712 personnes ont été traitées pour MP en France, soit une prévalence de 2,50 patients pour 1 000 personnes. Au cours de cette même année, 25 842 personnes étaient nouvellement traitées, soit une incidence de 0,39 patients pour 1 000 personnes-années. La prévalence et l’incidence augmentaient progressivement avec l’âge jusqu’à 80 ans ; plus de la moitié des patients avaient plus de 75 ans. Les hommes étaient atteints environ 1,5 fois plus souvent que les femmes. La distribution géographique de la maladie était caractérisée par une certaine hétérogénéité spatiale. En 2030, environ 260 000 personnes devraient être traitées pour une MP en France.
Conclusion –
Cette étude est la première sur la MP couvrant l’ensemble du territoire français et plusieurs régimes d’assurance maladie. Ces données contribuent à une meilleure connaissance du poids de la MP au niveau national et infranational. Les projections indiquent un fardeau de la MP en augmentation dans les décennies à venir, du fait notamment du vieillissement de la population.
Abstract
Objectives –
In France, the published frequencies of Parkinson’s disease (PD) are often limited to specific geographical areas or populations. The aim of this article was to estimate the frequency of PD for the entire population at the national regional and provincial levels.
Methods –
Based on antiparkinsonian drug reimbursement claims, we used a validated approach to identify persons treated for PD between 2010 and 2015. The number of persons newly treated over one year was also estimated. Frequencies were described by age, sex and district. Using a multi-state model, we estimated the number of people older than 45 years who will be treated in 2030.
Results –
At the end of 2015, 166,712 people were treated for PD in France, corresponding to a prevalence of 2.50 patients per 1,000 persons. In 2015, 25,842 people were newly treated, corresponding to an incidence of 0.39 patients per 1,000 person-years. Prevalence and incidence rates increased sharply with age up to 80 years; over half of the patients were older than 75 years. Men were affected about 1.5 times more often than women. The geographical distribution of the disease was characterized by spatial heterogeneity. By 2030, around 260,000 people should be treated for PD in France.
Conclusion –
This is the first study about PD to cover the entire French territory and several health insurance schemes. These data contribute to a better understanding of the burden of PD at the national and subnational levels. Projections indicate an increasing burden of PD in the coming decades mainly due to aging of the population.
Introduction
La maladie de Parkinson (MP) est une affection chronique lentement évolutive, principalement caractérisée par des troubles moteurs, comme le tremblement de repos, la rigidité ou la lenteur du mouvement. Des symptômes non-moteurs sont également fréquemment présents (constipation, dépression, etc.). En l’absence de traitement curatif, la MP est à l’origine d’une diminution de l’espérance et de la qualité de vie 1.
La MP est la seconde maladie neurodégénérative la plus fréquente après la maladie d’Alzheimer. En raison du vieillissement de la population mondiale, le nombre de personnes atteintes de la MP devrait doubler entre 2005 et 2030 2.
Depuis 2014, Santé publique France a mis en place un programme de surveillance des maladies neurodégénératives, dont la MP 3. Ce programme repose principalement sur l’exploitation des données médico-administratives de l’Assurance maladie. Pour la MP, les données de remboursements de médicaments représentent une solution intéressante pour identifier les patients. En effet, les différents traitements médicamenteux disponibles sont caractérisés par une bonne observance et la proportion de patients parkinsoniens non traités est, dans un pays comme la France, faible. Des travaux antérieurs ont montré que les personnes traitées pour une MP pouvaient être correctement identifiées à partir des données de remboursement de médicaments antiparkinsoniens, permettant ainsi une estimation correcte de la fréquence de la maladie 4,5.
En utilisant cette approche, cet article présente : (i) les estimations du nombre de patients traités pour MP en France au 31 décembre 2015 (cas prévalents) et le nombre de cas nouvellement traités en 2015 (cas incidents) ; (ii) la description de la fréquence de la maladie par âge et sexe, ainsi que sa distribution départementale ; (iii) l’évolution temporelle de la fréquence de la MP entre 2010 et 2015 ; (iv) des projections du nombre de personnes traitées pour MP en France en 2030.
Population et méthode
Identification des patients parkinsoniens
Les patients parkinsoniens ont été identifiés à partir des données du Datamart de consommation inter-régimes (DCIR) disponibles dans le Système national d’information inter-régimes de l’Assurance maladie (Sniiram) 6. Pour les médicaments remboursés par l’Assurance maladie – comme les médicaments antiparkinsoniens – le DCIR renseigne, de façon individuelle et anonyme, pour chaque remboursement, la nature du médicament (codée à l’aide de la classification anatomique, thérapeutique et chimique, ATC), la date de prescription et de délivrance du médicament, le nombre de boîtes remboursées, le nombre par boîte et dosage des comprimés ainsi que la spécialité du médecin prescripteur. De plus, des données démographiques comme l’âge, le sexe, la commune de domicile et le statut vital du bénéficiaire de la prestation sont disponibles.
À partir de ces informations, les cas parkinsoniens ont été identifiés en utilisant un modèle prédictif qui estime la probabilité qu’une personne a d’être traitée pour une MP à partir de son profil de remboursements de médicaments antiparkinsoniens 4,5.
Le modèle a été appliqué aux personnes ayant au moins un remboursement de médicaments antiparkinsoniens en 2015 après exclusion :
–des personnes âgées de moins de 20 ans, car la MP est exceptionnelle avant cet âge ;
–des femmes âgées de moins de 50 ans ayant uniquement un remboursement de bromocriptine à la dose de 2,5 mg, car il s’agit vraisemblablement d’un traitement inhibiteur de la lactation ;
–des personnes ayant uniquement des remboursements d’anticholinergiques (code ATC N04A) en association avec des neuroleptiques, car il s’agit vraisemblablement d’un traitement correcteur d’un syndrome extrapyramidal induit par les neuroleptiques.
Ont été considérées comme étant traitées pour une MP, les personnes dont la probabilité calculée par le modèle était supérieure ou égale à 0,255. Ce seuil a été déterminé dans une étude de validation réalisée auprès des affiliés de la Mutualité sociale agricole (MSA), âgés de 18 à 80 ans, de cinq départements (Charente-Maritime, Côte-d’Or, Gironde, Haute-Vienne, Mayenne) et ayant eu au moins un remboursement de médicament antiparkinsonien en 2007. Après exclusion des personnes bénéficiant d’une affection longue durée (ALD) pour démence ou pour maladie psychiatrique, et de celles en ALD pour MP depuis 15 ans ou plus, les personnes ayant eu un médicament habituellement utilisé dans le traitement de la MP ont été contactées et invitées par téléphone à être examinées par un neurologue afin de confirmer la MP, à l’exception des situations suivantes : (i) prise de petits doses d’agonistes dopaminergiques pour un syndrome de jambes sans repos ; (ii) traitement interrompu au cours du premier mois de traitement ; (iii) histoire documentée de syndromes parkinsoniens iatrogènes. Pour les personnes ayant eu un médicament rarement utilisé dans le traitement de la MP, un courrier a été envoyé afin de connaître le motif de la prescription ; seules les personnes ayant déclaré être traitées pour une MP ou un syndrome parkinsonien ou ne connaissant pas le motif de leur prescription ont été invitées à être examinées par un neurologue. À partir de ces données, il avait été estimé dans cette étude que le seuil permettait de classer les personnes comme atteintes ou pas avec une sensibilité de 92,5% et une spécificité de 86,4% par rapport au diagnostic établi par un neurologue après examen clinique et considéré comme la référence 4,5.
Définition des cas prévalents et incidents
Les cas prévalents de MP au 31 décembre 2015 ont été définis comme toutes les personnes considérées traitées pour MP d’après le modèle et vivantes à cette date.
Les cas incidents ont été définis comme toutes les personnes considérées traitées pour MP d’après le modèle en 2015 et sans aucun remboursement de médicament antiparkinsonien en 2014.
Les effectifs de patients parkinsoniens prévalents et incidents ont été corrigés par la sensibilité et la spécificité du modèle d’identification des cas, afin de tenir compte de ses performances imparfaites. Le nombre corrigé de cas prévalents a été calculé en faisant l’hypothèse que le rapport du nombre non corrigé sur le nombre corrigé était similaire à celui de 2009 (rapport=0,837 4). Le nombre corrigé de cas incidents a été calculé en faisant l’hypothèse que la proportion de cas incidents parmi l’ensemble des cas identifiés était la même pour les données corrigées et non corrigées.
Taux de prévalence et d’incidence
Le taux de prévalence au 31 décembre 2015 a été calculé en divisant le nombre de cas prévalents par l’effectif de la population française au 1er janvier 2016. Pour les effectifs de population, les données du recensement de population de l’Institut national de la statistique et des études économiques (Insee) ont été utilisées.
Le taux d’incidence a été calculé en divisant le nombre de cas incidents par le nombre de personnes-années obtenu à partir des estimations de population, en considérant que le nombre de personnes-années pour l’âge a était la moyenne entre l’effectif de la population d’âge a-1 au 1er janvier de l’année n et l’effectif de la population d’âge a au 1er janvier de l’année n+1.
Les taux ont été calculés dans l’ensemble, par sexe et classe d’âge de 5 ans. La comparaison des taux entre les hommes et les femmes a été faite après standardisation directe sur l’âge en utilisant la distribution d’âge de la population française. Les rapports homme-femme de prévalence et d’incidence, ainsi que leurs intervalles de confiance à 95% (IC95%), ont été estimés à l’aide d’un modèle de Poisson ajusté sur l’âge et incluant un paramètre de dispersion.
Distribution géographique
Des taux départementaux de prévalence et d’incidence standardisés et leur IC95% ont été calculés par la méthode directe (référence : distribution d’âge et de sexe de la population française). La localisation des patients parkinsoniens a reposé sur la commune de résidence renseignée au moment de la dernière délivrance de médicament antiparkinsonien. Pour 312 patients parkinsoniens (0,19%) dont le département de résidence était inconnu, le département de la caisse d’affiliation a été utilisé.
Tendances temporelles entre 2010 et 2015
Les taux de prévalence et d’incidence de la MP ont été calculés pour les années 2010 à 2014 en suivant la même méthodologie que pour l’année 2015. En raison de l’inclusion, à partir de 2013, des données de remboursements de nouveaux régimes dans le DCIR, les estimations de 2013 à 2015 ont été recalculées en considérant le même périmètre que pour les données antérieures à 2013. Les données détaillées pour les années 2010 à 2014 sont disponibles dans un rapport 7 et via une application interactive (https://dataviz.santepubliquefrance.fr/parkinson/).
Les évolutions temporelles entre 2010 et 2015 ont été décrites suivant deux modalités :
–à partir des taux non standardisés et en calculant des taux de variation entre les années ;
–en calculant des taux standardisés sur l’âge et le sexe (méthode directe ; référence : population française de 2010). Les taux standardisés permettent de comparer les taux annuels après prise en compte de l’évolution au cours du temps de la structure d’âge et sexe de la population française.
Les taux sont exprimés en base de 100 avec l’année 2010 utilisée comme année de référence.
Comparaison aux données de la littérature
Afin de comparer les taux estimés dans la présente étude à ceux disponibles dans la littérature, une approche différente a été suivie pour la prévalence et pour l’incidence en raison des données disponibles.
Pour la prévalence, les taux en 2015 ont été comparés aux résultats d’une méta-analyse de 47 études 8.
Pour l’incidence, une méta-analyse de 11 études a été publiée récemment 9. Cependant, elle retrouve une très grande hétérogénéité des incidences, liée à la fois à des différences méthodologiques et à des estimations peu précises. En outre, plusieurs études n’ont pas été incluses par les auteurs. Pour ces raisons, il a été retenu de comparer les taux d’incidence en 2015 de la présente étude aux estimations par âge et sexe des études d’incidence publiées jusqu’en 2016 (n=25) 10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34, plutôt qu’aux taux présentés par la méta-analyse.
Projection des taux de prévalence jusqu’en 2030
Les projections ont été réalisées à l’aide d’un modèle multi-état (modèle « sain-malade-décédé ») permettant de prendre en compte les risques concurrents entre la survenue de la MP et le décès, ainsi que l’évolution des taux de mortalité en fonction du temps et de l’âge (modèle Markovien non-homogène). Une description détaillée de la méthodologie a été publiée 35,36. Une approche similaire a été utilisée antérieurement pour projeter le nombre de cas de démence 37.
Les données nécessaires pour estimer ce modèle sont :
–les effectifs de population, recensés ou projeté par l’Insee pour les années 1950 à 2060 par âge, sexe et année de naissance ;
–les taux d’incidence de la MP, calculés en utilisant la méthodologie présentée ci-dessus. Entre 2010 et 2012 (seules années disponibles au moment du début du travail sur les projections), les taux d’incidence par âge et sexe ont été moyennés afin d’obtenir des données plus stables. Pour les projections, il a été considéré qu’il n’y avait aucun cas parkinsonien avant 45 ans car la MP est très rare avant cet âge et le faible nombre de cas était à l’origine d’une difficulté du modèle multi-état pour estimer le risque relatif de décès des patients parkinsoniens avant cet âge. Les taux d’incidence ont été corrigés pour la sous-identification après 80 ans et lissés à l’aide de fonctions splines pour obtenir des fonctions continues sur l’âge ;
–les taux de mortalité de l’Insee pour les années 1950 à 2060. La MP étant rare, la mortalité toutes causes des personnes non parkinsoniennes a été supposée similaire à celle de la population française. Les taux par âge et sexe ont été lissés à l’aide d’un modèle de Gompertz-Makeham pour obtenir des fonctions continues sur l’âge ;
–les taux de mortalité des patients parkinsoniens par âge et sexe. Ils ont été appréciés à partir des données de prévalence et d’incidence. Le risque relatif de décès par âge et sexe des sujets présentant une MP par rapport à ceux n’en ayant pas a été estimé, puis les taux de mortalité des patients parkinsoniens ont été calculés comme le produit des taux de mortalité des personnes non parkinsoniennes et du risque relatif de décès.
Le nombre de cas parkinsoniens de plus 45 ans en 2030 a ensuite été estimé en faisant l’hypothèse d’une incidence constante de la maladie dans le temps et en utilisant les projections de mortalité et de population de l’Insee. Ce calcul a été réalisé séparément pour les hommes et les femmes.
Résultats
Prévalence de la maladie de Parkinson en France en 2015
Au 31 décembre 2015, 166 712 personnes ont été identifiées comme étant traitées pour la MP en France. Cela correspond à une prévalence de 2,50 patients pour 1 000 personnes.
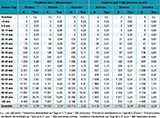
Le tableau 1 et la figure 1a présentent la prévalence par âge et sexe. La prévalence de la maladie augmente avec l’âge de manière continue entre 45 et 80 ans avant d’atteindre un pic entre 85 et 89 ans et diminuer ensuite. Parmi l’ensemble des patients, 23 402 (14%) étaient âgés de moins de 65 ans : 13 560 hommes (16% des hommes) et 9 842 femmes (12% des femmes).
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageLa prévalence était supérieure chez les hommes par rapport aux femmes. Après standardisation directe sur l’âge, elle était 1,56 (IC95%: [1,52-1,59]) fois plus élevée chez les hommes (3,17 pour 1 000 personnes) que chez les femmes (2,03 pour 1 000 personnes).
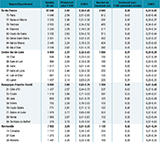
Les taux de prévalence départementaux standardisés sur l’âge et le sexe variaient entre 1,52 et 3,30 pour 1 000 personnes (tableau 2). La distribution géographique de la prévalence de la MP par département était hétérogène (figure 2a) avec des prévalences élevées dans certains départements (Somme, Bouches-du-Rhône, Indre, Corrèze et Oise).
 Agrandir l'image
Agrandir l'image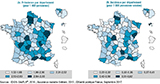 Agrandir l'image
Agrandir l'imageIncidence de la maladie de Parkinson en France en 2015
En 2015, 25 842 personnes ont été identifiées comme étant nouvellement traitées pour MP en France. Cela correspond à une incidence de 0,39 pour 1 000 personnes-années (ou 39 nouveaux cas pour 100 000 personnes par an).
Le tableau 1 et la figure 1b présentent l’incidence par âge et sexe. Comme pour la prévalence, l’incidence de la maladie augmente de manière continue entre 45 et 80 ans avant d’atteindre un pic entre 85 et 89 ans et diminuer ensuite. Parmi les nouveaux patients, 4 319 (17%) étaient âgés de moins de 65 ans : 2 400 hommes (17% des hommes) et 1 919 femmes (16% des femmes).
L’incidence était supérieure chez les hommes par rapport aux femmes. Après standardisation directe sur l’âge, l’incidence était 1,67 [1,56-1,80] fois plus élevée chez les hommes (0,51 pour 1 000 personnes-années) que chez les femmes (0,31 pour 1 000 personnes-années).
Les taux d’incidence départementaux standardisés sur l’âge et le sexe variaient entre 0,22 et 0,62 pour 1 000 personnes-années (tableau 2). La distribution géographique de l’incidence de la MP par département était hétérogène (figure 2b), avec des incidences élevées dans certains départements (Somme, Bouches-du-Rhône, Indre, Doubs, Lozère, Oise).
Comparaison aux données existantes
Les taux de prévalence observés dans la présente étude sont similaires à ceux de la méta-analyse avant 70 ans (figure 3). Après cet âge, les taux de prévalence observés en France sont légèrement plus élevés que les taux moyens calculés dans la méta-analyse, de manière plus nette chez les hommes que chez les femmes, mais restent compris entre les bornes des intervalles de confiance des estimations de la méta-analyse et du même ordre de grandeur.
 Agrandir l'image
Agrandir l'imagePour les taux d’incidence, il existe une grande hétérogénéité entre les études, notamment après 80 ans. Les taux d’incidence observés en France sont comparables à ceux de plusieurs études françaises ou étrangères et se situent dans les estimations moyennes.
Évolution temporelle de la fréquence de la maladie de Parkinson entre 2010 et 2015
La figure 4 présente l’évolution de la prévalence et de l’incidence de la MP entre 2010 et 2015. La prévalence brute a augmenté entre 2010 et 2015, passant de 2,30 à 2,43 pour 1 000, avec un taux de variation annuelle moyen de 1,08%. À périmètre constant, on dénombrait 149 668 cas en 2010 et 162 242 en 2015, soit environ 2 100 cas prévalents supplémentaires par an. L’évolution de l’incidence brute n’est pas monotone, avec des taux compris entre 0,36 et 0,39 pour 1 000 personnes-années suivant les années (soit entre 23 650 et 25 704 nouveaux cas selon les années).
 Agrandir l'image
Agrandir l'imageLe taux de prévalence standardisé (permettant de prendre en compte l’évolution de la structure d’âge et de sexe de la population française) est resté stable sur la période 2010-2015, tandis que l’évolution temporelle des taux d’incidence standardisée ne présente pas une tendance linéaire sur cette période.
Projection du nombre de cas parkinsoniens en 2030
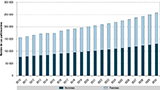
L’évolution du nombre de cas parkinsoniens de plus 45 ans en France entre 2010 et 2030 est présentée en figure 5. Le nombre total de cas parkinsoniens en 2030 est estimé à 256 800 personnes (130 000 hommes et 126 800 femmes). Cela correspond à une augmentation de 56% par rapport au nombre de cas prévalents en 2015 (51% chez les hommes et 61% chez les femmes).
 Agrandir l'image
Agrandir l'imageDiscussion – conclusion
Dans cette étude, le nombre de personnes touchées par la maladie de Parkinson en France en 2015 est estimé à environ 170 000. Chaque année, un peu plus de 25 000 personnes sont nouvellement traitées pour cette maladie. Compte tenu de la taille de la population française, cela représente une prévalence d’environ 2,50 pour 1 000 personnes et une incidence de 0,39 pour 1 000 personnes-années.
Les hommes sont atteints environ 1,5 fois plus souvent que les femmes. La fréquence de la maladie augmente progresivement avec l’âge jusqu’à 80 ans ; plus de la moitié des patients ont plus de 75 ans. Bien qu’elle survienne rarement avant 65 ans, la maladie touche près d’un patient sur 7 avant cet âge.
En 2030, on estime qu’environ 260 000 personnes seront traitées pour une maladie de Parkinson en France, soit environ 1 personne sur 120 parmi les plus de 45 ans. Cela représente une augmentation de 56% par rapport à 2015.
Les taux de prévalence et d’incidence estimés dans la présente étude sont en accord avec les données de la littérature 7,11. Il existe peu de données récentes sur la fréquence de la maladie de Parkinson en France. Deux autres études à partir des données médico-administratives sont disponibles 38,39. Leurs résultats sont légèrement différents, avec des taux de prévalence plus élevés par rapport à ceux présentés dans cet article.
Ces différences s’expliquent, d’une part, par la correction des effectifs permettant de prendre en compte la sensibilité et la spécificité imparfaites de la méthode d’identification qui ont pu être estimées lors d’une étude de validation 4,5. Dans cette étude, il avait été observé que, parmi les personnes incorrectement classées comme atteintes de la MP (faux positifs), plus de la moitié (53%) étaient atteintes de syndromes parkinsoniens neurodégénératifs autres que la MP (paralysie supranucléaire progressive, atrophie multisystématique, dégénérescence cortico-basale, syndrome parkinsonien secondaire à un syndrome démentiel, démence à corps de Lewy). En l’absence d’autres traitements efficaces, ces patients reçoivent de la lévodopa aux mêmes doses que les patients parkinsoniens. Ainsi, lorsqu’on identifie des personnes avec des remboursements de médicaments antiparkinsoniens, certaines d’entre elles sont traitées pour une autre raison ou à tort (erreurs diagnostiques non exceptionnelles). Le défaut de sensibilité ayant moins d’impact quantitativement que le défaut de spécificité, le nombre de cas corrigé est inférieur de 16% par rapport au nombre non corrigé.
D’autre part, les différences peuvent s’expliquer par la méthodologie utilisée pour identifier les cas (par exemple, inclusion ou non des données d’hospitalisation, médicaments antiparkinsoniens considérés) 40. Notamment, les études antérieures utilisaient le critère de trois délivrances de médicaments dans l’année pour identifier les cas parkinsoniens, ce qui peut entraîner des faux positifs puisque certaines personnes peuvent avoir quelques remboursements de faibles doses de médicaments antiparkinsoniens pour d’autres pathologies que la MP, notamment le syndrome des jambes sans repos. Enfin, les personnes décédées dans l’année ne sont pas incluses dans nos estimations de fréquence alors qu’elles le sont dans d’autres estimations, ce qui induit une augmentation de ces estimations de 7%.
Les analyses géographiques permettent de mieux connaître le poids de la MP dans chaque département et région. L’analyse de la distribution géographique met en évidence une certaine hétérogénéité spatiale, avec des territoires présentant des fréquences un peu plus élevées que le reste du territoire. Compte tenu du caractère multifactoriel de la MP, ces disparités géographiques sont difficiles à interpréter sur le plan étiologique. En effet, les départements diffèrent entre eux par de nombreuses caractéristiques : environnement, organisation, populations les composant. De plus, l’identification des cas reposant sur les données de remboursements, les disparités géographiques peuvent en partie refléter des différences géographiques de prise en charge ou d’accès aux soins. Cependant, la prise en compte de la densité de neurologues conduit à des conclusions similaires 7. Enfin, la MP se développe probablement sur plusieurs années avant que les symptômes moteurs apparaissent et que le diagnostic soit posé. Le délai de plusieurs années entre l’exposition à une nuisance et la survenue de la MP complique donc l’interprétation de ces résultats. Pour cette raison, il serait utile de connaître la commune de résidence des patients parkinsoniens dans les années ayant précédé le diagnostic. L’archivage des données du DCIR pour une durée de 20 ans permettra à l’avenir de connaître l’historique résidentiel plusieurs années avant le début de la maladie, mais cela n’est actuellement pas possible.
Entre 2010 et 2015, l’évolution temporelle des taux d’incidence n’est pas monotone, avec des valeurs oscillant autour 25 000 nouveaux cas par an, sans montrer une tendance nette. L’interprétation de cette évolution est délicate dans la mesure où les variations sont d’amplitude faible.
D’après nos estimations, le fardeau lié à la MP va fortement augmenter dans les décennies à venir, notamment en raison du vieillissement de la population. Le nombre de 260 000 patients parkinsoniens en 2030 est plus élevé que celui de 190 000 personnes, estimé dans une étude antérieure 2. Dans cette étude, les projections françaises reposaient sur des taux de prévalence estimés en Gironde à la fin des années 1980 ; une étude comparative avait noté que ces fréquences étaient plus faibles que celles de cinq autres pays européens, probablement en raison de la méthodologie et des critères diagnostiques utilisés 41. De plus, l’étude étant ancienne, les taux de prévalence représentent probablement une sousestimation des taux de prévalence actuels et futurs en raison de l’augmentation de la durée de la maladie chez les cas parkinsoniens. En effet, une méta-analyse de dix études a montré que les patients inclus dans les études les plus récentes avaient en moyenne des durées de maladie plus longues 1.
Ces résultats doivent être interprétés à la lumière de certaines limites.
Premièrement, il n’a pas été possible de tenir compte des patients non diagnostiqués ou non traités. D’après l’étude Paquid, menée dans le département de la Gironde à la fin des années 1980, 11% des patients atteints de la MP n’étaient pas diagnostiqués et cette proportion augmentait considérablement avec l’âge 41. Il est toutefois probable que ce pourcentage ait diminué depuis, du fait d’une meilleure reconnaissance de la maladie et de l’amélioration de sa prise en charge. De plus, les personnes institutionnalisées dans des maisons de retraite avec des pharmacies à usage interne (environ 30% des maisons de retraite) ne peuvent être identifiées dans les bases de remboursement de médicaments. Ces deux limites conduisent vraisemblablement à une sous-estimation de la prévalence et de l’incidence aux âges les plus avancés et contribuent à l’infléchissement des courbes de fréquence après 80 ans. Cette sous-estimation a été corrigée pour le calcul des projections en 2030 avec une différence relative de moins de 10% (9,6% pour l’année 2010) sur le nombre de patients de 45 ans et plus.
Deuxièmement, les personnes traitées pour une MP ont été identifiées à l’aide d’un modèle développé parmi des affiliés à la MSA 4,5. Nous avions vérifié antérieurement que le suivi neurologique des patients parkinsoniens affiliés à la MSA était similaire à celui des patients affiliés aux autres régimes et en cohérence avec les recommandations de la Haute Autorité de santé. De plus, comme ce sont les mêmes neurologues qui traitent les patients affiliés à la MSA et ceux affiliés aux autres régimes, il est peu probable que la manière de traiter les patients parkinsoniens affiliés à la MSA soit différente de celle des patients d’autres régimes d’assurance maladie.
Troisièmement, les données de remboursement disponibles dans le DCIR correspondent à environ 97% de la population française. Ceci conduit à une sous-estimation négligeable des indicateurs présentés dans cet article.
Concernant les projections, l’hypothèse d’un modèle markovien non homogène ne tient pas compte de l’impact de la durée de la maladie sur la mortalité. Un modèle semi-markovien permettant de considérer la durée de la maladie a été envisagé mais il s’ajustait mal aux prévalences observées en 2010 au-delà de 75 ans. L’utilisation de modèles différents suivant l’âge compliquerait la procédure d’estimation et nécessiterait des données complémentaires non disponibles pour le moment.
Cette étude comprend plusieurs points forts. C’est la première étude sur la maladie de Parkinson couvrant l’ensemble du territoire français et réalisée à partir de données individuelles et exhaustives de l’Assurance maladie. Elle a permis d’estimer – sans restriction à un régime spécifique d’assurance maladie – le nombre de personnes traitées pour une MP en France à partir de données réelles de soin. Des analyses territorialisées de la fréquence de la MP – notamment dans les départements d’outre-mer – ont été réalisées, et des sous-groupes spécifiques ont été étudiés, comme les patients âgés de moins de 65 ans. Une des forces de l’étude est la méthode d’identification des cas parkinsoniens. Même si le diagnostic de ces cas n’a pas été confirmé par un neurologue, une étude a montré la validité de cette approche et il est tenu compte des performances du modèle statistique pour corriger les estimations 4,5. C’est la seule méthode ayant fait l’objet d’une comparaison par rapport à un examen clinique réalisé par un neurologue en France 40. Pour les projections, l’intérêt de cette approche est de tenir compte de l’impact de l’âge et du temps sur la mortalité des personnes malades.
En conclusion, les données présentées dans cet article contribuent à une meilleure connaissance du poids de la maladie de Parkinson en France et au sein du territoire national. Le nombre de cas parkinsoniens augmentera de façon importante en raison du vieillissement de la population et de l’amélioration de l’espérance de vie. L’utilisation d’une méthodologie constante dans le temps et identique pour l’ensemble du territoire permet de produire des données infranationales utiles pour orienter l’offre de soins ou suivre des actions comme celles mises en œuvre dans la cadre du plan maladies neurodégénératives 2014-2019. Enfin, comme cela a été montré récemment pour certaines activités agricoles 42, ces données permettent à la communauté scientifique de mieux caractériser les facteurs de risque ou protecteurs de la maladie de Parkinson.




