Incidence du diabète de type 1 chez l’enfant en France en 2013-2015, à partir du système national des données de santé (SNDS). Variations régionales
// Incidence of type 1 diabetes in children in 2013-2015 in France based on the national health insurance database. Regional variations
Résumé
Objectif –
En l’absence de registre national du diabète de type 1 (DT1), l’objectif de cette étude était d’estimer l’incidence de ce type de diabète chez les enfants en France et ses variations régionales, à partir des bases de données médico-administratives.
Méthodes –
L’algorithme, construit pour identifier les enfants nouvellement diagnostiqués diabétiques de type 1, sélectionnait les enfants âgés de 6 mois à 14 ans qui avaient eu au moins un séjour hospitalier de deux jours ou plus avec un diagnostic de diabète et au moins un remboursement d’insuline dans l’année suivante. Les enfants étaient exclus de l’étude s’ils avaient été remboursés au moins une fois pour de l’insuline ou un antidiabétique oral avant le début de l’hospitalisation, ou s’ils étaient atteints d’un autre type de diabète.
Sur la période 2013-2015, des taux spécifiques d’incidence ont été calculés, par sexe, classe d’âge et régions.
Résultats –
Entre 2013 et 2015, 6 424 enfants ont été identifiés comme nouvellement atteints de DT1. Le taux d’incidence en France sur cette période était de 18,0 pour 100 000 personnes-années. Les taux d’incidence régionaux les plus élevés étaient observés dans les régions Corse (21,7 pour 100 000 personnes-années), Provence-Alpes-Côte d’Azur (21,1) et Hauts-de-France (19,7). Les taux d’incidence régionaux les plus bas étaient relevés en Guyane (3,6 pour 100 000 personnes-années), en Guadeloupe (12,2), à La Réunion (14,2) et, en France métropolitaine, dans les régions Pays de la Loire (15,8), Nouvelle-Aquitaine (16,8) et Normandie (16,9).
Conclusion –
Les bases de données médico-administratives permettent un accès pérenne à des informations sur l’incidence de certaines pathologies. Ces informations sont essentielles pour la planification de soins de santé et pour la recherche en santé. Les bases de données médico-administratives ont permis l’estimation de l’incidence du DT1 chez tous les enfants de la population française, ainsi que ses variations régionales.
Abstract
Introduction –
In the absence of a national type 1 diabetes registry, the purpose of this study was to estimate the incidence of this type of diabetes in children in France and its regional variations, based on medico-administrative databases.
Methods –
The algorithm built to identify new cases of type 1 diabetes selected children aged between 6 months and 14 years who had been hospitalized for diabetes at least once for 2 days or more, and had received their first reimbursement for insulin treatment during the following year. Children were excluded from the study if they had been reimbursed at least once for insulin or an oral anti-diabetic before hospitalization, or if they had a different form of diabetes.
Between 2013 and 2015, specific incidence rates were computed by sex, age group and regions.
Results –
Between 2013 and 2015, 6,424 children were identified as newly diagnosed with type 1 diabetes. The incidence rate of type 1 diabetes was 18.0 per 100,000 person-years. In the French regions, higher incidence rate were observed in Corsica (21.1 pour 100,000 person-years), Provence-Alpes-Côte d’Azur (21.1) and Hauts-de-France (19.7). Lower incidence rate were observed in the Guyana (3.6 per 100,000 person-years), Guadeloupe (12.2) and La Réunion (14.2), and in metropolitan France in Pays de la Loire (15.8), Nouvelle-Aquitaine (16.8) and Normandie (16.9).
Conclusion –
Medico-administrative databases provide long-term access to information on the incidence of certain diseases and provide a valuable resource for health research. Medico-administrative data allowed the incidence of type 1 diabetes in children to be estimated in the whole French population, along with its regional variations.
Introduction
Le diabète de type 1 (DT1) est une maladie métabolique complexe, qui se déclare en général dès l’enfance 1. Elle nécessite un traitement à vie et peut présenter de graves complications au moment de sa découverte puis lors de son évolution 2. Un diagnostic tardif peut entraîner une acidocétose pouvant conduire à un coma, voire à un décès 1. De plus, il existe une surmortalité significative des enfants et jeunes adultes diagnostiqués diabétiques de type 1 dans les premières années après le diagnostic 3,4, en grande partie attribuée à des complications métaboliques aiguës du diabète 3,5 : acidocétose et hypoglycémie.
Un traitement par insuline est nécessaire dès le diagnostic et, en France, l’initiation de ce traitement est systématiquement réalisée au cours d’une hospitalisation, en y associant l’éducation thérapeutique de l’enfant et de sa famille 6,7. Dans les guides « médecin » et « patient » du DT1 de l’enfant et de l’adolescent, la Haute Autorité de santé (HAS) recommande une prise en charge systématique par une équipe de spécialistes et un bilan initial réalisé à l’hôpital dans un service de pédiatrie 6,7.
Dans le monde, le nombre d’enfants de moins de 15 ans atteints de DT1 était estimé à presque 500 000 en 2013, avec 80 000 enfants développant la maladie chaque année 8. Il existe d’importantes variations géographiques concernant les taux d’incidence du DT1 chez l’enfant 8,9,10. Les pays européens obéissent à un gradient « Nord-Sud » et « Ouest-Est » : les taux d’incidence du DT1 sont élevés dans le Nord et le Nord-Ouest de l’Europe et bas en Europe centrale, de l’Est et du Sud 11. Selon les résultats de l’étude Eurodiab, l’incidence annuelle du DT1 a varié, entre 1989 et 1998, de 3,6 pour 100 000 en Macédoine à 43,9 en Finlande 12. Cependant, certains pays ne s’inscrivaient pas dans ce gradient : le taux d’incidence de la Sardaigne (37,8 pour 100 000) était bien plus élevé que celui de ses voisins 12.
En France, un registre basé sur quatre régions reflétant la diversité de la population française (Aquitaine, Lorraine, Haute et Basse-Normandie) a permis l’estimation du taux d’incidence national du DT1 6,11,13 jusqu’en 1997. Une augmentation de l’incidence a été observée entre 1988 et 1997. Elle a également été mise en évidence entre 2010 et 2014 dans une étude réalisée à partir des bases de données médico-administratives 14.
Dans ce contexte, l’objectif de notre étude était d’estimer l’incidence du DT1 chez les enfants en France sur la période 2013-2015 et ses variations régionales, à partir de bases de données médico-administratives.
Méthodes
Sources de données
Dans le Système national des données de santé (SNDS), le Système national d’information inter-régimes de l’assurance maladie (Sniiram) et le Programme de médicalisation des systèmes d’information (PMSI) sont chaînés et contiennent des informations détaillées sur les consommations de soins médicaux pour la quasi-totalité de la population de la France (plus de 98% sur la période 2013-2015), soit plus de 66 millions de personnes.
Le Sniiram contient des informations individualisées et exhaustives sur les remboursements des bénéficiaires de l’Assurance maladie 15 liés à la consommation de soins en ville, notamment les traitements identifiés par des codes de la classification ATC (Anatomique, thérapeutique et chimique) et la date de délivrance de ces traitements. Le Sniiram ne contient pas d’informations concernant les résultats cliniques liés aux prescriptions ou examens. Cependant, cette base de données contient des informations sur la présence d’affections de longue durée (ALD).
Le PMSI contient des informations exhaustives sur les séjours hospitaliers, notamment des caractéristiques du patient, comme son âge au début du séjour hospitalier et son sexe, la durée de l’hospitalisation, la commune de résidence et les diagnostics codés selon la 10e révision de la Classification internationale des maladies (CIM-10) : diagnostic principal, diagnostic relié et diagnostics associés.
Population d’étude
La population d’étude était âgée de plus de 6 mois, afin de ne pas prendre en compte les enfants atteints de diabète néonatal, et de moins de 14 ans, pour permettre la comparaison avec les études internationales.
Les jumeaux de même sexe ont été exclus de la population d’étude pour des raisons techniques inhérentes à l’utilisation des bases de données médico-administratives (Sniiram et PMSI). Leur proportion était estimée à environ 2% entre 2013 et 2015.
La population d’étude incluait les habitants de la France métropolitaine et des départements d’outre-mer (DOM), sauf Mayotte.
Algorithme d’identification des cas
Pour une année donnée n, un algorithme spécifique (figure 1) permettait de sélectionner les enfants âgés de 6 mois à 14 ans qui avaient les caractéristiques suivantes : a) au moins un séjour hospitalier de deux jours ou plus dans l’année n, avec un diagnostic principal, relié ou associé de diabète (codes CIM-10 E10 à E14) ; b) au moins un remboursement d’insuline dans les 12 mois suivant le début du séjour hospitalier incident.
 Agrandir l'image
Agrandir l'imageLes enfants étaient exclus de l’étude s’ils étaient atteints d’une autre forme de diabète : un diabète iatrogène ou un diabète insulino-dépendant non auto-immun associé à une maladie chronique.
Un diabète iatrogène était défini par : a) plus de trois remboursements d’immunosuppresseurs ou plus de six remboursements de corticoïdes, à des dates de délivrance différentes, pendant une année, précédemment à la première hospitalisation de l’année n ; ou b) un diagnostic de maladie rénale terminale ou de leucémie.
Les enfants atteints de maladies chroniques et sévères pouvant être associées à un diabète insulinodépendant non auto-immun (mucoviscidose ou drépanocytose) ont également été exclus de la population d’étude.
Les enfants étaient aussi exclus si, précédemment au début de la première hospitalisation sélectionnée de l’année n, ils avaient bénéficié au moins une fois d’un remboursement d’insuline ou d’antidiabétiques oraux.
Des précisions sur les méthodes de détection des enfants correspondant aux critères d’exclusion ont été présentées antérieurement 14. Ces méthodes s’appuient sur des algorithmes précédemment développés par la Caisse nationale d’assurance maladie des travailleurs salariés (Cnam-TS) 16 et utilisant des données provenant de différentes sources : diagnostics médicaux des hospitalisations et des affections de longue durée, et remboursements de médicaments.
Analyses
La distribution du nombre de cas incidents a été observée par sexe, classe d’âge (6 mois-4 ans, 5-9 ans et 10-14 ans) et région de domicile. Cette dernière était déterminée selon le domicile enregistré dans le PMSI lors de l’hospitalisation incidente.
Des taux d’incidence bruts ont été calculés en cumulant les trois années d’étude les plus récentes afin de limiter les variations dues à de petits effectifs, notamment par région. Ces taux d’incidence, spécifiques par région, classe d’âge et sexe, ont été calculés à partir du nombre d’enfants nouvellement diagnostiqués DT1, divisé par le nombre de personnes-années. Les personnes-années étaient estimées par la moyenne des populations (âgées de 6 mois à 14 ans) au 1er janvier des années n et n+1, évaluées par l’Institut national de la statistique et des études économiques (Insee). L’âge retenu dans le PMSI et dans les populations Insee était l’âge révolu, c’est-à-dire l’âge au dernier anniversaire, ou le nombre entier d’années vécues par la personne à un instant donné.
Pour représenter les taux régionaux sur une carte de France, la méthode de discrétisation des seuils naturels (méthode de Jenks 17) et un fond de carte de l’Institut national de l’information géographique et forestière (IGN) ont été utilisés.
Les analyses ont été réalisées avec le logiciel SAS Enterprise guide®, version 4.3 (SAS, Cary, États-Unis) et le logiciel R (version 3.3.2) pour la cartographie.
Résultats
Incidence sur la période 2013-2015
Entre 2013 et 2015 en France, 6 424 enfants (2 008 en 2013, 2 130 en 2014 et 2 286 en 2015) ont été identifiés comme nouvellement atteints de DT1 (tableau 1) : 3 411 garçons et 3 013 filles. Le ratio garçon/fille était de 1,13.
 Agrandir l'image
Agrandir l'imageLes taux d’incidence étaient respectivement de 18,0 pour 100 000 personnes-années en France, 18,6 chez les garçons et 17,3 chez les filles. La représentation graphique des taux d’incidence par sexe et classe d’âge (figure 2) montre une augmentation des taux d’incidence avec l’âge, chez les garçons comme chez les filles. Chez les 6 mois-4 ans et les 10-14 ans, les taux d’incidence étaient plus élevés chez les garçons.
 Agrandir l'image
Agrandir l'imageVariations régionales sur la période 2013-2015
Le nombre de cas incidents et les taux d’incidence bruts par région sont présentés dans le tableau 2. Les taux d’incidence régionaux les plus élevés étaient observés dans les régions Corse (21,7 pour 100 000 personnes-années), Provence-Alpes-Côte d’Azur et Hauts-de-France. Les taux d’incidence régionaux les plus bas étaient mis en évidence dans les régions Guyane (3,6 pour 100 000 personnes-années), Guadeloupe et La Réunion. En France métropolitaine, les taux les plus bas étaient observés dans les régions Pays de la Loire, Nouvelle-Aquitaine et Normandie. Une visualisation cartographique de ces différences régionales est présentée dans la figure 3.
 Agrandir l'image
Agrandir l'image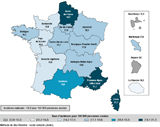 Agrandir l'image
Agrandir l'imageDiscussion
Notre étude a mis en évidence un taux d’incidence du DT1 chez les enfants de 18,0 pour 100 000 personnes-années en France sur la période 2013-2015. Les variations régionales observées étaient importantes : les taux variaient de 3,6 pour 100 000 personnes-années en Guyane à 21,7 en Corse sur la période. En France métropolitaine, les taux étaient les plus élevés dans les Hauts-de-France, en Provence-Alpes-Côte-d’Azur et en Corse, et les plus bas dans les Pays de la Loire, la Normandie et la Nouvelle-Aquitaine.
Cette étude est la première à produire une estimation nationale de l’incidence du DT1 de l’enfant en France à partir de bases de données médico-administratives. Une de ses grandes forces est sa très large couverture, presque 100% de la population française. En France, les enfants sont quasiment toujours hospitalisés au moment du diagnostic du DT1 pour l’initiation du traitement par insuline 6,7. Ainsi, même si les enfants pris en charge pour le diagnostic de leur diabète par un médecin de ville ne sont pas pris en compte dans notre méthode de sélection, cette éventualité est peu probable en France. Par ailleurs, l’algorithme de sélection de notre étude tient compte à la fois des données d’hospitalisation et des données de remboursement des bénéficiaires de l’Assurance maladie : leur combinaison contribue de façon importante à la qualité de notre méthode de sélection des cas.
Dans le monde, beaucoup de pays utilisent des registres du DT1 comme méthode de référence (gold standard) pour estimer l’incidence de la maladie 18,19,20,21. Cependant, dans d’autres pays, des bases de données médico-administratives sont utilisées pour estimer l’incidence de ce diabète 22,23,24.
La limite principale de cette étude était l’absence de validation de l’algorithme de sélection par une confirmation clinique de l’atteinte des enfants d’un DT1, confirmation difficile à mettre en œuvre 25, le Sniiram et le PMSI étant des bases de données garantissant l’anonymat. Pour pallier cette absence de confirmation clinique, nous avons construit l’algorithme avec des critères stricts pour garantir une bonne spécificité de notre processus de sélection, en nous appuyant sur des avis d’experts. Nous avons ainsi exclu les doublons et les cas prévalents, et nous avons combiné les données d’hospitalisation chaînées aux données de remboursement. Ainsi, le risque d’avoir considéré l’enfant comme diabétique, alors qu’il ne l’était pas, est très faible, et les critères d’exclusion garantissent de façon presque certaine la sélection d’enfants nouvellement diagnostiqués avec un DT1.
Afin de garantir également une bonne sensibilité de la méthode de sélection, nous avons inclus toutes les hospitalisations pour diabète (codes CIM-10 E10 à E14), sans présupposer de la précision du codage dans le PMSI, et nous avons retenu une période de 12 mois suivant le séjour hospitalier jusqu’à la première délivrance remboursée d’insuline, afin de ne pas exclure les cas de « lune de miel ». Il s’agit d’une période transitoire d’une durée de 6 à 9 mois en moyenne, vécue par certaines personnes, qui est marquée par une diminution importante des besoins de traitement par insuline, et qui peut se traduire par une absence de remboursement d’insuline.
Enfin, des éléments externes sont en faveur de la qualité de l’algorithme : nos résultats sont cohérents avec ceux de registres français contenant des informations cliniques, ainsi qu’avec leurs projections 7,13,26,27.
Une autre limite est le risque de surestimation du nombre d’enfants nouvellement diagnostiqués diabétiques de type 1. En effet, certains enfants peuvent être atteints d’une autre forme de diabète : les diabètes monogéniques, par exemple le diabète MODY (Maturity-Onset Diabetes of the Young, ou diabète de type adulte chez le jeune), le diabète de type 2, les diabètes iatrogènes ou un diabète causé par une maladie chronique spécifique, des maladies du pancréas exocrine, d’autres maladies endocrines ou des infections. Même si ces autres formes de diabète sont peu fréquentes chez les enfants 1,28, nous nous sommes efforcés de les exclure de la population d’étude afin de conserver une bonne spécificité de la méthode de sélection. L’identification des enfants qui avaient certains traitements ou certaines maladies associées au diabète nous a permis d’exclure, respectivement, les enfants qui pouvaient être atteints soit d’un diabète de type 2 ou iatrogène, soit d’un diabète associé à une autre maladie chronique. Cependant, dans un petit nombre de cas, l’algorithme peut inclure comme diabétique de type 1 un enfant atteint de diabète de type 2 traité par insuline uniquement, ou un enfant atteint de diabète monogénique.
Comme les autres études utilisant des bases de données médico-administratives, notre étude est concernée par les limites relatives à l’enregistrement, la saisie et le codage des données.
D’autres limites sont inhérentes à des contraintes techniques d’utilisation du Sniiram et du PMSI et sont partagées par la plupart des études utilisant ces bases de données, par exemple la présence de doublons non détectés (estimés à moins de 1 pour 1 000 en 2015), l’exclusion de jumeaux de même sexe ou les difficultés d’identification de personnes uniques à travers les différentes sources de données 29.
Des variations régionales importantes ont été observées dans notre étude. Face au faible nombre d’enfants nouvellement diagnostiqués diabétiques de type 1 dans certaines régions, nous avons calculé des taux d’incidence cumulés sur trois années. Cependant, le nombre de cas demeurait faible dans quelques régions et a pu rester impacté par des fluctuations dues aux petits effectifs : comme indiqué dans le tableau 2, moins de 50 nouveaux cas étaient observés en trois ans dans les régions Guyane, Guadeloupe, Corse et Martinique. Par ailleurs, les faibles taux d’incidence relevés dans les DOM, et notamment en Guyane, méritent d’autres investigations afin de s’assurer de la fiabilité de l’algorithme au sein de ces territoires (notamment en cas de spécificités de recours aux soins). Néanmoins, une étude menée sur la même période à La Réunion mais utilisant une méthodologie différente mettait en évidence des taux d’incidence similaires dans cette région 30.
Les causes de ces variations géographiques, qu’elles soient au niveau régional ou international, sont mal connues dans la littérature, malgré les nombreux facteurs étudiés pour les expliquer : facteurs environnementaux ou interactions entre génétique et environnement, notamment des infections virales, des facteurs nutritionnels, des substances toxiques, des conditions de vie familiale stressantes, l’absence d’allaitement, le manque de vitamine D ou des facteurs liés à l’hypothèse hygiéniste. Plus probablement, ces variations doivent être expliquées par une combinaison complexe de causes, dont certaines restent à découvrir 10,11,31,32,33,34. De nouvelles approches géographiques pour étudier les facteurs environnementaux de maladies multifactorielles pourraient conduire à d’autres facteurs explicatifs 35.
Pour améliorer la compréhension de la variabilité géographique de l’incidence en France, des analyses environnementales, utilisant la commune de résidence des enfants nouvellement diagnostiqués, pourraient rechercher une hétérogénéité spatiale ainsi que des agrégats spatiaux et temporels de cas (clusters), sur la base de notre étude. Ces analyses permettraient d’explorer l’hypothèse d’un lien entre facteurs environnementaux et survenue du DT1.
Face à la gravité potentielle du DT1 (au moment de sa découverte et pendant son évolution), à son poids sur les structures habilitées à le prendre en charge 36 et à l’augmentation de son incidence en France entre 2010 et 2014 14, des adaptations du système de santé pourraient être encouragées, dans les champs de l’organisation et du recours aux soins 9, mais aussi dans le champ de la prévention. Des campagnes d’information sur les symptômes d’alerte permettent d’éviter un retard au diagnostic et donc ses complications, comme l’acidocétose inaugurale 37,38.
Par ailleurs, le Sniiram et le PMSI pourraient permettre un suivi prospectif des enfants diabétiques afin d’améliorer la spécificité de l’algorithme de sélection des cas incidents et de surveiller la survenue des complications.
L’algorithme de sélection des enfants nouvellement diagnostiqués diabétiques de type 1 pourra également être utilisé pour une surveillance sur le long terme de l’incidence du DT1 chez les enfants en France.
Conclusion
Les bases de données médico-administratives permettent de disposer d’informations sur l’incidence de certaines maladies, essentielles pour la surveillance épidémiologique de la maladie ainsi que la planification de soins de santé. Elles assurent également des ressources intéressantes pour la recherche en santé. En l’absence de registre national du DT1, les bases de données médico-administratives permettent l’estimation de l’incidence de la maladie chez tous les enfants de la population française, ainsi que ses variations régionales.
Remerciements
Nous remercions le Dr Anne Fagot-Campagna (Caisse nationale d’assurance maladie des travailleurs salariés) et le Dr Bertrand Gagnière (Cellule d’intervention de Santé publique France en région Ouest) pour leur contribution significative à cette étude.




