Caractéristiques des infections VIH très récentes et réseaux de transmission à partir des données de la déclaration obligatoire, France, 2012-2014
// Characteristics of very recent HIV infections and transmission networks based on data from the mandatory notification system, France 2012-2014
Résumé
Introduction –
Les variants VIH identifiés à un stade précoce de l’infection sont des indicateurs des souches circulant en France et participant à l’épidémie. L’objectif de l’étude était de décrire les caractéristiques des patients récemment infectés par le VIH-1 en France en analysant, de façon combinée, les données épidémiologiques issues de la déclaration obligatoire (DO) et les données virologiques du Centre national de référence du VIH (CNR VIH).
Méthodes –
Le dispositif de DO pour le VIH est associé à une surveillance virologique effectuée à partir d’échantillons de sérum collectés sur buvard. Un test d’identification des infections très récentes (ITR=31 jours) a été réalisé sur tout échantillon reçu au CNR VIH entre janvier 2012 et décembre 2014. Pour toute ITR, l’amplification et le séquençage d’un fragment (env) du génome viral ont été effectués, suivis d’une analyse phylogénétique. Les données épidémiologiques des sujets identifiés en ITR ont été recueillies à partir de la DO. Un modèle multivarié de régression logistique a été utilisé pour identifier les facteurs associés à l’appartenance à un réseau de transmission.
Résultats –
Sur les 17 010 échantillons collectés, 1 988 (12%) ITR ont été identifiées, pour lesquelles 714 séquences ont été obtenues (36%). L’échantillon final incluait 549 cas. On dénombrait 493 hommes (90%), dont 315 contaminés suite à des rapports sexuels avec des hommes (HSH). Quarante-trois réseaux de transmission (107 cas, dont 70 HSH), de 2 à 11 cas chacun, ont été identifiés, principalement localisés en Île-de-France et dans le sud-est de la France. Être HSH était le seul facteur associé à l’inclusion dans un réseau de transmission (OR=4,2 ; IC95%: [1,6-11,0] ; p=0,004).
Conclusion –
L’analyse combinée des données sociodémographiques et épidémiologiques issues de la DO et des données virologiques issues du CNR VIH permet de disposer d’éléments objectifs décrivant les patients avec infection très récente à VIH en temps réel, notamment au travers de l’identification de réseaux de transmission.
Abstract
Background –
HIV variants identified at an early stage of infection are indicators of strains which are spreading in France and contribute to the epidemics. The study aimed to describe the characteristics of very recent HIV-1 infections (VRI) in France, combining epidemiological data from the French HIV mandatory notification system and virological surveillance data from the HIV National Reference Center.
Methods –
The HIV mandatory reporting system for new HIV diagnoses is linked to virological surveillance using dried serum spots (DSS). A VRI identification test (VRI=31 days) was performed for all samples received at the NRC between January 2012 and December 2014. For each VRI, amplification and sequencing of a viral genome fragment (env) were performed, followed by a phylogenetic analysis. Epidemiological data of subjects identified for VRI were collected from the mandatory notification system. A multivariate logistic regression model was used to identify factors associated with the fact of belonging to a transmission network.
Results –
Out of 17,010 DSS collected, 1,988 corresponded to a VRI (12%) of which 714 (36%) were sequenced. The final study sample included 549 cases, corresponding to 493 men (90%), of whom 315 were identified as men who have sex with men (MSM). Forty three dyads/clusters of 2 to 11 cases each were identified (107 cases, including 70 MSM), mainly located in the Greater Paris Area and the South-East of France. The only factor associated with clustering was the fact of being a MSM (OR=4.2, 95%CI= [1.6-11.0], p=0.004).
Conclusions –
The cross-analysis of socio-demographic and epidemiological data from the mandatory reporting system and virological surveillance data from NRC allows the collection of objective evidence to describe the characteristics of very recent HIV infections in France in real time, particularly through the identification of transmission networks.
Introduction
En France, la déclaration obligatoire (DO) du VIH a permis de montrer des dynamiques différentes selon les populations et les modes de contaminations, bien que le nombre de découvertes de séropositivité soit globalement stable depuis 2007 : stabilité des diagnostics liés à une contamination par rapports hétérosexuels et augmentation des diagnostics liés à des rapports sexuels entre hommes 1. Parmi les personnes ayant découvert leur séropositivité en 2014, 42% étaient des hommes ayant des rapports sexuels avec des hommes (HSH), 39% étaient des hétérosexuels nés à l’étranger, 17% des hétérosexuels nés en France et 1% des usagers de drogues injectables.
Le système de la DO VIH est couplé à une surveillance virologique effectuée par le Centre national de référence du VIH (CNR VIH) 2. Le CNR réalise les tests permettant la détermination du type, groupe et sous-type (B vs non-B) de VIH, ainsi qu’un test d’infection récente (TIR) à partir des échantillons de sérum sur buvard envoyés par les laboratoires volontaires ayant réalisé le diagnostic. Le TIR permet de distinguer biologiquement les personnes récemment infectées (infection datant de moins de six mois en moyenne) et d’estimer ainsi l’incidence de la maladie 3. Ce test présente une sensibilité de 88% et une spécificité de 84% 4. L’analyse phylogénétique des séquences virales de ces échantillons permet d’identifier des réseaux de transmission du VIH. La compréhension de ces réseaux est un élément important dans l’élaboration des mesures de prévention.
L’objectif principal de la présente étude était, à l’aide d’une modification du seuil du TIR, de décrire les caractéristiques sociodémographiques, épidémiologiques et virologiques des patients très récemment infectés par le VIH en France à partir de la DO 2012-2014, et d’identifier parmi eux des réseaux de transmission.
Méthodes
Population d’étude
La sélection des patients a été effectuée à partir des buvards reçus au CNR VIH entre le 1er janvier 2012 et le 31 décembre 2014. Pour l’inclusion, une modification du seuil du test TIR a permis d’identifier les infections très récentes (ITR) et de sélectionner ainsi les prélèvements de personnes infectées depuis 31 jours en moyenne. Le seuil du test TIR (<2,2) choisi pour identifier une ITR dans cette étude a été déterminé à l’aide de 581 sérums séquentiels provenant de 244 séroconverteurs 5. Il correspondait à une durée moyenne d’infection de 31 jours avec, dans 95% des cas, une durée inférieure à 75 jours et, dans 99% des cas, une durée inférieure à 159 jours. L’analyse rétrospective des données de la DO permet d’estimer que la spécificité est supérieure à 97% pour les patients infectés depuis plus de six mois. Le fait d’utiliser ce seuil permettait de restreindre les analyses moléculaires aux seules ITR, pour des raisons de faisabilité et de coût, et de se focaliser sur l’identification de souches circulant sur le territoire durant la période d’étude.
Ont été inclus les patients pour lesquels le test d’ITR était positif et le génotypage réalisable. Ont été exclus les cas pour lesquels le chaînage avec les données épidémiologiques de la DO n’était pas possible, les doublons, les diagnostics au stade clinique de sida et les patients ayant refusé la surveillance virologique (figure 1).
Exploitation et analyse des données
Une analyse descriptive de l’ensemble des patients inclus a été réalisée à partir des variables disponibles dans la DO : âge, sexe, département de domicile, pays de naissance, mode de contamination déclaré, lieu probable de la contamination déclaré, stade clinique. Les proportions ont été calculées en excluant les données manquantes du dénominateur.
Des analyses phylogénétiques ont ensuite été conduites. L’ARN viral a été extrait à partir des échantillons de sérum sur buvards, puis amplifié (fragment d’environ 880 paires de base du gène env) par une technique de RT-PCR. Les séquences ont été comparées à des séquences de référence par la méthode des distances évolutives, afin de déterminer le sous-type viral. Pour définir les réseaux de transmission, les séquences amplifiées ont été comparées deux à deux à l’aide de la méthode des distances évolutives 6,7,8. Deux séquences ont été considérées comme liées entre elles et appartenant à un même réseau de transmission lorsque la différence évolutive était inférieure à 1,5% 9.
Enfin, une analyse comparative des populations incluses et non incluses dans les réseaux de transmission a été réalisée, suivie d’une analyse statistique de l’appartenance ou non à un réseau de transmission à l’aide d’un modèle de régression logistique multiple. Les variables redondantes n’ont pas été intégrées dans le modèle multivarié. Les analyses ont été réalisées sous SAS 9.3®.
Résultats
Les 17 010 buvards reçus au CNR VIH sur la période d’étude correspondaient à des dates de diagnostic de juillet 2011 à décembre 2014. Parmi ces nouveaux diagnostics d’infection à VIH, 1 988 (12%) avaient un test ITR positif et, parmi ceux-ci, 714 séquences virales (36%) ont été obtenues (figure 1). Après exclusion des cas non analysables, notre échantillon final comportait 549 infections très récentes génotypées.
 Agrandir l'image
Agrandir l'image
Caractéristiques sociodémographiques de la population
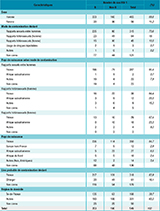
La proportion d’hommes dans notre échantillon était de 90%. L’âge médian au diagnostic était de 36 ans (minimum=16 ans, maximum=76 ans). Les 20-39 ans représentaient près de 60% de notre échantillon. La grande majorité des personnes incluses (85%) étaient nées en France et 6,5% étaient nées en Afrique subsaharienne.
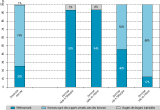
Parmi les personnes incluses, 74% avaient été contaminées par rapports sexuels avec des hommes (83% des hommes), 25% par rapports hétérosexuels (94% des femmes et 17% des hommes) et 0,7% par usage de drogues injectables (6% des femmes) (tableau 1). Parmi les hommes hétérosexuels, 64% étant nés en France et 20% en Afrique subsaharienne, alors que chez les HSH, 91% étaient nés en France et seulement 1% en Afrique subsaharienne. Parmi les femmes contaminées par rapports hétérosexuels, 67% étaient nées en France et 23% en Afrique subsaharienne. Parmi les hommes, le mode de contamination était différent selon le pays de naissance, avec 88% de contamination par rapports sexuels entre hommes pour les hommes nés en France vs 46% de contamination par rapports hétérosexuels pour les hommes nés à l’étranger (figure 2).
Avec 10% de 50 ans et plus parmi les HSH contre 29% parmi les personnes contaminées par rapports hétérosexuels, les HSH étaient significativement plus jeunes (36 ans d’âge moyen au diagnostic vs 42 ans).
 Agrandir l'image
Agrandir l'image
 Agrandir l'image
Agrandir l'image
Lorsque l’information était disponible, le stade clinique le plus fréquemment retrouvé au sein des ITR était la primo-infection (74%), suivi du stade asymptomatique (24%) puis symptomatique non sida (2%).
Les patients étaient domiciliés plus fréquemment en Île-de-France (40%), en région Provence-Alpes-Côte d’Azur (14%) et en Rhône-Alpes (10%). Au niveau départemental, Paris concentrait le plus grand nombre d’ITR sur la période, suivi des Alpes-Maritimes puis du Rhône.
Caractéristiques biologiques et analyses phylogénétiques
Dans notre échantillon, 64% des personnes présentaient un VIH-1 de sous-type B et 36% de sous-type non-B, dont le plus important était le sous-type 02AG (17,5%). La proportion de sous-type non-B était plus importante parmi les personnes contaminées par rapport hétérosexuels que chez les HSH (65% vs 25%) (tableau 1). La part des personnes nées en Afrique subsaharienne était plus élevée parmi les infections de sous-types non-B (17%) que parmi celles de sous-types B (2%). Parmi les sous-types non-B, 30% des personnes contaminées par rapports hétérosexuels étaient nées en Afrique subsaharienne et 58% en France. La très grande majorité des HSH de sous-types non-B étaient nés en France. Concernant le sous-type B, 89% des personnes étaient nées en France (tous modes de contamination).
L’analyse phylogénétique a retrouvé 43 réseaux de transmission, comprenant 107 individus au total (soit 19% de la population incluse) : 8 réseaux de transmission de plus de 3 personnes (dont 3 de sous-type non-B) et 35 paires (dont 10 de sous-types non-B). Le réseau de transmission le plus important était composé de 11 hommes infectés par un variant de sous-type CRF02_AG (figure 3). L’analyse spatiotemporelle montrait une diffusion initiale très rapide dans les Bouches du Rhône (6 cas entre janvier 2012 et juin 2012) suivie d’une diffusion à Paris en 2013-2014 (5 cas). Le second réseau de transmission le plus important était composé de 6 hommes (5 HSH) infectés par un variant B en 2013-2014 à Paris. L’analyse des autres réseaux de transmission et paires montrait dans la majorité des cas une concentration spatiotemporelle reflétant l’existence de réseaux de transmission régionaux.
 Agrandir l'image
Agrandir l'image
Caractéristiques des patients inclus dans des réseaux de transmission
La population incluse dans les réseaux de transmission était différente de la population « non-clustérisée » sur certaines caractéristiques sociodémographiques et clinico-biologiques (tableau 2). Il y avait davantage d’hommes inclus dans les réseaux de transmission (95% vs 88%), d’HSH (93% vs 69%), de personnes nées en France (94% vs 83%) et contaminées en France (95% vs 82%). L’analyse multivariée a permis de mettre en évidence l’influence du mode de contamination sur l’inclusion dans un réseau de transmission. Ainsi, les HSH présentaient une probabilité plus importante d’être inclus dans un réseau de transmission (odds ratio, OR=4,2 ; intervalle de confiance à 95%, IC95%: [1,6-11,0]) que les personnes contaminées par rapports hétérosexuels ou usage de drogues injectables.
 Agrandir l'image
Agrandir l'image
Discussion
Cette étude a été menée sur les données nationales de trois années consécutives (2012-2014) à partir d’échantillons de sérum sur buvard centralisés au CNR VIH. Elle s’est focalisée sur les infections très récentes, permettant d’avoir une image des caractéristiques de variants ayant circulé récemment dans la population française.
Les caractéristiques des patients nouvellement infectés par le VIH en France entre 2012 et 2014, et diagnostiqués très précocement, ont pu être analysées : une grande majorité d’hommes (90%), un âge médian de 36 ans et une population essentiellement née en France (85%). La proportion retrouvée de sous-type non-B chez les HSH dans notre enquête (25% des cas) témoignait de la circulation active de ces sous-types dans la population de HSH en France. La grande majorité a été diagnostiquée au stade de primo-infections symptomatiques (71%). Le seul facteur lié à l’inclusion dans un réseau de transmission est le fait d’avoir été contaminé par rapports sexuels entre hommes, facteur également retrouvé dans la littérature pour les infections récentes 10.
Les rapports sexuels entre hommes représentaient le mode de contamination le plus important et concernaient près des trois quarts de l’échantillon. Cette proportion d’HSH parmi les personnes présentant des infections très récentes, supérieure à celle observée parmi les nouveaux diagnostics d’infection à VIH, peut s’expliquer par un recours au dépistage des HSH plus fréquent que celui de la population générale 11,12,13. Se focaliser sur les infections très récentes sélectionne les personnes ayant une plus grande probabilité d’être diagnostiquées à un stade précoce du fait d’un recours au dépistage plus fréquent. C’est pourquoi la population des HSH est surreprésentée dans notre étude par rapport à l’ensemble des diagnostics. A contrario, les populations ayant un moindre recours au dépistage, telles que les populations d’Afrique subsaharienne ou encore les populations des départements et territoires d’outre-mer, sont sous-représentées par rapport à l’ensemble des diagnostics. Cette sélection préférentielle des personnes ayant un recours fréquent au dépistage constitue une limite de cette étude. Cependant, l’identification d’ITR chez des patients originaires d’Afrique subsaharienne, y compris dans certains cas par des souches de sous-type B, conforte la notion de poursuite de l’épidémie dans la population migrante via des contaminations acquises sur le territoire français. Cette observation est un argument supplémentaire pour amplifier les mesures de prévention spécifiquement dédiées à cette population 14.
Notre enquête comporte d’autres limites. L’effectif est réduit par le choix de se focaliser sur les infections très récentes. En effet, les bases de la DO et du CNR 2012-2014 n’étant pas chainées, elles nécessitaient pour chaque patient inclus un chaînage manuel des données épidémiologiques et virologiques, d’où la nécessité de restreindre l’enquête pour des raisons de faisabilité et de coût. Cependant, la mise en place de la déclaration obligatoire en ligne (e-DO) du VIH, débutée en 2016, devrait permettre de faciliter le chainage et de disposer de données presqu’en temps réel. De plus, en dehors de la probable surreprésentation de patients HSH, notre échantillon d’étude n’est pas exhaustif et probablement non représentatif pour les raisons suivantes : 1) la non exhaustivité de la DO avec une sous-déclaration estimée à 30% 1 ; 2) les données de la DO, en particulier pour la fin de l’année 2014, n’avaient pas encore été totalement renseignées, excluant un certain nombre de cas pour lesquels les séquences virales étaient disponibles ; 3) l’envoi des buvards par les laboratoires effectuant le diagnostic de l’infection à VIH étant basé sur le volontariat, la non-participation des biologistes à la surveillance virologique était de 20% en 2013 ; 4) la technique d’amplification sur buvard présente des limites et seuls environ 40% des échantillons correspondant aux ITR ont pu être amplifiés et séquencés. Ceci s’explique par le volume extrêmement réduit (une goutte de sérum séché) disponible. Cependant, les caractéristiques de cas amplifiés et non amplifiés sont différentes pour certaines variables (sexe, région de domicile), mais pas pour d’autres (mode de contamination, âge, pays de naissance). Cela pourrait biaiser les comparaisons entre cas appartenant ou non à un réseau de transmission. Le résultat de l’analyse multivariée (seule caractéristique associée à l’appartenance à un réseau de transmission = contamination par rapports sexuels entre hommes) n’est donc pas affecté, puisque la répartition par mode de contamination ne montre pas de différence significative entre les cas non amplifiés (54% HSH, 23% hétérosexuels, 23% autre ou inconnu) et ceux amplifiés (respectivement 58%, 21% et 20%), p=0,24. Des études complémentaires sur la représentativité des ITR amplifiées seraient nécessaires pour consolider ces premiers résultats.
Malgré ces limites, la méthodologie développée, couplant données cliniques, sociodémographiques et virologiques sur trois années en France, permet une description des variants récemment transmis chez des personnes diagnostiquées rapidement après leur contamination ainsi que des réseaux de transmission observés dans cette population. Elle montre l’existence de réseaux de transmission regroupant des personnes à la fois contaminées très récemment et diagnostiquées peu de temps après leur contamination, notamment chez les HSH.
D’une façon générale, il reste nécessaire de continuer les efforts de prévention, particulièrement dans le groupe des HSH, et de mobiliser tous les outils disponibles (préservatif, dépistage, traitements) dans une logique de prévention combinée. L’incitation au dépistage reste une action prioritaire afin de pouvoir proposer un traitement adapté le plus tôt possible dans l’histoire de la maladie. Cependant, elle ne suffit pas puisque les réseaux de transmission mis en évidence par la présente étude sont constitués de personnes ayant recouru au dépistage très rapidement après la prise de risque ayant conduit à leur contamination. La mise en place de la prophylaxie pré-exposition (PrEP) à l’aide du Truvada®, autorisée en France depuis le 23 novembre 2015 et remboursée à 100%, devrait également contribuer à diminuer la transmission du virus dans cette population.
Sur le plan épidémiologique, la mise en place de la e-DO est un élément pouvant améliorer le taux de déclaration ainsi que sa rapidité. Couplée à l’analyse de la diversité des souches circulantes via les données de séquences virales parmi les ITR, l’identification presqu’en temps réel de foyers de transmission active de certaines souches pourrait permettre des interventions ciblées, complémentaires des actions de prévention rappelées ci-dessus.




