Impact de l’exposition à la pollution atmosphérique d’origine automobile sur la morbidité respiratoire et allergique au cours de l’enfance : leçons de la cohorte Paris
// Impact of traffic-related air pollution on respiratory and allergic morbidity in childhood: Lessons from the PARIS cohort
Résumé
Introduction –
Les objectifs sont de décrire la morbidité respiratoire et allergique des enfants de la cohorte Paris jusqu’à l’âge de 13 ans, et d’étudier son association avec l’exposition chronique à la pollution atmosphérique d’origine automobile (PAA), à différentes fenêtres d’exposition, en explorant les potentiels effets modificateurs.
Matériel et méthodes –
Ce travail porte sur les 2 453 enfants de la cohorte Paris toujours suivis jusqu’à l’âge de 8-9 ans (64%). La morbidité est documentée au travers des prévalences des diagnostics d’asthme, d’eczéma et de rhume des foins et des prévalences annuelles des symptômes évocateurs de ces pathologies. L’exposition à la PAA a été estimée par les concentrations d’oxydes d’azote mesurées par les stations de fond du réseau Airparif durant la grossesse et modélisées par un modèle physico-chimique de dispersion pour les périodes post-natales. L’association entre l’exposition à la PAA aux différentes fenêtres d’exposition et la morbidité respiratoire et allergique (incidence, prévalence) est étudiée au moyen de divers modèles de régressions (Cox et logistiques), après ajustement sur les facteurs de confusion potentiels, avec recherche d’effets modificateurs.
Résultats –
Cette recherche montre des associations avec la PAA distinctes selon la fenêtre d’exposition et la maladie respiratoire/allergique considérées. L’exposition postnatale à la PAA est reliée aux maladies respiratoires allergiques durant l’enfance, alors que l’exposition prénatale ne l’est pas. La dermatite atopique n’est pas associée à l’exposition à la PAA. Des sous-groupes de population plus vulnérables sont mis en évidence, la présence d’antécédents parentaux d’allergie, notamment d’asthme, la survenue précoce d’infections des voies respiratoires basses, d’événements familiaux stressants majorant la sensibilité aux effets de la PAA.
Conclusion –
Ces résultats confirment l’intérêt pour les pouvoirs publics de poursuivre les efforts de réduction des niveaux de PAA dans l’agglomération parisienne.
Abstract
Introduction –
This study aimed to describe respiratory and allergic morbidity in children aged 13 years and under in PARIS cohort, and to study associations with traffic-related air pollution (TRAP) exposure for different timeframes in order to elucidate potential modifying effects.
Methods –
This work concerns 2,453 children from the PARIS cohort who were monitored up to the age of 8-9 years (64%). Morbidity was documented using prevalence of asthma, eczema and hay fever diagnoses and annual prevalence of symptoms for these diseases. TRAP exposure was estimated using nitrogen oxide concentrations as measured by background stations from the Airparif air quality network during pregnancy then estimated using an air dispersion model for postnatal periods. Associations between TRAP exposure at various timeframes and respiratory/allergic morbidity (incidence, prevalence) were studied using different regression models (Cox, logistic) after adjusting for confounders and examining potential modifiers.
Results –
Our results show differing TRAP exposure associations according to the exposure timeframe and respiratory/allergic disease. Postnatal TRAP exposure was related to respiratory allergic diseases during childhood, whereas prenatal exposure was not. Atopic dermatitis was not associated to TRAP exposure. The vulnerability of certain subgroups is highlighted as parental history of allergy, especially asthma, early occurrence of repeated lower-respiratory tract infections, and stressful family events appear to enhance the effects of postnatal TRAP exposure.
Conclusions –
These results confirm the interest for public policy to continue reducing TRAP levels in the Paris region.
Introduction
Les maladies allergiques comme l’asthme, la rhinite allergique et la dermatite atopique sont un enjeu de santé publique. L’Organisation mondiale de la Santé (OMS) les place en quatrième position au regard du nombre de cas dans le monde 1. Les affections respiratoires figurent parmi les maladies chroniques les plus fréquentes chez l’enfant. Elles altèrent la qualité de vie et engendrent des coûts importants pour la société.
Ces pathologies multifactorielles sont d’étiologie complexe. À côté de facteurs intrinsèques (génétique…), divers comportements caractéristiques du mode de vie (tabagisme, activité physique, régime alimentaire…) et de nombreuses expositions environnementales ont été étudiés en lien avec les maladies allergiques, à différentes fenêtres d’exposition.
L’impact sanitaire des expositions à la pollution atmosphérique d’origine automobile (PAA) est une préoccupation croissante pour la société, de plus en plus urbaine. Si l’exposition aiguë à la PAA est connue pour son effet à court terme provoquant des exacerbations de l’asthme, le lien entre exposition chronique à la PAA et développement de pathologies respiratoires et allergiques n’est pas clairement établi chez les enfants et les adolescents et les résultats des études sont souvent discordants 2. Cette hétérogénéité tient à des différences méthodologiques dans le choix des variables sanitaires, dans la vulnérabilité des populations étudiées et dans les modalités d’évaluation de l’exposition. Certains auteurs utilisent la distance du lieu de vie jusqu’à un axe routier ou la densité de trafic, d’autres, les mesures de polluants traceurs du trafic fournies par les stations fixes des réseaux de surveillance de la qualité de l’air, tandis que de plus en plus d’équipes ont recours à une modélisation des concentrations de polluants, par des modèles statistiques LUR (Land-Use Regression) ou par des modèles physico-chimiques de dispersion des polluants 3. Les polluants d’intérêt sanitaire varient également (ce sont surtout les oxydes d’azote (NOx), notamment le dioxyde d’azote (NO2) et les particules fines), de même que les lieux de vie étudiés (essentiellement le domicile, parfois l’école). Enfin, les fenêtres d’exposition considérées peuvent différer.
La petite enfance constitue une période critique en raison de la croissance, de l’immaturité post-natale des organes, de la mise en place progressive du système immunitaire, mais aussi en raison des conditions d’exposition des enfants (respiration par la bouche, activité physique) 4.
Dans ce contexte, le suivi de cohortes de naissances est le plus à même de tenir compte de la chronologie, de la précocité et de la multiplicité des expositions avant l’éventuelle survenue de perturbations cliniques, fonctionnelles ou biologiques. Entre 2003 et 2006, a été mise en place, la cohorte de nouveau-nés franciliens Paris (Pollution and asthma risk: an infant study), afin d’étudier l’incidence et la prévalence des symptômes des maladies respiratoires et allergiques chez l’enfant et leur relation avec l’évolution du mode et du cadre de vie des enfants.
Cet article a pour objectif de documenter :
–la morbidité respiratoire et allergique des enfants de la cohorte Paris, jusqu’à leurs 13 ans ;
–leur exposition chronique à la PAA, à différentes fenêtres d’exposition ;
–les associations entre cette exposition chronique à la PAA (aux différentes fenêtres) et la morbidité respiratoire et allergique jusqu’à l’âge de 13 ans, en explorant les potentiels effets modificateurs.
Matériel et méthodes
La cohorte est constituée de 3 840 nouveau-nés sains, nés à terme, et recrutés au moment de la naissance entre 2003 et 2006 dans cinq maternités parisiennes 5.
Le suivi prospectif s’est fait dès l’inclusion, à la maternité, puis par auto-questionnaires sanitaires, environnementaux et comportementaux administrés aux parents tous les trois mois la première année, tous les six mois la deuxième, annuellement jusqu’à l’âge de 6 ans, puis à 8/9 ans et à 13 ans. De plus, les enfants ont bénéficié de trois bilans clinico-biologiques gratuits, effectués au centre des examens de santé de l’enfant de la Caisse primaire d’assurance maladie de Paris, à 18 mois et à 15/16 ans (en cours), et dans les services des explorations fonctionnelles respiratoires des hôpitaux Necker et Trousseau, à 8/9 ans. Ces bilans ont donné lieu à la constitution de biothèques.
La mise en place et le suivi de la cohorte Paris ont reçu un avis favorable de la Commission nationale de l’informatique et des libertés (Cnil) : avis n° 031153 et n° 051289. Les bilans clinico-biologiques ont fait l’objet d’un avis favorable du Comité de protection des personnes Île-de-France II (2009-A00824-53). Les parents ont donné leur consentement éclairé par écrit.
Évaluation de la morbidité respiratoire et allergique
Elle repose sur les questions standardisées issues de l’étude multicentrique Isaac (International study of asthma and allergies in childhood) relatives à la prévalence « vie entière » d’asthme, de rhino-conjonctivite et d’eczéma et à la prévalence au cours des 12 derniers mois des symptômes de ces pathologies. Les immunoglobulines de classe E (IgE) totales et spécifiques de trophallergènes et de pneumallergènes ont été dosées dans le sérum lors des trois bilans clinico-biologiques, par technique immuno-enzymatique ImmunoCAP® (Phadia, Thermo Fisher Scientific, Uppsala, Suède).
Évaluation de l’exposition chronique à la PAA
L’exposition à la PAA a été estimée par les concentrations d’oxydes d’azote (NOx), meilleur traceur de la pollution liée au trafic routier en Île-de-France (1), qui sont exprimées en µg/m3 équivalent NO2. Plusieurs fenêtres d’exposition ont été examinées : durant la grossesse, depuis la naissance jusqu’à chaque date de point du suivi et entre les dates de point.
Pour chaque mère, les niveaux moyens d’exposition aux NOx ont été reconstitués sur la grossesse entière et sur chacun des trimestres de grossesse, à partir des mesures de monoxyde d’azote (NO) et de dioxyde d’azote (NO2) de la station du réseau de surveillance de la qualité de l’air Airparif la plus proche du domicile, avec une pondération par l’inverse de la distance.
L’exposition postnatale à la PAA a été évaluée par l’indice ExTra développé par Sacré et al. 6 et validé par Reungoat et al. 7 pour estimer les concentrations de NOx devant chaque lieu de vie des enfants (domicile, lieu de garde, école/collège/lycée), en tenant compte du temps passé dans chacun. ExTra intègre une composante régionale correspondant aux niveaux de fond de NOx mesurés par le réseau Airparif et une composante locale modélisée par un modèle physico-chimique de dispersion des polluants adapté du modèle danois OSPM® (Operational Street Pollution Model) 6,7. Ce modèle nécessite des données topographiques (pour chaque lieu de vie, hauteurs des immeubles et de leurs vis-à-vis renseignées sur les auto-questionnaires, largeurs des trottoirs et chaussées devant les lieux de vie déterminées sur système d’information géographique), des données de densité de trafic fournies par les municipalités, ainsi que des données météorologiques (vitesse et direction des vents mises à disposition par Météo France).
Analyse statistique
La morbidité ressentie est documentée au travers des prévalences annuelles des sifflements, des symptômes évocateurs de dermatite atopique, de rhinite et de rhino-conjonctivite. La prévalence des diagnostics d’asthme, d’eczéma et de rhume des foins au cours des 8/9 premières années de vie, ainsi que l’âge auquel ces diagnostics ont été posés sont décrits, tout comme la sensibilisation allergénique à 18 mois et à 8-9 ans. Enfin, l’exposition à la PAA des enfants de la cohorte Paris est illustrée par les distributions des concentrations de NOx à différentes fenêtres d’exposition. Les niveaux de NOx ont été comparés par des tests non paramétriques, entre la première et la huitième année de vie (test de Mann-Whitney apparié) et suivant le lieu de résidence, à Paris intra-muros ou en banlieue (test de Mann-Whitney).
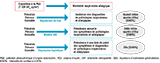
L’association entre l’exposition à la PAA aux différentes fenêtres et la morbidité respiratoire et allergique est étudiée selon les modalités (modèles statistiques et paramètres de quantification) récapitulées figure 1. Les modèles GEE (équations d’estimation généralisées) sont utilisés pour les mesures répétées à chaque date de point du suivi et leur association avec la concentration de NOx correspondante. La structure de corrélation est une corrélation autorégressive d’ordre 1. Le choix des variables d’ajustement s’est fait par un graphe orienté acyclique (DAG : directed acyclic graph), à partir des variables renseignées aux différentes dates de point (sexe, facteurs sociodémographiques et psychosociaux, cadre et mode de vie). La recherche d’interactions statistiques multiplicatives a permis d’identifier les facteurs ayant un effet modificateur sur les associations entre PAA et morbidité. Ainsi ont été testés le sexe, les antécédents parentaux d’allergie/d’asthme, la survenue précoce (au cours de la première année) d’infections des voies respiratoires basses, d’événements familiaux stressants (séparation/divorce des parents, licenciement ou chômage, problème de santé, décès d’un proche).
 Agrandir l'image
Agrandir l'imageRésultats
Population d’étude
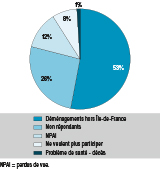
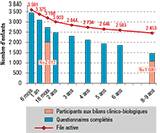
La figure 2 représente l’évolution de la file active de la cohorte Paris depuis l’inclusion des enfants, à la naissance jusqu’à 8/9 ans. À 13 ans, 2 282 enfants (59,5%) sont toujours suivis. Sur les 1 916 familles sollicitées, 732 parents et/ou adolescents (38,2%) ont répondu au questionnaire. Le bilan clinico-biologique de 18 mois a été réalisé pour 2012 participants (52,4%), celui de 8-9 ans pour 1 080 (28,1%). La principale raison de l’abandon était le déménagement des familles en dehors de l’Île-de-France (N=735 ; soit 53,0% des abandons) (figure 3).
 Agrandir l'image
Agrandir l'imageComparés aux perdus de vue, les enfants toujours dans la file active de la cohorte Paris étaient issus de familles possédant un niveau de profession et catégorie socioprofessionnelle (PCS) plus élevé et tendaient à avoir plus souvent au moins l’un de leurs deux parents d’origine française. Leurs mères avaient plus souvent fait des études supérieures, avaient moins fumé durant leur grossesse et étaient plus âgées lors de la naissance de l’enfant. En termes d’antécédents familiaux d’allergie, de symptomatologie respiratoire/allergique la première année de vie, de zone de résidence ou de sexe, ils ne différaient pas de ceux qui ont abandonné.
Les participants de la cohorte sont des garçons pour 51% d’entre eux ; ils appartiennent à un foyer de PCS moyenne (27,5%) ou élevée (65,1%) ; 93% vivent en appartement et à la naissance, les 2/3 habitaient à Paris, 37% en petite couronne tandis qu’à 8/9 ans, 46% habitaient à Paris, 44% en petite couronne et 10% en grande couronne.
Morbidité respiratoire et allergique
La figure 4 décrit l’histoire naturelle de la morbidité ressentie dans la cohorte Paris. Après l’âge d’un an, la prévalence des sifflements décroissait rapidement pour se stabiliser autour de 6% à partir de 8/9 ans tandis que la prévalence des symptômes évocateurs de dermatite atopique était plutôt stable tout au long du suivi (autour de 12%). Quant à la prévalence des symptômes de rhinite et de rhinoconjonctivite, elle diminuait jusqu’à 4 ans avant de remonter ensuite progressivement. Au cours des 8-9 premières années de vie, 13,1% des enfants ont eu un diagnostic d’asthme, 37,6%, un diagnostic d’eczéma et 6,3%, un diagnostic de rhume des foins. Les âges moyens de diagnostic pour ces trois pathologies étaient respectivement de 3,0, 2,1 et 5,3 ans. La présence d’une multimorbidité allergique a été rapportée chez 9,9% des enfants de l’étude. À 18 mois et à 8/9 ans, respectivement 13,6% des nourrissons et 34,5% des enfants étaient sensibilisés à au moins un allergène.
 Agrandir l'image
Agrandir l'imageExposition chronique à la pollution atmosphérique d’origine automobile
L’exposition prénatale des enfants à la PAA était en moyenne de 72,1 ± 10,5 μg/m3 équivalents NO2 de NOx. L’exposition postnatale moyenne aux NOx modélisée grâce à l’indice ExTra était de 80,8 ± 24,9 μg/m3 équivalents NO2 durant la première année de vie des enfants, significativement supérieure à celle durant la huitième année de vie (58,8 ± 12,1 μg/m3 équivalents NO2, p<0,001). Ces concentrations étaient significativement plus élevées pour les enfants vivant dans Paris intra-muros que pour ceux vivant en banlieue (figure 5).
 Agrandir l'image
Agrandir l'imageImpact sanitaire de l’exposition pré- et postnatale à la PAA : associations avec la morbidité respiratoire et allergique
Le tableau 1 présente les associations entre les niveaux de NOx aux différentes fenêtres d’exposition et les prévalences de symptômes évocateurs d’asthme, de dermatite atopique et de rhinite au cours des 8-9 premières années de vie et le tableau 2, les associations entre les niveaux de NOx aux différentes fenêtres d’exposition et l’incidence entre 0 et 8-9 ans des diagnostics d’asthme, de dermatite atopique et de rhume des foins. L’exposition prénatale à la PAA (grossesse entière ou par trimestre, données non montrées) n’était associée ni à la prévalence des symptômes évocateurs de maladie respiratoire/allergique, ni à l’incidence de ces pathologies.
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageLes niveaux de NOx durant la première année de vie étaient significativement associés à la présence de sifflements au cours des 8-9 premières années de vie. Les prévalences annuelles des sifflements, des symptômes de rhinite et de rhino-conjonctivite durant le suivi étaient également reliées aux niveaux annuels de NOx correspondants. L’exposition précoce à la PAA, durant la première année de vie n’était pas, quant à elle, reliée à la présence de symptômes de rhinite au cours du suivi. Enfin, il n’y avait aucune association entre l’exposition postnatale à la PAA et la présence de symptômes évocateurs de dermatite atopique entre 0 et 8-9 ans.
L’incidence du diagnostic d’asthme au cours du suivi était associée aux niveaux de NOx durant la première année de vie et aux niveaux de NOx cumulés depuis la naissance. Aucune association de l’exposition postnatale aux NOx avec l’incidence du diagnostic de dermatite atopique ou de rhume des foins durant l’enfance n’a été trouvée.
Facteurs de vulnérabilité
Les infections respiratoires jouaient un rôle de facteur modificateur (pinteraction≤0,01) : ainsi, les associations entre l’incidence du diagnostic d’asthme entre 0 et 8/9 ans et les niveaux postnatals d’exposition aux NOx (durant la première année de vie et cumulés depuis la naissance) étaient observées chez les enfants ayant eu plusieurs infections précoces des voies respiratoires basses (HRa=1,38 ; IC95%: [1,16-1,64] et 1,31 [1,21-1,49], respectivement), mais pas chez les autres (0,95 [0,77-1,18] et 0,92 [0,77-1,10], respectivement).
Ces associations avec l’incidence du diagnostic d’asthme étaient modifiées par le sexe (pinteraction ≤0,01), retrouvées chez les garçons (1,37 [1,17-1,61] et 1,29 [1,19-1,64], respectivement), mais pas chez les filles (0,88 [0,65-1,20] et 0,87 [0,68-1,11], respectivement).
De plus, l’association entre les niveaux de NOx durant la première année de vie et l’incidence du diagnostic d’asthme entre 0 et 8-9 ans était significative chez les enfants avec des antécédents maternels d’asthme (1,39 [1,07-1,80]), mais pas chez ceux sans ces antécédents (1,16 [0,96-1,41]).
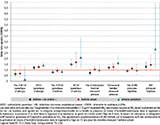
L’association entre l’exposition postnatale précoce à la PAA et la prévalence de l’asthme à l’âge de 13 ans, qu’il soit « vie entière », actuel ou persistant était aussi modifiée par les infections précoces répétées des voies respiratoires basses, par les antécédents parentaux d’allergie, notamment d’asthme et par un contexte familial stressant en début de vie (figure 6). En effet, comme à l’âge de 4 ans 8, les associations étaient renforcées chez les adolescents dont les parents avaient déclaré un évènement familial stressant précoce (figure 6). À 13 ans, le sexe n’était pas facteur modificateur.
 Agrandir l'image
Agrandir l'imageDiscussion-Conclusion
Ces travaux montrent que les niveaux d’exposition postnatale des enfants aux NOx au cours du suivi de la cohorte Paris ont nettement diminué, comme les niveaux de fonds dans l’agglomération parisienne (diminution moyenne de 44% des émissions en Île-de-France entre 2000 et 2012 (2)). Cette diminution est sans doute due à la limitation des émissions de NOx des véhicules neufs et aux mesures prises à Paris depuis le début des années 2000 : diminution de 23% entre 2004 et 2014 de la circulation dans Paris intra-muros, augmentation concomitante de la fréquentation annuelle des transports en commun, de la longueur des aménagements cyclables et du nombre de vélos dans Paris 9. De plus, au cours du suivi, 421 familles avaient quitté Paris pour s’installer en banlieue où les niveaux d’exposition sont moins forts, quand seulement 28 avaient fait le chemin inverse.
L’indice d’exposition à la pollution liée au trafic utilisé est un indice global qui reflète l’intensité de cette exposition dans son ensemble, comme lorsque l’on évalue l’exposition à la fumée de tabac environnementale, sans individualiser un polluant plus particulièrement. Nous avons choisi de l’exprimer en NOx car ces polluants sont de meilleurs traceurs de la source « trafic » que les particules : près de 60% des NOx sont émis par le trafic en Île-de-France alors que 35% seulement des PM2,5 sont issues du trafic (1). L’indice ExTra intègre les variations annuelles des concentrations de polluants et un grand soin a été apporté à la collecte prospective des données nécessaires à son calcul en considérant les principaux lieux de vie de l’enfant, qui généralement ne sont pas pris en compte par les auteurs 2,19. Par sa précision, l’indice ExTra est donc susceptible de réduire les erreurs de classement d’exposition.
Ces travaux apportent un éclairage nouveau en mettant en évidence des associations avec la PAA distinctes selon la fenêtre d’exposition et la maladie respiratoire/allergique considérées, et en pointant des sous-groupes de population plus vulnérables. L’exposition postnatale à la PAA, finement modélisée tout au long du suivi sur un large éventail de fenêtres d’exposition, est reliée aux maladies respiratoires allergiques durant l’enfance, alors que l’exposition prénatale ne l’est pas. Dans la littérature, cette dernière était nettement moins souvent étudiée, mais quelques auteurs rapportent son association avec l’asthme et la rhinite 2. Nous n’avons pu la modéliser par l’indice ExTra en raison de l’indisponibilité des données nécessaires à son calcul, en particulier concernant le lieu de travail de la mère pendant la grossesse. On ne peut exclure que son estimation par les seuls niveaux de fond de NOx soit insuffisante pour refléter les fortes variations spatiales, à petite échelle, des niveaux de NOx dans Paris et sa proche banlieue. Il pourrait en résulter une sous-estimation de l’association avec la morbidité.
Ni les symptômes évocateurs de dermatite atopique, ni l’incidence du diagnostic de dermatite atopique n’étaient associés à l’exposition à la PAA, qu’elle soit prénatale ou postnatale, conformément à la littérature, les rares études sur le sujet concluant généralement à l’absence d’association 2.
L’incidence de l’asthme diagnostiqué, ainsi que la présence et la persistance de sifflements tout au long du suivi étaient associées à l’exposition postnatale à la PAA, en particulier durant la première année de vie ou la période qui a précédé le diagnostic de l’asthme. Ces résultats sont cohérents avec ceux observés dans la cohorte néerlandaise Piama à 8 et 12 ans 10,11, dans deux études canadiennes jusqu’à 6 12 et 12 ans 13. En revanche, aucune association n’a été trouvée dans une méta-analyse 14, ni dans la cohorte norvégienne OBC 15, ni dans la cohorte suédoise Bamse au cours des 12 premières années de vie 16, peut-être en raison de niveaux de NOx relativement faibles dans les pays nordiques 17. Ces associations sont pourtant biologiquement plausibles car une exposition chronique élevée à la PAA durant la petite enfance, moment critique du développement pulmonaire 4 pourrait entraîner une atteinte suffisamment sévère des voies aériennes pour induire un remodelage de celles-ci, conduisant au développement d’un asthme 18.
Une autre explication possible à cette disparité de résultats est que tous les enfants ne présentent pas le même risque de développer l’asthme en lien avec l’exposition à la PAA. L’apport majeur de cette étude est la mise en lumière de facteurs de vulnérabilité. C’est chez les enfants ayant eu des bronchites ou des bronchiolites répétées que l’exposition postnatale à la PAA est associée à l’incidence de l’asthme, à la persistance de ses symptômes, tout comme elle l’était à une fonction respiratoire abaissée à 8-9 ans 19. L’effet de la pollution chimique liée au trafic routier se rajouterait aux lésions précoces engendrées par des agents biologiques sur les poumons encore immatures (inflammation, hyperperméabilité tissulaire) pour favoriser l’apparition d’un asthme chez l’enfant 20,21.
Le terrain allergique (antécédents familiaux) apparaît comme un autre facteur de vulnérabilité aux effets de la PAA postnatale précoce par rapport à l’incidence de l’asthme et à la persistance de ses symptômes, comme montré par la littérature chez les enfants avec un terrain atopique 2,8,19,21. Il est fait l’hypothèse que le déséquilibre de la balance Th1/Th2 induit par les polluants atmosphériques et stimulant la réponse immunitaire et l’inflammation au niveau des bronches, se produirait plus fréquemment chez ces enfants.
L’effet modificateur de la survenue précoce d’évènements familiaux stressants sur la relation entre l’exposition précoce à la PAA et l’incidence de l’asthme, sa prévalence à 13 ans et comme déjà démontré par l’équipe, sa prévalence à 4 ans 8 et la fonction respiratoire à 8/9 ans 19 est cohérent avec d’autres études qui suggèrent une susceptibilité à la PAA chez les enfants plus âgés exposés au stress 22,23. Un effet synergique entre stress et PAA est biologiquement plausible car un contexte stressant pourrait affecter la réponse immune et potentialiser les effets de la PAA par des mécanismes physiologiques analogues impliquant inflammation et stress oxydatif 24.
Quelques travaux épidémiologiques ont suggéré que l’exposition à la PAA était différemment associée à l’incidence de l’asthme et à la présence de sifflements selon le sexe de l’enfant, mais leurs résultats sont discordants 2,8,21. Dans notre étude, les associations entre l’incidence du diagnostic d’asthme et les niveaux de NOx postnatals n’étaient retrouvées que chez les garçons jusqu’à 8/9 ans, mais pas à 13 ans. Le calibre des voies respiratoires des garçons étant en moyenne plus petit que celui des voies respiratoires des filles durant la petite enfance 25, le remodelage de ces voies respiratoires engendré par les dommages causés par les polluants atmosphériques pourrait aboutir plus « facilement » à une hyperréactivité bronchique, donc à un asthme.
Enfin, l’exposition annuelle à la PAA est associée à la prévalence concomitante des symptômes évocateurs de rhinite allergique alors que ni l’exposition précoce, ni l’exposition cumulée à la PAA ne sont reliées au développement de ces symptômes ou du rhume des foins. Autant d’éléments qui plaident en faveur d’une exacerbation des symptômes de rhinite allergique par l’exposition à la PAA. Mais ces résultats méritent d’être confirmés, compte tenu des discordances de la littérature 2.
Au total, ces travaux suggèrent que l’exposition à la PAA est associée à la morbidité respiratoire allergique, mais en combinaison avec d’autres facteurs, qu’ils soient liés à l’environnement physique et à ses contaminants biologiques (virus, bactéries,…), à l’environnement psychosocial (stress) ou qu’ils soient génétiques (notion de terrain atopique). Ces résultats observés malgré la diminution régulière tout au long de l’étude des niveaux de PAA dans Paris et sa banlieue sont en accord avec les constats récents de Anenberg et al 26 qui concluent qu’en dépit d’améliorations dans plusieurs régions du monde, la pollution au NO2 continue d’être un important contributeur à l’incidence de l’asthme pédiatrique, en particulier dans les villes. Ils confirment l’intérêt pour les pouvoirs publics de poursuivre les efforts de réduction des niveaux de PAA dans l’agglomération parisienne.
Remerciements
Les auteurs expriment leur reconnaissance aux enfants et parents de la cohorte Paris et au personnel administratif (Dominique
Viguier, Marianne Bijou, Bruno Métivier, Chimène Yimier) pour son implication dans le suivi de la cohorte. Ils remercient
tous les médecins, infirmières et techniciens qui ont assuré les bilans de santé et les analyses biologiques (CPAM de Paris,
Pr Jocelyne Just, assistance publique hôpitaux de Paris (AP-HP) Trousseau, Pr Jacques de Blic, AP-HP Necker).
Cette recherche a bénéficié du soutien logistique de la Mairie de Paris (Direction de l’action sociale, de l’enfance et de
la santé, Service parisien de santé environnementale) et a été financée par l’Agence nationale de sécurité sanitaire de l’alimentation,
de l’environnement et du travail (Anses), dans le cadre des appels à proposition de recherche des Programmes nationaux de recherche
en environnement-santé-travail (PNREST) de 2009 et de 2015, par le programme européen MeDALL (Mechanisms of the development of allergy) (FP7-261357), par l’Agence de la transition écologique (Ademe) et par l’Agence nationale de la recherche (ANR – APR générique 2016).
Nicolas Bougas a bénéficié d’une bourse de thèse de doctorat financée par l’Ademe et Antoine Citerne, d’une allocation de
recherche de la région pour son master (DIM QI2 « Qualité de l’air, Impacts sanitaires, Innovations techniques et politiques »).
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.