Le dépistage universel de la surdité permanente bilatérale néonatale en France : évaluation de son déploiement
après deux
années de fonctionnement
// Universal screening for permanent neonatal bilateral deafness in France: Evaluation two years after national deployment
Résumé
Le programme national de dépistage de la surdité permanente bilatérale néonatale (SPBN) mis en place fin 2014 vise à repérer précocement les enfants déficients auditifs pour limiter les conséquences délétères de ce déficit. Notre objectif était d’évaluer le déploiement du programme à l’échelle nationale, deux années après son lancement.
Le programme comporte une phase de dépistage universel en maternité. Dans certaines régions, un test différé (Test3) est également réalisé après la sortie de la maternité. Les enfants suspects entrent ensuite dans une phase diagnostique. Les données agrégées régionales concernant les naissances 2015 et 2016 ont été utilisées pour calculer plusieurs indicateurs nationaux d’évaluation : taux d’exhaustivité, de refus, valeur prédictive positive (VPP), taux d’enfants suspects de SPBN, prévalence et répartition par sévérité.
Le taux d’exhaustivité a augmenté de manière significative entre 2015 et 2016 (83,3 vs 93,8% ; p<0,001), tandis que l’acceptation du dépistage était très bonne dès 2015 (refus : 0,1%). En 2016, le taux de suspects de SPBN diminuait de façon importante après le Test3 (1,4 vs 0,9%), tandis que la VPP augmentait (4,7 vs 7,6%). En 2015, la prévalence de la SPBN moyenne à profonde a été estimée à 0,9‰ (IC95% [0,8-1,0]) ; 57% des nouveau-nés avec un déficit >40 décibels ont une surdité moyenne, 17% sévère et 26% profonde.
L’objectif national de 90% d’exhaustivité après deux ans de fonctionnement du programme a été dépassé. Le Test3 apparaît utile pour désengorger les structures de diagnostic. L’amélioration de la remontée des données diagnostiques permettront de confirmer la prévalence et la distribution par sévérité de la surdité néonatale en France.
Abstract
The national permanent bilateral neonatal hearing loss (PBNHL) screening program set up in December 2014 aims to identify affected children early to allow appropriate care. Our goal was to evaluate the implementation of this program at the national level, two years after its launch.
The program includes a phase of universal screening in maternity wards. Depending on the region, a delayed test (Test3) can be performed after leaving the maternity. Children suspected during screening then enter in a diagnostic phase. Regional aggregated data on births in 2015 and 2016 were used for to calculate several national assessment indicators: completeness and refusal rate, positive predictive value (PPV), rate of PBNHL suspicious children, prevalence and distribution by severity of PBNHL.
The completeness rate increased significantly between 2015 and 2016 (83.3 vs 93.8%; p<0.001) while the acceptance of screening was very good from 2015 (refusal: 0.1%). The rate of suspicious PBNHL in 2016 decreased a lot after Test3 (1.4 vs 0.9%) while PPV increased (4.7 vs 7.6%). In 2015, prevalence of moderate to profound PBNHL was estimated at 0.9‰ (CI95% [0.8-1.0]); 57% of newborns with a >40 decibels deficit had moderate deafness, 17% severe and 26% profound.
The national target of 90% completeness after two years of operation of the program has been exceeded. The Test3 appears to be useful for reduce excess activity in diagnostic structures. Improvements in the reporting of diagnostic data are still necessary in order to confirm prevalence and severity’s repartition of neonatal hearing loss in France.
Introduction
La surdité permanente bilatérale néonatale (SPBN) est le déficit sensoriel congénital le plus fréquent en Europe 1. En 2007, une étude de la HAS rapportait que 800 nouveau-nés porteurs d’un déficit bilatéral auditif supérieur ou égal à 40 décibels (dB) naîtraient chaque année en France 2. Cette fréquence de la SPBN en fait une problématique importante de santé publique, tout comme ses conséquences sur l’enfant en l’absence d’intervention précoce lui permettant d’apprendre un langage dans les premiers mois de vie. Plusieurs travaux sur la plasticité cérébrale apportent des arguments physiologiques en faveur d’une prise en charge précoce de ces enfants 3,4. En effet, la reconnaissance tardive de ce déficit a des conséquences lourdes sur le langage, la voix, l’articulation et sur le développement socio-émotionnel et cognitif des enfants sourds 5,6,7.
Grâce aux évolutions technologiques de ces vingt dernières années, ce déficit peut désormais être dépisté dès les premiers jours de vie 2. C’est dans ce contexte de progrès technologiques et à la suite de plusieurs recommandations internationales 8,9,10,11 que la quasi-totalité des pays européens ont décidé de mettre en place un dépistage néonatal universel des troubles de l’audition. La finalité de ces programmes de dépistage est d’identifier précocement les enfants présentant un trouble de l’audition, afin d’accélérer leur diagnostic et adapter au mieux leur prise en charge.
En France, le programme de dépistage universel de la surdité a été lancé officiellement en novembre 2014, à la suite de la parution d’un cahier des charges national détaillant sa mise en œuvre 12. La cible fixée par le ministère de la Santé était d’atteindre 90% d’exhaustivité du dépistage à la fin des deux premières années de fonctionnement.
L’objectif de cette étude était donc : (i) d’évaluer sur le plan épidémiologique le déploiement du programme de dépistage universel de la surdité en France (taux d’exhaustivité, de refus, d’enfants suspects après la phase de dépistage, valeur prédictive positive (VPP) deux ans après son lancement (années 2015 et 2016) et (ii) d’estimer la prévalence et la répartition des sévérités de la surdité néonatale en France.
Méthode
Grandes lignes du programme de dépistage néonatal de l’audition
Il comporte deux phases 12.
La première, appelée ici phase de dépistage, consiste en une vérification de l’audition du nouveau-né en maternité (Test1 et si nécessaire Test2) par des méthodes objectives, rapides et non invasives : les oto-émissions acoustiques automatisées (OEAA) et/ou les potentiels évoqués auditifs automatisés (PEAA) 13,14 (figure 1). Bien que non précisé dans le programme, dans certaines régions un troisième test (appelé Test3) est réalisé dans le premier mois suivant la sortie de la maternité. Sa mise en œuvre est motivée notamment par le fait que les Tests1 et 2 à l’aide d’OEAA peuvent être faussés par l’éventuel reste de liquide amniotique persistant parfois quelques jours dans les conduits auditifs de l’enfant. Une maturation des voies auditives dans les semaines suivant l’accouchement peut également invalider les premiers tests utilisant les PEAA. Si le résultat des tests de dépistage est anormal, l’enfant suspect de surdité est adressé à un service d’audiologie infantile.
La seconde phase, appelée ici phase de diagnostic, permet de préciser les niveaux d’audition des enfants suspects et de diagnostiquer une éventuelle surdité (figure 1).
 Agrandir l'image
Agrandir l'imagePopulation et sources de données
Cette étude porte sur les enfants nés vivants dans chaque région en 2015 et 2016.
Elle s’appuie sur deux sources de données : d’une part, deux questionnaires permettant à chaque région de décrire les modalités pratiques de réalisation des dépistages et diagnostics de la surdité ; d’autre part, des données régionales agrégées permettant de calculer les indicateurs d’évaluation du dépistage et du diagnostic 15. Pour harmoniser le calcul de ces données agrégées, Santé publique France a élaboré, puis mis à disposition, une application informatique permettant à chaque région de les générer automatiquement à partir de données individuelles, préalablement recueillies à l’aide de logiciels dédiés (Néonat®, Voosurdité®) ou via un fichier Excel formaté par Santé publique France.
Indicateurs d’évaluation du dépistage et du diagnostic
Le tableau 1 présente les principaux indicateurs d’évaluation des phases de dépistage et de diagnostic de la surdité néonatale et leur définition. Ils ont été définis en concertation avec des acteurs institutionnels au sein des Agences régionales de santé (ARS), des cliniciens oto-rhino-laryngologistes (ORL), des représentants des coordonnateurs régionaux du dépistage/diagnostic et de Santé publique France.
 Agrandir l'image
Agrandir l'imageDonnées transmises par les régions
La fin du recueil de données pour cette étude a été fixée au 31/12/2017. Au final, sur les 27 régions françaises (1), 21 régions ont transmis des données en 2015 et 24 en 2016.
Des hypothèses ont dû être faites pour calculer les taux annuels d’exhaustivité dans les régions n’ayant pas transmis de données en 2015 et/ou 2016 alors qu’elles avaient déjà démarré le programme de dépistage de la surdité 15. Le calcul des VPP et des prévalences de la surdité a été effectué en posant l’hypothèse que tous les enfants suspects de SPBN avaient le même risque d’être diagnostiqués SPBN en cas de données diagnostiques manquantes.
Analyses statistiques
Les pourcentages ont été calculés en rapportant les effectifs transmis par les régions au nombre d’enfants nés vivants enregistrés par l’Institut national de la statistique et des études économiques (Insee) pour une année donnée dans chacune des régions. Les pourcentages et taux ont ensuite été comparés avec un test d’indépendance du Chi2 de Pearson ou un test exact de Fisher avec un seuil de significativité fixé à 5%. La VPP correspond au nombre d’enfants atteints de SPBN moyens à profonds rapporté à ceux suspects de surdité à l’issue de la phase de dépistage. Les analyses statistiques ont été menées sur le logiciel Stata® version 14.2 (Stata Corp., College Station, TX, USA).
Résultats
Déploiement du programme de dépistage en région
Au 31 décembre 2017, sur la base des informations transmises, toutes les régions, sauf la région Poitou-Charentes, avaient démarré le programme de dépistage. Il existait une hétérogénéité régionale, liée à l’interprétation du cahier des charges national. Le tableau 2 détaille les différences régionales observées : nature des surdités dépistées (uni/bilatérales ou bilatérales uniquement), nombre d’étapes de la phase de dépistage (ajout éventuel d’un Test3), nature des surdités dépistées prises en charge (uni- ou bilatérale) dans la phase diagnostique, type d’opérateurs impliqués dans la coordination des phases de dépistage/diagnostic et logiciels utilisés pour la collecte des données individuelles.
(situation en 2016)
 Agrandir l'image
Agrandir l'imageDéploiement du programme de dépistage de la surdité en France
Taux d’exhaustivité
Le nombre d’enfants nés vivants en France et bénéficiant effectivement du programme de dépistage de la surdité avait augmenté de façon significative entre 2015 et 2016, passant respectivement de 83,3% à 93,8% (p<0,001). Sur les 27 régions françaises, 14 puis 21 d’entre elles avaient dépassé l’objectif de 90% d’exhaustivité du dépistage en 2015, puis 2016 respectivement (figure 2).
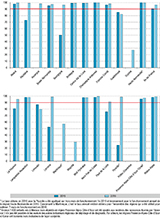 Agrandir l'image
Agrandir l'imageTaux de refus du dépistage
Au niveau national, 0,1% des familles avaient refusé de participer au dépistage en 2015 et 2016 (soit 862 et 852 enfants). Dans six régions, ce taux était doublé (Rhône-Alpes, Bretagne, Auvergne, Midi-Pyrénées) voire triplé (Guadeloupe, Centre-Val de Loire).
Taux d’enfants suspects de SPBN après les tests de dépistage
Le taux d’enfants suspects de SPBN à la sortie de l’établissement de naissance (après Test1 et éventuel Test2) variait selon la région (allant de 0,2 à 2,7%). À l’échelle nationale, il était de 1,4% en 2015 comme en 2016 (p=0,06) et n’était pas significativement différent selon la stratégie de repérage choisie par les régions en 2016 (uni/bilatérale ou bilatérale uniquement) (tableau 3 ; p=0,3).
Après la phase de dépistage (incluant les tests en maternité et éventuellement un Test3 selon les régions), le taux national d’enfants suspects de SPBN en 2016 passait de 1,4 à 0,9%. Cette diminution était observée quelle que soit la stratégie de repérage choisie par les régions, mais était plus marquée dans les régions repérant uniquement les surdités bilatérales (taux de suspects passe de 1,4 à 0,7%) (tableau 3). Globalement, le taux de SPBN après la phase de dépistage s’avérait significativement plus élevé dans les régions qui dépistaient les surdités uni/bilatérales comparé à celles qui repéraient uniquement les surdités bilatérales (1,1 vs 0,7% ; p<0,001).
 Agrandir l'image
Agrandir l'imageValeurs prédictives positives
Les VPP après les dépistages en maternité étaient de 7,1% en 2015 et 4,7% en 2016.
Si l’on intègre les éventuels Test3 dans la phase de dépistage, les VPP devenaient plus élevées : 11,7% en 2015 et 7,6% en 2016 (tableau 3).
Phase de diagnostic : prévalence et sévérité de la surdité
Entrée dans la phase de diagnostic
La proportion d’enfants suspects de SPBN après la phase de dépistage et ayant bénéficié d’une consultation pour un diagnostic de surdité était de 62% en 2016 (51,5% en 2015), variable selon la région considérée (de 12,8 à 100% en 2016). Ainsi, en 2016, huit régions rapportaient des taux d’entrée des enfants suspects de SPBN dans la phase de diagnostic inférieurs à 50% : Franche-Comté, Bourgogne, Provence-Alpes-Côte d’Azur-Corse, Basse-Normandie, Île-de-France, La Réunion, Auvergne, Champagne-Ardenne.
Prévalence de la surdité
La prévalence de la surdité bilatérale légère à profonde a été estimée à 1,3‰ naissances ayant bénéficié du dépistage sur l’année 2015 (min-max : 0,7-2,8‰ ; IC95 [1,2-1,4]). Celle de la surdité bilatérale moyenne à profonde était de 0,9‰ naissances ayant bénéficié du dépistage en 2015 (min-max : 0,5-1,6‰, IC95 [0,8-1,0]) (tableau 3).
Répartition par sévérité des surdités >40 dB
La répartition des surdités bilatérales selon le degré de perte auditive montre qu’une majorité d’enfants atteints de SPBN moyenne à profonde avaient une atteinte auditive dite moyenne (57% des enfants en 2015 IC95% [50-62] et 55% en 2016 IC95% [49-61]). La proportion de surdités sévères ou profondes était respectivement de 17% et 27% en 2015 ; 20% et 25% en 2016 (tableau 4).
Discussion
Après deux années de fonctionnement du programme, le taux d’exhaustivité du dépistage était de 93,8%, au-delà de la cible de 90% fixée par l’Arrêté 12. L’acceptation du programme par les parents était très bonne (taux de refus initial de 0,1%). Après la phase de dépistage, 0,9% des nouveau-nés sont suspects de SPBN, ce qui représente environ 8 000 enfants chaque année. Sur la base des données transmises, la prévalence annuelle de la surdité permanente bilatérale néonatale a été estimée à 1,3‰ (légère à profonde) et 0,9‰ (moyenne à profonde) en 2015.
Bien que l’exhaustivité du dépistage en France soit élevée (93,8%), elle s’avère inférieure à celle observée dans d’autres pays ayant mis en place le même type de programme (97,8% aux États-Unis en 2017 16, 98,4% en Pologne en 2016 17 et 99,3% en Italie en 2011 18). Néanmoins, dans ces trois pays, ces chiffres ont été obtenus après plus de 10 ans de fonctionnement (jusqu’à 37 ans aux États-Unis). En Belgique, au bout de 5 années de fonctionnement, le taux d’exhaustivité du dépistage était de 91,7% en 2012 19, soit un taux comparable à celui de la France. La marge d’amélioration en France porte probablement sur la montée en charge progressive des maternités dans certaines régions et sur la réduction de l’échappement au test des enfants nés à domicile ou transférés vers un service de néonatalogie, réanimation néonatale ou pédiatrie. En effet, la cellule de Santé publique France en région Bretagne a montré que le taux d’échappement des enfants bretons transférés en 2016 était de 1,9% soit un taux environ 4 fois plus élevé que pour l’ensemble des enfants éligibles au dépistage dans la région (0,5%) 20.
Le taux de refus (0,1%) était très faible en 2015 comme en 2016, mais cependant bien supérieur à celui observé pour les dépistages biologiques néonataux (0,3‰ en 2017 et 2018) mis en place depuis 1972 21. En revanche, il était deux fois moins élevé que celui observé en Belgique (0,2%) après 5 années de fonctionnement 19. Quelques régions françaises ont un taux deux à trois fois plus élevé que la moyenne nationale. Des études qualitatives pourraient être réalisées dans ces régions pour mieux comprendre ces différences et surveiller les tendances de ces taux de refus.
Nous avons montré que le Test3 réalisé dans le mois suivant la sortie de la maternité avait pour intérêt de désengorger les structures de diagnostic en réduisant le taux d’enfants suspects de surdité bilatérale (passant de 1,4 à 0,9% après le Test3). Cependant, cette diminution est moins marquée dans les régions détectant les surdités unilatérales et bilatérales comparativement aux régions repérant uniquement les surdités bilatérales. Cette différence pourrait s’expliquer par le fait que le Test3 aurait deux effets contraires : d’une part, diminuer le nombre d’enfants suspects de surdité bilatérale et, d’autre part, dans les régions qui repèrent les surdités unilatérales, il augmenterait aussi les chances de repérer des surdités bilatérales considérées après le Test2 comme unilatérale.
La variabilité régionale des taux de nouveau-nés suspects de SPBN est à étudier pour en connaitre l’origine exacte. Elle est probablement liée en grande partie au manque d’homogénéité entre les régions dans la réalisation du programme de dépistage.
Lorsqu’un nouveau-né est jugé suspect de surdité après la phase de dépistage, il entre alors dans la phase de diagnostic. En 2015-2016, la qualité des données permettant d’estimer les indicateurs d’évaluation de la phase de diagnostic demandait clairement à être améliorée. En effet, d’après les données disponibles en 2015, seul un enfant sur deux avait des consultations de diagnostic documentées et un peu moins de deux enfants sur trois en 2016. Or, selon les ORL et les coordinateurs régionaux du dépistage, ces chiffres seraient certainement sous-estimés en raison d’un manque de transmission systématique des données de diagnostic. Des leviers doivent donc être identifiés pour faciliter la transmission, soutenir l’engagement et la motivation des ORL à remonter leurs données et ainsi améliorer la qualité de ces indicateurs. Cette amélioration des données collectées permettrait d’évaluer l’utilité du programme en termes d’âge à la prise en charge (âge de la première consultation de diagnostic), au diagnostic ou à l’appareillage des enfants sourds. Les données d’autres programmes européens montrent des problèmes similaires (Belgique avec 62,2% des enfants suspects vus en consultation de suivi) 19.
Du fait du taux important de données manquantes ou incomplètes concernant la phase de diagnostic, le taux d’enfants suspects de SPBN entrant dans la phase diagnostique (et sa variabilité régionale), les estimations de la VPP du dépistage et des prévalences de la surdité en France, ainsi que sa répartition par sévérité de l’atteinte auditive, doivent être considérées avec prudence malgré les corrections apportées pour prendre en compte les données manquantes. La VPP du dépistage de la surdité est renforcée après l’ajout du Test3 mais reste faible. Ceci signifie que près de 90% des enfants suspects après les tests s’avèrent entendre normalement. Cependant, les conditions dans lesquelles les oto-émissions acoustiques sont recueillies sont parfois difficiles à réunir (enfant endormi, calme) et la maturation des voies auditives est peut-être toujours en cours au moment des tests ce qui pourrait expliquer ce chiffre. De plus, pour mieux quantifier cette VPP, il faudrait pouvoir tenir compte de l’appareillage utilisé dans les différentes régions car les PEAA sont plus sensibles que les OEAA (VPP de 27,3% vs 8,2% selon le rapport de l’Institut national de la santé et de la recherche médicale – Inserm – paru en 2004).
La prévalence de la surdité permanente bilatérale néonatale légère à profonde a été estimée dans notre étude à 1,3‰ (IC95% [1,2-1,4]) et celle de la surdité moyenne à profonde à 0,9‰ en 2015 (IC95% [0,8-1,0]). Bien que la comparaison entre les régions françaises, et a fortiori entre les différents pays, soit difficile du fait de modes de fonctionnements hétérogènes, ces prévalences s’avèrent similaires ou légèrement plus faibles que dans les autres pays/régions. Selon l’Inserm, les prévalences de la surdité moyenne à profonde en Europe et aux États-Unis seraient comprises entre 1,1 à 1,3‰ naissances vivantes 1. En 2007, la HAS avait conclu qu’au moins 1‰ nouveau-né serait atteint de surdité moyenne à profonde par an en France 2. En région Rhône-Alpes et Champagne-Ardenne, le taux de surdité bilatérale néonatale moyenne à profonde était respectivement de 1,2‰ en 2016 et 0,8‰ en 2006 22,23.
Les degrés d’atteinte de la surdité bilatérale se répartissent de façon comparables à ce qui a été observé au Royaume-Uni en 2002 : 53% des surdités bilatérales >40 dB sont moyennes, 21% sévères et 25% profondes 24.
Le dépistage universel de la surdité néonatale a été efficacement mis en œuvre en France au regard des objectifs nationaux. Homogénéiser les pratiques du dépistage dans toutes les régions (ajout du Test3 et repérage des surdités unilatérales pouvant devenir secondairement bilatérales) et de diagnostic (suivi proactif des surdités bi/unilatérales) et améliorer la remontée des données de la phase diagnostique restent des cibles à atteindre à l’issue des deux premières années de fonctionnement du programme. En effet, sans amélioration de l’exhaustivité et de la qualité des données diagnostiques remontées, il ne sera pas possible d’évaluer l’impact réel de ce programme notamment sur la baisse de l’âge au diagnostic et à la mise en œuvre de l’intervention – quelle qu’elle soit – permettant à l’enfant d’apprendre un langage.
Remerciements
Les auteurs remercient Virginie Da Costa, Céline Koscielniak, Véronique Bocquet et Vanessa Murgia en tant que coordinatrices du dépistage des régions Bretagne, Nord-Pas-de-Calais, Lorraine et Midi-Pyrénées respectivement, pour leur aide dans la mise au point de l’application informatique dédiée à la remontée des données du programme de dépistage de la surdité. Ils remercient également les docteurs Thierry Cardoso, Françoise Denoyelle, Marie-Françoise Merlin-Bernard, Emmanuel Nallet, Michel Roussey, Hung Thaï Van, le Pr Stéphane Roman, Catherine Dubeau, Dominique Foissin, Céline Koscielniak, Yann Le Strat et Vanessa Murgia pour leur relecture du rapport dont cet article est une synthèse.
Lien d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.
Références
inserm.fr/handle/10608/144
fr/evaluation-du-depistage-neonatal-systematique-de-la-surdite-permanente-bilaterale
2018/27/2018_27_3.html





