Mise en œuvre du dépistage néonatal de la surdité en Rhône-Alpes. État des lieux 2016 et 1er semestre 2017
// Universal newborn hearing screening in Rhône-Alpes region (France). Assessment of the program in 2016 and first half of 2017
Résumé
Introduction –
Le dépistage néonatal de la surdité (DNS) a débuté en tant que programme de santé en 2015 en Rhône-Alpes, avec l’objectif de dépister les surdités uni et bilatérales. Après test (T1) et retest (T2) en maternité, l’étape diagnostique était concentrée dans un nombre limité de centres. Un test différé préalable (T3) était proposé avant 1 mois. Les objectifs de l’étude étaient d’évaluer la mise en œuvre du programme et l’impact du T3.
Matériels et méthodes –
L’étude rétrospective observationnelle s’appuyait sur les données transmises en routine à l’organisme régional en charge du dépistage néonatal par les maternités et les centres experts.
Résultats –
Toutes les maternités et unités de néonatologie de Rhône-Alpes proposaient le DNS, 47/51 maternités utilisaient les techniques recommandées. L’exhaustivité atteignait 99,7% parmi les nouveau-nés légalement éligibles (hors les 0,2% de refus parentaux). Un T2 était nécessaire pour 10,2% des enfants, et il était suivi d’un T3 pour 31,3% des T2 anormaux ; 88,6% des T3 étaient déclarés normaux. Enfin, 2,2% des nouveau-nés étaient adressés en centre diagnostic pour test non concluant uni ou bilatéral.
Les issues à 6 mois montraient, pour 2016, un taux de surdité global à 1,7‰ (4,7‰ chez les nouveau-nés transférés) et de surdité bilatérale à 1,2‰. Parmi les enfants avec retests anormaux 7,7% étaient perdus de vue.
Dans le réseau recourant largement au T3, 0,6% des enfants étaient adressés en centre de diagnostic, soit 4 enfants adressés pour 1 sourd, versus 17 (p<0,001) pour le reste de la région en 2016.
Conclusion –
En Rhône-Alpes les objectifs nationaux et régionaux de couverture du DNS sont largement dépassés. Limiter les perdus de vue reste essentiel.
La répétition d’un test automatisé vers 2-4 semaines de vie améliore le dépistage et limite considérablement l’adressage en centre expert sans augmenter les perdus de vue.
Le DNS est un processus complexe (parcours, acteurs, évaluation). Les perspectives du réseau sont de confronter les expériences et de solliciter les retours des parents.
Abstract
Introduction –
Universal newborn hearing screening (UNHS) started officially in 2015 in the Rhône-Alpes region (France), with a goal of screening for uni and bilateral deafness. After test (T1) and retest (T2) in maternity, diagnosis was possible only in a limited number of centres. A preliminary delayed test (T3) was then offered locally around 2-4 weeks. The study aimed at assessing the implementation of the UNHS programme in Rhône-Alpes and the impact of a T3.
Materials and methods –
The retrospective and observational study was based on routine data from the regional structure in charge of neonatal screening and diagnosis centres.
Results –
All maternities and neonatal units of Rhône-Alpes performed UNHS, 47/51 maternity units used the recommended techniques. Exhaustivity reached 99.7% among legally eligible newborns (except 0.2% of parental refusals. A retest (T2) was necessary for 10.2% of babies, followed by a T3 for 31.3% of abnormal T2: 88.6% of T3 were normal. 2.2% of new-borns were referred to specialist centres for diagnosis due to a uni or bilateral non conclusive test.
Outcomes at 6 months (2016) showed for 2016, a global deafness rate of 1.7‰ (4.7‰ among referred newborns), a bilateral deafness of 1.2‰. Among babies with abnormal retests, 7.7% were lost to follow-up.
Inside the perinatal network which widely resorted to a T3, 0.6% babies were referred to a diagnosis centre, i.e. 4 babies referred for 1 deaf, versus 17 for the remaining RA centres (2016, p<0.001).
Conclusion –
In Rhône-Alpes, the regional and national goals of UNHS coverage are far exceeded. Limitation of babies lost to follow-up remains essential.
The duplication of an automated check around 2-4 weeks improves the screening and widely limits the referral to expert centres without increasing the number of lost to follow-up. UNHS is a complex process (pathways, actors, assessment). The network prospects are to compare experiences and seek parental feedback.
Introduction
Le dépistage de la surdité permanente néonatale bilatérale (DNS) a pour objectif la prise en charge précoce de la surdité, dont le bénéfice est établi en termes d’acquisition du langage et de développement des capacités de communication 1. En France, le DNS constitue un programme de santé publique institué par arrêté en 2012, financé depuis 2013. Sa mise en œuvre est confiée aux Agences régionales de santé (ARS) pour un déploiement sur l’ensemble du territoire. L’arrêté du 3 novembre 2014 en définit les modalités : cahier des charges national, organisation par les ARS. Le DNS repose sur des méthodes validées, rapides et non invasives : les potentiels évoqués acoustiques automatisés (PEAA) et les otoémissions acoustiques (OEA), qui permettent le repérage des surdités moyennes à profondes. Ce dépistage doit être réalisé à la naissance avant la sortie de l’établissement de santé, après accord parental, avec un objectif national d’exhaustivité à la fin des deux premières années fixé à 90% 2.
En concertation avec les acteurs, le programme s’est appuyé en Rhône-Alpes sur un cahier des charges régional, définissant les rôles des acteurs, les parcours patients et imposant le DNS dans tous les établissements au plus tard fin 2015. L’organisme déjà responsable des dépistages néonataux biologiques, l’Union régionale pour la prévention des handicaps de l’enfant (URPHE), était chargé de la traçabilité. La formation et la diffusion des procédures étaient confiées aux réseaux de périnatalité. L’étape diagnostique, après deux tests non concluants avant la sortie (T1 et T2) était réservée à un nombre limité de centres experts de l’audition de l’enfant.
Antérieure au cahier des charges national, la procédure régionale (2014) en différait par l’objectif de dépister également les surdités unilatérales et la recommandation de la méthode PEAA pour les tests, puis secondairement, par l’introduction du test différé après la sortie (T3).
En effet, devant la saturation rapide des centres experts et pour limiter les déplacements des familles, certaines maternités du Réseau périnatal des 2 Savoie (RP2S) ont initié dès 2015 la répétition d’un troisième test automatisé (T3) par PEAA, différé après la sortie, entre 2 et 4 semaines de vie. La pratique du T3 s’est rapidement diffusée dans ce réseau. Après concertation, cette procédure, absente du cahier des charges national, était recommandée sur le plan régional en juillet 2016 (révision du cahier des charges) en cas de T2 non concluant unilatéral.
Les objectifs régionaux du programme étaient les suivants :
–proposition du dépistage à l’ensemble des nouveau-nés quel que soit leur lieu de naissance, et exhaustivité de 98% fin 2017 ;
–taux de perdus de vue après adressage en centre expert à moins de 7% fin 2017.
Deux ans après l’introduction de ce programme de santé publique en Rhône-Alpes, l’article a pour objectifs : i/ d’évaluer, au regard des objectifs nationaux et régionaux, la mise en œuvre du DNS en Rhône-Alpes sur la période 2016 et 1er semestre 2017 ; ii/ d’en présenter les principaux indicateurs (dont le taux de surdité de degré moyen à profond) ; iii/ d’évaluer l’impact éventuel de la procédure comprenant le T3.
Matériels et méthode
Après accord des différents partenaires régionaux (réseaux de périnatalité, centres experts, URPHE) une étude multicentrique, rétrospective, observationnelle a inclus toutes les naissances vivantes survenues en Rhône-Alpes durant la période choisie.
Les données tracées sur les supports prévus (cartons-buvards des tests sanguins, fiches de refus parental, d’adressage en centre expert et d’issue à 6 mois), saisies en routine par l’URPHE, ont été extraites en novembre 2017. Ces données concernaient : l’année de naissance ; le transfert à la naissance (DNS effectué hors maternité de naissance) ; le refus éventuel du DNS ; la réalisation et le résultat du premier test (T1) et, le cas échéant, du retest (T2) et du T3 ; l’adressage ou non en centre expert ; l’âge à la première consultation en centre expert ; les informations à l’issue de l’étape diagnostique (dans un délai de 6 mois fixé par le cahier des charges régional) pour les enfants nés en 2016.
Les enfants transférés incluaient les enfants nés prématurément, pour lesquels les étapes du DNS s’effectuent en tenant compte de l’âge corrigé. L’âge gestationnel n’étant pas tracé, les données concernant l’âge au premier rendez-vous en centre expert n’ont pas été considérées pour ces enfants.
Les réseaux de naissance (RP2S ou non) étaient pris en compte, afin d’examiner les indicateurs pouvant être liés à la différence de pratique du T3.
Le critère de jugement principal était l’atteinte des objectifs nationaux et régionaux d’exhaustivité et de perdus de vue, soit respectivement 90%, 98% et 7%. Pour l’impact du T3, les critères de jugement étaient le taux d’adressage en centre expert et le nombre d’enfants à référer pour diagnostiquer un enfant sourd.
L’homogénéité des distributions observées pour les caractères qualitatifs était testée au moyen du test Chi2 et du test exact de Fisher. Le seuil de significativité a été choisi à 0,05.
Résultats
Population, exhaustivité
Toutes les maternités et les unités de néonatologie de Rhône-Alpes participaient au DNS. T1 et T2 étaient effectués avec la séquence PEAA/PEAA pour 40 maternités, OEA/PEAA pour 7 et OEAA/OEAA pour 4. Les unités de néonatologie utilisaient exclusivement les PEAA.
Durant la période d’étude, 115 674 enfants sont nés vivants en Rhône-Alpes et non décédés avant la sortie (78 261 en 2016 et 37 413 au 1er semestre 2017).
Parmi les nouveau-nés éligibles, l’exhaustivité (au moins un résultat de DNS tracé) était de 99,5%. Un refus parental était signalé pour 0,2% des enfants et 99,7% des nouveau-nés légalement éligibles (hors refus) étaient dépistés.
Parcours
Les parcours du DNS en Rhône-Alpes sont schématisés sur la figure 1, et la figure 2 résume le diagramme de flux pour l’année 2016.
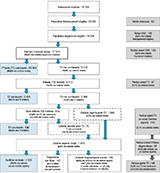 Agrandir l'image
Agrandir l'imagePrincipaux indicateurs parmi les enfants ayant bénéficié du DNS
Les tests étaient normaux d’emblée pour 89,7% des nouveau-nés. Un T2 a été pratiqué pour 10,2% des nouveau-nés, et déclaré normal dans 68,7% des cas. Parmi les nouveau-nés avec T2 anormaux, 31,3% ont bénéficié d’un T3, normal chez 88,6%.
À l’issue des tests et éventuels T3, 2,2% des enfants étaient adressés en centre expert pour doute uni ou bilatéral. Pour les enfants non transférés à la naissance, l’âge médian au premier rendez-vous était, en 2016, de 39 jours et 75% de ces rendez-vous avaient lieu avant 53 jours.
Les données sur les issues n’étaient complètes que pour les enfants nés en 2016. Rapporté à la population des enfants dépistés, à 6 mois de vie ou d’âge corrigé, le taux global de surdité (uni et bilatérale) moyenne à profonde était de 1,7‰ ; le taux de surdité bilatérale était de 1,2‰.
Un diagnostic de surdité moyenne à profonde a été posé chez 6,9% des enfants adressés en centre expert en 2016 (4,8% pour atteinte bilatérale).
Pour 2016, les perdus de vue aux différentes étapes du DNS représentaient 0,4% des nouveau-nés testés. Ils représentaient 0,6% des nouveau-nés légalement éligibles. Parmi les enfants avec dépistage positif (T2 non concluant), 7,7% étaient perdus avant la fin de l’étape diagnostique : avant l’arrivée en centre expert ou en cours d’étape diagnostique.
Dynamique des indicateurs entre 2016 et 2017
L’évolution des indicateurs entre 2016 et le premier semestre 2017 figure dans le tableau 1.
L’exhaustivité a baissé entre 2016 et 2017 dans la population légalement éligible, passant de 99,8% en 2016 à 99,7% en 2017 (p<0,05). Elle était stable parmi les enfants non transférés à la naissance (99,9%).
Sur l’ensemble de la population, la pratique du T3 est passée de 23,8% à 48,6% des retests anormaux (p<0,001) et le recours au centre expert a diminué : 1,6% des enfants dépistés en 2017 (p<0,001).
 Agrandir l'image
Agrandir l'imageExpérience dans le réseau périnatal RP2S versus le reste de la région
En 2016, 15 706 des 77 913 enfants dépistés sont nés dans les maternités du réseau RP2S (20,2%). Dans cette population, plusieurs indicateurs différaient significativement par rapport aux enfants nés dans le reste de la région.
Le T3 était pratiqué dans le RP2S chez 75,8% des enfants avec T2 anormal versus 14,9% dans le reste de la région (p<0,001). Le taux d’enfants adressés en centre expert était de 0,6% dans le RP2S, versus 2,9% ailleurs (p<0,001).
Dans le RP2S, en moyenne 4 enfants étaient adressés en centre expert pour 1 enfant diagnostiqué sourd, versus 17 dans le reste de la région (p<0,001).
Le taux de perdus en cours de dépistage ne différait pas significativement : 0,4% dans le RP2S comme dans le reste de la région.
Les taux de surdité parmi les enfants dépistés n’étaient pas significativement différents entre les enfants nés dans le RP2S versus le reste de la région : taux de surdité global 1,4‰ dans le RP2S versus 1,8‰ ; surdité bilatérale 0,8‰ versus 1,3‰.
Focus sur les enfants transférés à la naissance
Parmi les enfants dépistés, 9 480 (8,2%) avaient été transférés à la naissance, 6 184 en 2016 (7,9%) et 3 296 en 2017 (8,8%, p<0,001). Certains indicateurs différaient significativement dans le groupe des enfants transférés (tableau 2). Le taux de refus parentaux était significativement plus élevé, l’exhaustivité du dépistage plus faible et les taux de perdus de vue plus élevés dans le groupe des enfants transférés. Les taux de surdité étaient plus élevés dans ce groupe, avec 4,0‰ de surdités bilatérales (de degré moyen à profond) versus 0,9‰ chez les enfants non transférés.
 Agrandir l'image
Agrandir l'imageLa dynamique des indicateurs entre 2016 et 2017 pour les enfants transférés montrait :
–une baisse significative du taux refus (p<0,05) ;
–une augmentation significative des enfants perdus avant DNS (p<0,05) ;
–une baisse significative des enfants testés perdus avant l’étape diagnostique (p<0,05).
Discussion
L’Enquête nationale périnatale informe que seules deux maternités ne pratiquaient pas le DNS en France en 2016 3, mais les indicateurs nationaux ne sont pas disponibles. Notre travail apporte des résultats sur les pratiques tracées sur 18 mois concernant plus de 115 000 nouveau-nés, dans un territoire assurant environ 10% des naissances françaises.
Le programme établi en Rhône-Alpes a évolué en partenariat avec les acteurs. La plupart des maternités utilisent les techniques recommandées avec PEAA. Les objectifs d’exhaustivité nationaux et régionaux sont amplement dépassés.
Le DNS est largement accepté. Le taux de refus, de 0,2%, est cependant très supérieur à celui des dépistages biologiques néonataux (0,4‰ en 2016) 4.
Nos résultats d’exhaustivité (99,5% de couverture des enfants vivants et 99,7% sur la population légalement éligible) sont supérieurs aux données américaines 5 et comparables à ceux de Haute-Normandie (99,8%) 6. En Italie, l’exhaustivité du dépistage (premier test réalisé) était de 99,3% en 2011 dans les maternités publiques des sept régions où une loi régionale de santé prescrit ou encourage le DNS 7. En Pologne entre 2003 et 2015, le dépistage a concerné 96% des nouveau-nés 8.
Dans notre série, nous observons une exhaustivité significativement plus faible parmi les enfants transférés à la naissance, restant néanmoins supérieure à 97%. La diminution de l’exhaustivité globale en 2017 est liée à la fois à une exhaustivité moindre parmi les enfants transférés et à un taux de transfert supérieur. Les parcours complexes de ces enfants entre plusieurs centres, les décalages en âge corrigé pour les prématurés et les pathologies concomitantes pourraient être des freins au DNS. Il est également vraisemblable que la traçabilité (décalée par rapport aux dépistages biologiques) soit moins systématique pour ces enfants. La marge d’amélioration de la couverture du DNS en Rhône-Alpes porte donc essentiellement sur les enfants transférés à la naissance, à plus haut risque de surdité, parmi lesquels on retrouve à la fois le plus de refus et de perdus avant dépistage.
S’il n’est pas concluant, le test de dépistage doit être répété avant la sortie. En Rhône-Alpes, le T1 est concluant dans environ 90% des cas et le T2 dans 69%. La volonté d’adresser tous les enfants suspectés de surdité en centre spécialisé a abouti à la création des centres experts, qui ont rapidement été saturés.
Absente du cahier des charges national, et issue de l’initiative de maternités (notamment du réseau périnatal RP2S), l’introduction d’un 3e test automatisé à distance de la sortie avait pour but de limiter fortement le recours en centre expert. Effectué dans un délai de 4 semaines après la naissance, au plus près du domicile des parents, ce T3 permet dans 9 cas sur 10 la confirmation d’une audition normale. Un contrôle différé à 2-4 semaines de vie (PEAA en ORL) était, en 2015, rapporté comme performant par l’équipe de Haute-Normandie, sur une cohorte de plus de 100 000 nouveau-nés dépistés entre 1999 et 2011 5. Une étude de 2018 relate l’expérience d’une maternité italienne sur 2 ans de DNS et près de 5 000 naissances, avec un protocole prévoyant OEA en T1 et T2 pour les nouveau-nés à bas risque, suivi d’un T3 par PEAA en cas d’échec. Ce PEAA est normal dans 86% des cas 9. Plusieurs facteurs peuvent contribuer à la normalisation des tests à distance de la naissance, notamment la meilleure aération de l’oreille externe et moyenne ainsi que la maturation des voies auditives.
En dépit des difficultés organisationnelles pour les maternités et de l’absence de cotation, la pratique du T3 (en cas de T2 non concluant), s’élevait à 75,8% dans les maternités du RP2S et a doublé pour l’ensemble de la région entre 2016 (23,8%) et 2017 (48,6%).
Rajoutant une étape dans les parcours, le T3 pourrait faire courir le risque d’augmenter les perdus de vue. Nous retrouvons un taux d’enfants perdus de vue en cours de dépistage (ou sans résultats documentés) à 0,4%, identique dans le RP2S et le reste de la région. Les taux de surdité (uni et bilatérale, de degré moyen à profond) parmi les enfants dépistés, 1,4‰ dans le RP2S versus 1,8‰, n’étaient pas significativement différents.
À l’issue du DNS, 2,2% des enfants de Rhône-Alpes étaient adressés en centre expert. Ce taux avait significativement baissé entre 2016 et 2017 (2,5% versus 1,6%), et était significativement plus bas (0,6%) dans le réseau utilisant largement le T3. Aux États-Unis, les Centers for Disease Control and Prevention rapportent un taux de 1,6% d’enfants ayant échoué au dépistage initial 5. En Haute-Normandie, le taux d’adressage après tests en maternité ou néonatologie était de 1,7%, et baissait à 0,2% après l’étape supplémentaire du PEAA différé 6. Outre l’impact du T3, il est vraisemblable que les résultats s’améliorent en Rhône-Alpes avec l’expérience accrue des professionnels de maternité et néonatologie, conduisant à ne pas « brûler les cartouches » et à n’effectuer les tests que dans de bonnes conditions (nouveau-né et environnement).
Rapporté aux enfants dépistés nés en 2016, le taux de surdité global de degré moyen à profond (uni et bilatérale) en Rhône-Alpes était de 1,7‰ à 6 mois de vie ou âge corrigé. Le taux de surdité bilatérale était de 1,2‰. Ces données diffèrent peu des résultats nord-américains (1,6‰ des enfants testés en 2014 5) et de Haute-Normandie (1,4‰ pour surdités bilatérales) 6. Si notre étude ne prenait pas en compte spécifiquement les facteurs de risque de surdité, nous avons retrouvé sans surprise des taux plus élevés parmi les enfants transférés à la naissance, avec 4,7‰ de surdités globales et 4,0‰ bilatérales.
En Rhône-Alpes, 0,4% des nouveau-nés testés en 2016 étaient perdus de vue en termes de résultats documentés. Ce taux était de 2,2% des enfants pour l’expérience d’une maternité italienne 9. En Rhône-Alpes, 7,7% des enfants dépistés à risque (c’est-à-dire avec T2 ou T3 anormal) étaient perdus de vue, résultat proche de la Haute-Normandie 6. Dans un système de santé très différent, ces taux étaient beaucoup plus élevés aux États-Unis avec 27,9% de perdus parmi les enfants avec dépistage non concluant, mais les résultats étaient très hétérogènes selon les États 5. Nous ne disposons pas d’informations sur les causes de ces ruptures dans les parcours, plus fréquentes parmi les enfants transférés à la naissance.
La région Rhône-Alpes a choisi pour son programme une stratégie permettant le diagnostic des surdités unilatérales : les enfants ayant, à l’issue du dépistage, un test non concluant sur au moins une oreille entrent dans la phase diagnostique. Toutefois, il ne nous a pas été possible de présenter séparément les enfants suspects de façon uni ou bilatérale aux différentes étapes, ce qui pourra limiter la comparaison ultérieure de nos résultats. La publication des résultats des différentes régions françaises quand ils seront disponibles et l’échange entre professionnels permettraient de confronter les approches et les actions mises en œuvre en France pour améliorer les pratiques.
Enfin, l’aspect médico-économique du programme n’a pas été considéré. Ce point pourra être évalué à l’échelle nationale.
Conclusion
Le DNS est un processus complexe. Le programme fonctionne de façon très satisfaisante en Rhône-Alpes au regard des objectifs nationaux et régionaux. Améliorer le taux de couverture parmi les enfants transférés à la naissance (qui tend à diminuer en 2017, bien que le nombre d’enfants non dépistés reste faible) et limiter les enfants perdus de vue, notamment à l’étape diagnostique, restent des cibles essentielles pour la région. L’étude valide l’intérêt de la répétition d’un test automatisé (différé) avant un mois, qui diminue considérablement l’adressage en centre expert sans augmenter les perdus de vue.
Nous portons l’hypothèse que la gouvernance du projet en Rhône-Alpes, réunissant l’ensemble des acteurs et laissant de l’autonomie à chacun, ait contribué à cette réussite.
Enfin, un réel état des lieux du DNS nécessiterait de s’intéresser au versant « usagers », aussi bien auprès de parents d’enfants dont les résultats de dépistage étaient immédiatement concluants qu’auprès de parents inclus dans un processus de soin plus complexe, comprenant des contrôles et le recours en centre expert. D’autres études restent à mener, notamment sur les parcours de soin et éducatifs et la trajectoire développementale des enfants dépistés sourds à l’issue du programme.
Remerciements
Aux antennes de Lyon et Grenoble de l’URPHE ; aux centres experts (CEAE) des CHU de Lyon, Saint-Étienne, Grenoble, et l’INJS Chambéry-Cognin ; aux Réseaux de périnatalité Aurore, Elena, RPAI ; à l’Agence régionale de santé Auvergne Rhône-Alpes ; au groupe de travail régional, et tout particulièrement Anne Rivron et Joëlle Troussier, Pascal Gaucherand, Éric Truy, Hung Thai-Van, David Cheillan, Sandrine Roy, Géraldine de Biase, ainsi que Olivier Claris, aux équipes des maternités et unités de néonatologie de Rhône-Alpes.
Références
la_surdite_permanente_bilaterale.pdf





