Première transmission vectorielle du virus Zika en Europe : enquête de séroprévalence pour étudier l’étendue de l’émergence dans le Var en novembre 2019
// First vector transmission of the Zika virus in Europe: Seroprevalence survey
to study the extent of the emergence in Var,
France, November 2019
Résumé
L’implantation de l’Aedes albopictus expose au risque d’arboviroses et notamment d’infections au virus Zika (ZIKV), du genre des flavivirus. La première transmission vectorielle, par Aedes albopictus, en Europe de ZIKV a été identifiée à Hyères dans le Var, en France. Il s’agissait de 3 cas, avec une date de début des signes début août 2019, habitant un même quartier. Une enquête de séroprévalence a été menée afin de déterminer l’étendue de la transmission autochtone et la part des infections asymptomatiques et paucisymptomatiques.
En novembre 2019, des échantillons de sang capillaire, des informations sur les antécédents médicaux et les expositions à risque (voyages, piqures de moustiques) ont été collectés auprès des résidents consentants et des travailleurs exposés au vecteur, dans un rayon de 200 mètres autour des cas.
Des marqueurs d’infection par un flavivirus (Zika, dengue et West-Nile) ont été recherchés par sérologie IgM et IgG ELISA puis, pour les sérums positifs, confirmés en séroneutralisation (permettant de caractériser la réponse anticorps et d’identifier un antécédent d’infection par le ZIKV).
L’enquête a pu être menée auprès de 61% des foyers de la zone étudiée (88/145) et 86% des personnes enquêtées éligibles ont été prélevées (162/189). Ce pourcentage était de 82% pour les travailleurs (69/84).
Huit personnes présentaient des IgG anti-flavivirus. Les 5 séroneutralisations faites n’ont montré aucun antécédent d’infection au virus Zika. Les 3 autres personnes avaient déjà habité dans des zones à risque de transmission d’arbovirus.
Ce foyer de 3 cas d’infection à ZIKV identifié à Hyères est resté limité et l’enquête de séroprévalence n’a pas mis en évidence de cas supplémentaire.
Abstract
The implantation of Aedes albopictus exposes to the risk of arboviruses infections and in particular to Zika virus (ZIKV), of the genus flavivirus. The first vector transmission in Europe by Aedes albopictus of ZIKV was identified in Hyères in Var (France). Three cases living in the same district were detected with onset of symptoms in early August 2019. A seroprevalence survey was conducted to determine the extent of the autochthonous transmission, and the distribution of asymptomatic and pauci symptomatic infections.
In November 2019, capillary blood samples, information on medical history, and risk exposures (travel, mosquito bites) were collected from residents and workers exposed to the vector, within a 200-meter radius of cases.
Past flavivirus infections (Zika, dengue and West-Nile) were tested by IgM and IgG ELISA serology. In case of positive result, seroneutralization was performed in order to characterize the antibody response and to identify a history of ZIKV infection.
The survey was carried on 61% of households in the study area (89/145), and 86% of eligible respondents were sampled (162/189). This percentage was 82% for workers in the area (69/84).
Eight people presented anti-flavivirus IgG. 5 sero-neutralizations were performed and showed no history of Zika infections. The other 3 people had already lived in areas at risk of transmission.
This cluster of 3 cases of ZIKV infection identified in Hyères remained limited and the seroprevalence survey did not reveal any additional cases.
Introduction
Le virus Zika (ZIKV) est un arbovirus appartenant à la famille des Flaviviridae, du genre flavivirus, comme les virus de la dengue, du West-Nile ou encore de la fièvre jaune. La plupart des infections sont asymptomatiques et les formes symptomatiques sont le plus souvent bénignes et d’évolution rapidement favorable. Elles sont caractérisées par un syndrome pseudo grippal et souvent d’une éruption cutanée diffuse 1,2,3. Il n’existe pas de traitement curatif spécifique du Zika, ni de vaccin (même si certains projets sont en cours de développement 4).
Isolé pour la première fois en 1947 en Ouganda, ce virus a été identifié en Asie en 1966, puis a provoqué des épidémies dans le Pacifique, dont une majeure en Polynésie française en 2013. Le virus a ensuite atteint le Brésil en 2015, puis de façon épidémique toutes les Amériques jusqu’en 2016.
Le ZIKV est majoritairement transmis par des moustiques du genre Aedes principalement par Aedes aegypti et exceptionnellement par Aedes albopictus 5. Il peut aussi se transmettre par transmission sexuelle 6, transfusion sanguine ou encore par transmission materno-fœtale 1,7.
C’est à l’occasion de l’épidémie de 2015-2016, pour laquelle l’OMS a déclaré une urgence sanitaire de portée internationale que les complications neurologiques et congénitales du Zika ont été décrites. Parmi celles-ci, le syndrome de Guillain-Barré a été décrit chez des adultes et des enfants infectés. Les études montrent, qu’environ 25% des fœtus dont la mère a été infectée pendant la grossesse pourraient être infectés, entraînant parfois : des fausses couches, une mort fœtale (4-7%), ou des malformations congénitales regroupées sous le terme de syndrome d’infection congénitale Zika (5-14%), dont une microcéphalie (4-6%) 1.
Jusqu’en 2018, en France, le dispositif de surveillance des cas de dengue, chikungunya et Zika avait identifié 11 cas de zika autochtones, contaminés par transmission sexuelle. Début octobre 2019, un cas de zika a été confirmé par le Centre National de Référence (CNR) des arbovirus dans la ville d’Hyères dans le Var (département colonisé par Aedes albopictus depuis 2007) 8. L’hypothèse de transmission vectorielle étant privilégiée à la suite de l’interrogatoire du cas, une première investigation en porte à porte a été menée autour du cas le 10 octobre 2019 et des traitements de lutte antivectorielle (LAV) ont été réalisés. L’identification de deux nouveaux cas parmi ses proches voisins (habitant à moins de 90 mètres du 1er cas), qui appartenaient vraisemblablement à la même génération de cas car survenus dans un laps de temps de 8 jours, renforçait l’hypothèse de transmission vectorielle. Ainsi, il s’agissait probablement du premier épisode de zika par transmission vectorielle (par Aedes albopictus) documenté en Europe 8.
Une enquête de séroprévalence a été menée autour de ces trois cas. Elle avait pour objectifs de déterminer l’étendue réelle de la transmission, la part et le rôle des cas asymptomatiques ou pauci/symptomatiques dans la transmission du virus. Cet article présente cette enquête.
Méthode
Type, zone d’étude et population cible
Pour cette enquête de séroprévalence, une enquête transversale exhaustive en population a été conduite les 14 et 15 novembre 2019 sur une zone de 200 mètres de rayon centrée sur les lieux de résidence des 3 cas autochtones de ZIKV (figure 1).
 Agrandir l’image
Agrandir l’imageLe périmètre d’action de l’enquête de 200 mètres de rayon couvrait environ 90% de la distance de vol parcourue par les Aedes albopictus femelles 9.
Le protocole de cette enquête complémentaire dérivait de celui de l’étude de séroprévalence de la dengue réalisée dans un quartier résidentiel de Nîmes en 2015 10.
Les personnes suivantes ont été incluses dans l’étude :
–celles habitant, et ayant séjourné au moins une nuit dans la zone d’enquête, de juillet à octobre ;
–les travailleurs de la zone, ayant travaillé au moins une journée de juillet à octobre, et ayant eu une activité extérieure de plus d’une heure par journée travaillée, ou rapportant la notion de piqûres de moustiques en journée sur leur lieu de travail.
Etaient exclues toutes les personnes dans l’incapacité de donner un consentement éclairé et les enfants de moins de 2 ans et demi (en raison des difficultés de prélèvement et par souci d’éthique).
Les premières estimations de la population et du nombre de foyers sur la zone ont été faites à partir des données des revenus fiscaux localisés en 2015 (carroyage périmètre 200 mètres). Puis, une visite sur site a été organisée afin de recenser l’ensemble des foyers (nom et adresse des foyers indiqués sur des feuilles de route pour les enquêteurs).
Enquête de terrain
L’enquête a mobilisé 17 enquêteurs de différentes institutions publiques (Santé publique France, Agence régionale de santé Provence-Alpes-Côte d’Azur (ARS Paca), CNR des arbovirus et Entente interdépartementale pour la démoustication du littoral méditerranéen (EID Méditerranée)) sur deux jours.
La zone à enquêter était découpée en 6 secteurs, chacun investigué par un binôme (comprenant au moins une personne du secteur médical ou paramédical). Six feuilles de route recensant les foyers permettaient de faciliter les déplacements des enquêteurs.
Une équipe de coordination recueillait la totalité des questionnaires et vérifiait la qualité et la complétude des données et revenait vers les enquêteurs si besoin.
Chaque logement était visité 4 fois à des heures différentes avant de le considérer comme « absent ». Les horaires de passages couvraient l’ensemble des tranches horaires, y compris entre midi et deux heures et en soirée. Les raisons de refus de participation à l’enquête étaient renseignées par l’enquêteur, dans la mesure du possible.
La collecte d’informations démographiques, sur le foyer ou le lieu de travail, s’appuyait sur un premier questionnaire, administré à un adulte répondant pour l’ensemble des personnes de ce lieu. Les informations cliniques, épidémiologiques et entomologiques (existence de symptômes de juillet à octobre 2019, antécédents d’arboviroses, exposition aux moustiques) étaient collectées auprès de chaque participant : habitants, tuteur légal si mineur, ou travailleurs, à l’aide d’un questionnaire individuel.
Aspect éthique
Un consentement éclairé a été recueilli systématiquement par écrit. Les informations directement nominatives et/ou identifiantes ont été collectées et conservées à part des informations cliniques, biologiques et sociodémographiques.
Cette enquête complétait les investigations épidémiologiques menées dans le cadre de la surveillance des arboviroses et était réalisée conformément à l’autorisation N°341 194 v 42 de la Commission nationale de l’informatique et des libertés (Cnil).
Saisie et analyses de données
Seules les données anonymisées ont été saisies sur Voozanoo®. Les analyses descriptives des données ont été faites sur Stata®. Les questionnaires ont été placés dans une armoire forte pendant la durée de l’analyse.
Analyses biologiques
Les interrogatoires s’accompagnaient de la collecte de quelques gouttes de sang par prélèvement sur papier buvard au bout du doigt. Ces buvards ont ensuite été transmis au CNR des arbovirus (IHU/IRBA Marseille).
Une technique de diagnostic indirect (détection des IgM et IgG par ELISA maison du CNR des arbovirus, avec pour antigène du virus précipité et inactivé) était mise en œuvre pour chaque prélèvement recueilli pour rechercher des infections par un flavivirus (Zika, dengue et West-Nile) 11. Puis, un nouveau prélèvement était demandé pour toute sérologie positive. Les prélèvements reçus par le CNR ont été testés en séroneutralisation pour caractériser la réponse anti-ZIKV et la distinguer de celles dirigées contre d’autres flavivirus.
Définition de cas
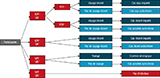
Les critères biologiques et épidémiologiques des définitions de cas de Zika (figure 2) visaient à classer les participants présentant un test diagnostique positif, selon qu’ils présentaient une infection aiguë, récente ou une cicatrice sérologique. Un cas était classé comme symptomatique s’il présentait une éruption cutanée, avec ou sans autres symptômes, et pauci-symptomatique s’il avait présenté un ou plusieurs symptôme(s) en l’absence d’éruption.
 Agrandir l’image
Agrandir l’imageSensibilisation de la population enquêtée
Avant le début de l’enquête, plusieurs supports de sensibilisation ont été utilisés pour obtenir l’adhésion d’un maximum de personnes. Des communiqués de presse ont été publiés à plusieurs étapes de l’émergence et ont donné lieu à de nombreux articles locaux et nationaux. L’enquête de séroprévalence et deux réunions publiques d’information ont été annoncées par courrier et des affiches ont été mises en place sur la zone. Le comité de quartier a également été informé.
Résultats
Enquête de terrain
Pour les résidents, l’enquête a pu être menée auprès de 61% des foyers de la zone étudiée (88/145 foyers). Parmi les personnes enquêtées éligibles, 86% ont été prélevées (162/189) et 88% (166/189) ont répondu au questionnaire individuel. Le nombre moyen de personnes par foyer enquêté était de 2, l’âge médian de 63,5 ans et le sex-ratio (H/F) de 0,8 (86/105). Trois personnes de foyers différents n’étaient pas éligibles et 16% des foyers (23/145) ont refusé ouvertement de participer à l’enquête ; la raison la plus citée étant le manque de temps (7/23). Les foyers absents représentaient 23% (34/145).
La quasi-totalité des foyers enquêtés avait un jardin (95%) et 49% des répondants y passaient plus de 4 heures par jour entre juillet et octobre. La plupart des foyers rapportaient des systèmes pouvant contenir ou générer de l’eau (95%) : les plus fréquents étant la présence de pots de fleurs (91%), d’un arrosage automatique (32%) et de piscine à demeure (31%). La plupart des résidents enquêtés ont perçu la présence de moustiques comme « très nombreux » (39%) ou « assez nombreux » (27%) l’été de l’enquête. Néanmoins, 40% de ces résidents rapportaient avoir été « peu piqué » par les moustiques sur leur lieu de domicile (tableau 1).
 Agrandir l’image
Agrandir l’imageChez les travailleurs, 84 étaient éligibles à l’enquête. L’âge médian était de 38 ans et le sex-ratio (H/F)
de 0,6 (33/51).
Parmi eux, 82% (69/84) ont été prélevés et 83% (70/84) ont répondu au questionnaire. Seuls 21% travaillaient plus de 4 heures
par jour à l’extérieur dans la zone étudiée. Ils étaient 58% à être « peu » (44%) ou « pas du tout » (14%) piqués, mais la
notion de piqûre et de nuisance semblait être très personne-dépendante (tableau 1).
Cas autochtones / Résultats biologiques
Sur les buvards recueillis lors de l’enquête de séroprévalence, 8 personnes asymptomatiques pendant l’été 2019 présentaient des IgG dirigés contre les flavivirus (sans IgM positifs) (tableau 2).
Var, novembre 2019
 Agrandir l’image
Agrandir l’image–Parmi eux, 5 ont accepté de faire un prélèvement sanguin de contrôle pour réalisation de tests de séroneutralisation par le CNR des arbovirus. Ces tests n’ont montré aucun antécédent d’infection par le virus Zika. Néanmoins, tous présentaient des anticorps neutralisants montrant une infection ancienne par le virus de la dengue (cicatrice sérologique), en cohérence avec des antécédents de voyage dans une zone endémique de la dengue (tableau 2).
–Les 3 autres personnes n’ont pas réalisé de prélèvement de contrôle. Tous avaient habité dans une zone à risque de transmission et 2 avaient rapporté un antécédent de dengue (tableau 2). Le CNR a conclu à une infection ancienne par flavivirus.
Le séquençage réalisé à partir du prélèvement précoce de l’un des 3 cas autochtone montre une origine asiatique du ZIKV 12.
Recherche du cas importé
Durant les mois de juin, juillet et août 2019, 10 foyers avaient reçu des personnes ayant voyagé dans le mois précédent dans des zones de circulation du virus. Une personne habitant en Thaïlande avait séjourné à son retour de voyage dans un foyer situé entre les 3 cas ; 6 jours après son retour (mi-juillet), elle avait présenté une éruption cutanée. Son prélèvement sur papier buvard a été réalisé à la suite de l’enquête de séroprévalence et a montré la présence d’IgG flavivirus. Néanmoins, le CNR n’a pas pu estimer si l’infection était ancienne ou récente (prélèvement tardif et test de séroneutralisation impossible, en raison de trop petite quantité de sang présent sur le papier buvard).
Discussion – conclusion
L’enquête de séroprévalence complétant l’investigation initiale de l’émergence de ZIKV à Hyères, réalisée dans le cadre de la surveillance renforcée du chikungunya, de la dengue et du Zika 13, montre que le foyer de transmission est resté limité. Elle n’a pas permis d’identifier de nouveau cas en dehors des 3 cas retrouvés lors de l’enquête en porte à porte initiale 8.
Les 3 cas, rapprochés dans le temps et dans l’espace, appartenaient visiblement à la même chaîne de transmission de ZIKV, qui a probablement régressé d’elle-même. En effet, faute de signalement du cas importé primaire et du fait du diagnostic tardif du cas à l’origine de l’alerte, les actions de LAV ont été menées plus d’un mois après la date de début des signes du cas index.
Tous étaient des résidents symptomatiques qui avaient présenté leurs premiers signes entre le 7 et le 15 août. Ils résidaient dans un rayon de 50 mètres et avaient tous des jardins attenants. Ils rapportaient avoir été « très piqués » et que les moustiques étaient « très nombreux » à leur domicile.
Avant l’enquête de séroprévalence, les actions de sensibilisation de la population et la collaboration avec la ville d’Hyères, notamment pour organiser deux réunions publiques préparatoires, ont permis d’obtenir la participation de 61% des foyers de la zone d’étude, ce qui était supérieur au taux attendu (taux de 40% pour l’enquête réalisée sur Nîmes en 2015 10). Les passages répétés des enquêteurs et la proximité avec les habitants ont joué un rôle essentiel. Les échanges ont permis d’accompagner au mieux la population et de recueillir un maximum d’informations (identification d’un cas suspect importé et de nombreuses maisons inhabitées notamment).
Par ailleurs, cette enquête n’a pas permis d’identifier de cas asymptomatiques, alors qu’il est rapporté dans la littérature que la majorité des formes de ZIKV sont asymptomatiques 2,3. Néanmoins, ces études ont été réalisées auprès de populations déjà exposées aux flavivirus et les données ne sont donc peut-être pas transposables à la population française métropolitaine qui est naïve.
Bien qu’un cas probable importé revenant de Thaïlande ait été identifié par l’enquête de séroprévalence, le test de séroneutralisation n’a pas pu être effectuée et l’antériorité de l’infection à ZIKV n’a pas été datée (prélèvement sur papier buvard tardif ne permettant pas d’identifier d’IgM). L’hypothèse que ce cas, qui avait habité plusieurs années dans une zone d’endémie du ZIKV, soit à l’origine de l’introduction du virus à Hyères ne peut être vérifiée.
L’investigation de cet épisode plaide pour une transmission vectorielle du virus. L’interrogatoire des cas n’est pas en faveur d’une transmission sexuelle. L’hypothèse d’une transmission vectorielle est confortée par la survenue de cas dans un laps de temps très court dans un périmètre très limité au sein d’un quartier où la présence d’Aedes albopictus était abondante. L’identification du virus parmi les moustiques présents sur la zone aurait pu confirmer cette hypothèse, mais cette recherche entomologique n’a pas été effectuée, en raison d’un faible nombre de vecteur au moment de l’enquête et d’une capture réalisée à distance de la circulation virale.
Avant cet épisode, aucune transmission vectorielle n’avait été décrite en Europe, et ceux malgré des centaines de cas importés de ZIKV lors de l’épidémie de 2016, documentant la faible capacité vectorielle du moustique tigre à transmettre ce virus 14.
Comme pour les autres arboviroses, le couple vecteur/virus a un rôle essentiel dans l’étendue d’une émergence ou d’une épidémie. La compétence vectorielle d’Aedes albopictus pour le ZIKV serait meilleure pour des souches de ZIKV originaire d’Afrique que pour des souches asiatiques 15. Or, il s’agissait ici d’une souche asiatique 12.
Par ailleurs, en termes de surveillance, cette enquête de séroprévalence a montré que la stratégie de lutte déployée en France en routine paraît adaptée au risque actuel. L’investigation en porte à porte mise en place dans le cadre de la surveillance renforcée des arbovirus a probablement permis d’identifier l’intégralité des cas. Il est par ailleurs important que les professionnels de santé recherchent le diagnostic de Zika devant tous tableaux cliniques évocateurs avec notion de voyage dans une zone à risque de transmission. Le prélèvement doit être réalisé rapidement et les résultats positifs communiqués sans délai aux ARS de la région de domicile du cas pour contrôler toute introduction de cet arbovirus.
Remerciements
Nous tenons à remercier chaleureusement la ville d’Hyères pour son accueil, sa collaboration et la mise à disposition de locaux
durant l’enquête et les réunions d’informations.
Nous tenons également à remercier la Cellule régionale Occitanie pour leurs conseils et mise à disposition d’outils d’aide
à la réalisation de cette enquête de séroprévalence et Marine Sabastia, géomaticienne au service DATA de Santé publique France
pour l’estimation de la population sur la zone d’étude.
Enfin, nous remercions tous les enquêteurs, les participants à l’étude et leur comité de quartier d’avoir rendu cela possible.
Liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.
Références
1056/NEJMoa0805715
– 2007: A New Threat from Aedes albopictus? PLoS Negl Trop Dis. 2014;8(2):e2681.
france.fr/beh/2019/19-20/2019_19-20_1.html
Citer cet article
en Europe : enquête de séroprévalence pour étudier l’étendue de l’émergence dans le Var en novembre 2019.
Bull Epidémiol Hebd. 2020;(22):456-62. http://beh.santepubliquefrance.fr/beh/2020/22/2020_22_2.html




