Infections associées aux soins en établissement de santé : résultats de l’Enquête nationale de prévalence 2017, France
// Healthcare-associated infections in healthcare facilities: Results of French National Point Prevalence Survey, 2017
Résumé
L’Enquête nationale de prévalence (ENP) sur les infections associées aux soins (IAS) en établissement de santé (ES) est répétée tous les cinq ans. En 2017, elle avait pour objectif de mesurer la prévalence de ces infections et de décrire les patients infectés en établissement de santé.
L’enquête a été réalisée sur un échantillon représentatif des ES français par sondage aléatoire avec stratification sur la région et la catégorie d’établissement. Entre le 15 mai et le 30 juin 2017, 403 établissements de santé ont participé et inclus 80 988 patients.
En 2017, un patient sur 20 hospitalisés en ES était infecté (4,98% IC95%: [4,62-5,36]). Cette prévalence n’a pas diminué entre 2012 et 2017 alors que les enquêtes antérieures avaient montré une diminution constante depuis 2001. En 2017, la prévalence des patients infectés a augmenté en court séjour, en particulier en services de chirurgie, par rapport à 2012. Elle a également augmenté chez les patients présentant certains facteurs de risque d’infection : être atteint d’une affection maligne, avoir été opéré depuis l’admission, avoir un dispositif invasif à demeure le jour de l’enquête et en particulier un cathéter.
Les quatre principales localisations des infections associées aux soins en ES représentant 71,5% des sites infectieux documentés – voies urinaires (28,5%), sites opératoires (15,9%), pneumonies (15,6%), bactériémies (11,4%) – étaient identiques en 2012 et 2017. Cependant, la part des infections du site opératoire (ISO) parmi l’ensemble des infections a augmenté en 2017 par rapport à 2012, dépassant celle des pneumonies.
Les quatre micro-organismes les plus fréquents étaient Escherichia coli, Staphylococcus aureus, Enterococcus faecalis et Pseudomonas aeruginosa représentant la moitié des micro-organismes isolés d’IAS.
La diminution de la prévalence des patients infectés par S. aureus résistant à la méticilline (SARM) entre 2012 et 2017 confirme la diminution des infections à SARM déjà constatée par les ENP depuis 2001. La prévalence des patients infectés par des entérobactéries résistantes aux céphalosporines de 3e génération (C3G) est restée stable entre 2012 et 2017 ; celle des patients infectés par des entérobactéries productrices de β-lactamases à spectre étendu (EBLSE) a augmenté sur la période.
Ces résultats incitent à poursuivre les actions de prévention ciblées sur les infections les plus fréquentes et les plus graves, en particulier les ISO, les bactériémies et les pneumonies.
Abstract
The National Point Prevalence Survey (PPS) on healthcare-associated infections (HAI) is repeated every 5 years. In 2017, its objectives were to measure the prevalence of, and describe patients infected in healthcare facilities.
The survey was carried out on a representative sample of French healthcare facilities by random sampling with stratification by region and category of facility. Between 15 May and 30 June 2017, 403 healthcare facilities participated in the study, and 80,988 patients were enrolled.
In 2017, one out of every 20 patients hospitalized in a health facility was infected (4.98% 95%CI [4.62-5.36]). This prevalence did not decrease between 2012 and 2017, whereas previous surveys had shown a steady decrease in prevalence since 2001. Compared to 2012, the prevalence of infected patients increased in 2017 in short-stay, particularly in surgical wards. It also increased in patients with certain risk factors for infection: having a malignant disease, having had surgery since admission, having an indwelling invasive device on the day of the survey, and in particular a catheter.
The four main sites of infection associated with care in healthcare facilities, representing 71.5% of documented infectious sites – urinary tract infections (28.5%), surgical site infections (15.9%), pneumonia (15.6%) and bloodstream infections (11.4%) – were identical in 2012 and 2017. However, the proportion of surgical site infections (SSIs) among all infections increased in 2017 compared to 2012, exceeding that of pneumonia.
The four most frequent microorganisms were Escherichia coli, Staphylococcus aureus, Enterococcus faecalis and Pseudomonas aeruginosa, representing half of the microorganisms isolated from HAIs.
The decrease in the prevalence of patients infected with methicillin-resistant S. aureus (MRSA) between 2012 and 2017 confirms the decrease in MRSA infections already seen in the previous prevalence studies since 2001. The prevalence of patients infected with 3rd generation cephalosporin-resistant Enterobacteriaceae (C3G) remained stable between 2012 and 2017; the prevalence of patients infected with extendedspectrum-β-lactamases (ESBL)-producing Enterobacteriaceae increased over the period.
These results encourage the continuation of prevention actions targeting the most frequent and most serious infections, in particular surgical site infections, bloodstream infections and pneumonia.
Introduction
La prévention des infections associées aux soins (IAS) est un enjeu majeur pour la sécurité des patients hospitalisés 1. Une infection est dite associée aux soins si elle survient au cours ou au décours d’une prise en charge (diagnostique, thérapeutique, palliative, préventive ou éducative) d’un patient, et si elle n’était ni présente, ni en incubation au début de la prise en charge. Contractée dans un établissement de santé, une IAS est une infection nosocomiale (IN) 2.
Bien que la surveillance des IAS en incidence soit devenue un standard, la répétition d’enquêtes de prévalence est une alternative plus accessible, à la fois plus rapide et moins coûteuse, pour les établissements de santé (ES) 3.
En France, depuis 1996, cinq enquêtes nationales de prévalence (ENP) des IAS en ES ont permis de produire des estimations périodiques de la fréquence des IAS dans les ES et d’établir la tendance évolutive de la prévalence des patients infectés, tant au niveau national que régional 4,5,6,7,8,9,10,11,12. Ces données de référence sont utiles pour orienter les programmes de lutte contre les IAS. En 2015, le programme national d’actions de prévention des infections associées aux soins (Propias) prévoyait de réaliser une enquête nationale de prévalence des IAS dans les ES tous les cinq ans 13. En 2017, l’ENP a été mise en œuvre par les ES et coordonnée par Santé publique France au niveau national et les Centre d’appui pour la prévention des infections associées aux soins (CPias) au niveau régional.
Les objectifs de l’ENP 2017 étaient de mesurer et de décrire la prévalence des IAS en fonction des caractéristiques des patients et des ES, d’étudier son évolution depuis 2012, de mettre à disposition les données produites au niveau national et régional et de renforcer la sensibilisation des ES au risque infectieux.
Matériel et méthodes
Type d’étude et population
L’Enquête nationale de prévalence est une enquête transversale réalisée un jour donné, entre le 15 mai et le 30 juin 2017, pour tous les patients d’un ES participant. Elle est fondée sur un échantillon constitué d’un ensemble d’ES publics et privés tirés au sort et stratifiés sur la catégorie d’ES et la région. La base de sondage a été constituée à partir de la Statistique annuelle des établissements de santé au 31 décembre 2015 14. L’échantillon a été défini pour permettre une précision absolue b=0,006 pour une prévalence d’IAS estimée à 6% et un effet de plan de sondage ρ=6. L’ENP 2017 est la première ENP conduite à partir d’un échantillon représentatif d’ES en matière de catégories et de répartition régionale.
Tous les services d’hospitalisation, courts séjours, soins de suite et de réadaptation (SSR), soins de longue durée (SLD) et psychiatrie ont été inclus, à l’exception des structures d’hospitalisation à domicile, des lits d’hospitalisation de jour, des lits d’hospitalisation de nuit dans les centres hospitaliers ou structures spécialisés (CHS) et des Établissements d’hébergement pour personnes âgées dépendantes (Ehpad). Tous les patients présents le jour de l’enquête au moment du passage de l’enquêteur et admis avant 8 heures dans les services ciblés par l’enquête ont été inclus.
Recueil des données
Le recueil des données a été réalisé dans chaque ES par une équipe d’enquêteurs sous la coordination de l’équipe opérationnelle d’hygiène le plus souvent. Les enquêteurs ont renseigné un questionnaire standardisé en s’appuyant sur l’interrogatoire des personnels soignants du service enquêté et à partir des dossiers médicaux, des dossiers de soins infirmiers et des résultats des analyses biologiques des patients.
Le questionnaire standardisé permettait le recueil de données individuelles au niveau des patients et de données agrégées au niveau des ES. Les caractéristiques des ES portaient sur des données administratives (statut juridique et catégorie d’ES, région) et des données de structure et d’activité de l’ES, comme le nombre de lits et d’admissions.
Pour chaque patient étaient renseignées : 1) des données sur les caractéristiques de son séjour (la spécialité du service prenant en charge le patient et sa durée de séjour jusqu’à l’enquête) ; 2) des données sur les caractéristiques du patient, notamment en matière de facteurs de risque d’infection (sexe, âge, notion d’intervention chirurgicale depuis l’admission, indice de gravité de l’état de santé du patient mesuré par le score de McCabe 15, déficit immunitaire (oui/non), néoplasie ou affection maligne) ; 3) des données sur la présence d’un ou plusieurs dispositifs invasifs à demeure le jour de l’enquête (cathéter et type de cathéter, sonde urinaire, assistance respiratoire) ; 4) la présence d’une IAS active chez le patient le jour de l’enquête. La définition de l’IAS retenue est celle formulée dans le guide sur la surveillance et la prévention des IAS 16. Un délai d’au moins 48 heures entre l’admission et le début des symptômes est communément accepté pour distinguer une IAS d’une infection communautaire. Pour les infections du site opératoire (ISO), on considère comme associées aux soins celles survenues dans les 30 jours suivant l’intervention chirurgicale ou dans les 90 jours qui suivent l’intervention s’il y a mise en place d’une prothèse ou d’un implant 17.
Pour chaque IAS étaient documentés : 1) le siège de l’infection ; 2) la présence d’un dispositif invasif documentée pour les infections urinaires (sonde urinaire), les pneumonies (intubation) et les bactériémies (cathéter veineux central) ; 3) l’origine de l’IAS (acquise dans l’ES ou importée d’un autre ES) ; 4) la date des premiers signes ; 5) l’origine des bactériémies secondaires à une autre infection ; 6) le(s) microorganisme(s) isolé(s) de l’IAS ; 7) la sensibilité de certains d’entre eux à une sélection d’antibiotiques. Il était possible de renseigner deux IAS par patient et jusqu’à trois micro-organismes par IAS.
Les définitions des variables étaient données dans le guide de l’enquêteur 18. Les définitions des sites d’infections étaient adaptées de celles de l’European Centre for Disease Prevention and Control (ECDC) 19 et en cohérence avec celles de l’ENP 2012 20 pour permettre les comparaisons entre les deux enquêtes.
La saisie des données a été réalisée par les ES à l’aide d’un outil Web de saisie en ligne développé par le CPias de Bretagne.
Analyses des données
Les deux indicateurs principaux étaient les estimations de la prévalence des patients infectés (PPI) et de la prévalence des IAS (PIAS) pour 100 patients hospitalisés, entourées de leur intervalle de confiance à 95% (IC95%).
Des rapports de prévalences des patients infectés (RPPI) ont été calculés en analyse univariée pour différents facteurs de risque d’infection chez le patient : âge, sexe, intervention chirurgicale depuis l’admission, affection engageant le pronostic vital mesuré par le score de McCabe, immunodépression, affection maligne, dispositifs invasifs.
Les données de l’ENP 2017 ont été comparées à celles de la précédente enquête, en 2012. Des comparaisons de la PPI ont été réalisées à l’aide de modèles multiniveaux prenant en compte la nature hiérarchique des données au niveau patient, ES et région et en ajustant sur l’âge, le sexe, le score de McCabe, le type de séjour du patient, son statut immunitaire et l’exposition à certains dispositifs invasifs (sondage urinaire, assistance respiratoire, cathéter veineux périphérique ou central).
L’analyse des données a été réalisées avec le logiciel Stata 14.2®.
Résultats
Participation et patients
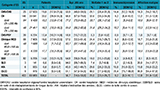
Sur les 449 ES sollicités, 403 ont participé à l’enquête soit un taux de participation de 90%. Au total, l’enquête a inclus 80 988 patients dont la distribution par catégorie d’ES figure dans le tableau 1.
 Agrandir l'image
Agrandir l'imageLes patients hospitalisés étaient plus âgés en 2017 qu’en 2012. Ainsi, l’âge médian des patients enquêtés a augmenté, passant de 67 ans en 2012 à 69 ans (IC95% : [68-69]) en 2017. En particulier, la proportion de patients de 85 ans et plus était plus importante en 2017 (20,4% [18,9-22,0]) qu’en 2012 (18,1%). De même, la proportion d’hommes hospitalisés était plus importante en 2017 (47,4% [46,4-48,4]) qu’en 2012 (45,7%).
Les proportions de patients atteints d’affections engageant le pronostic vital à 1 ou 5 ans (25,0% [23,4-26,7]), immunodéprimés (9,2% [8,3-10,1]), opérés depuis leur admission (16,9% [15,7-18,2]) ou atteints d’affection maligne (12,8% [11,9-13,8]) sont restées stables entre 2012 et 2017.
Un patient sur trois (32,2% [30,3-34,1]) était porteur d’au moins un dispositif invasif (DI) (cathéter, assistance respiratoire ou sonde urinaire). Par type de DI, les cathéters (KT) étaient majoritaires avec 29,7% [27,8-31,6] des patients porteurs d’au moins un KT ; 8,6% [8,0-9,2] des patients étaient porteurs d’une sonde urinaire et 1,0% [0,8-1,3] étaient sous assistance respiratoire. La proportion de patients présentant des DI, quels qu’ils soient, est restée stable entre 2012 et 2017, à l’exception des patients porteurs de cathéter central à insertion périphérique (PICC), dont la proportion a augmenté de manière importante (+169%) en 2017.
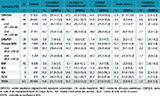
Les distributions des caractéristiques des patients par catégorie d’ES sont présentées dans les tableaux 1 et 2.
depuis leur admission, par catégorie d’établissement de santé (ES). Enquête nationale de prévalence des infections associées aux soins en établissement de santé (ENP), France, juin 2017
 Agrandir l'image
Agrandir l'imageInfections associées aux soins
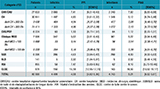
La PPI en 2017 était égale à 4,98% [4,62-5,36], proche de celle observée en 2012 (5,05%). L’analyse multivariée, après ajustement sur les caractéristiques des patients, n’a pas mis en évidence de différence significative entre les deux enquêtes de 2012 et 2017 (p>0,05).
En 2017, 4 743 IAS étaient recensées, soit une PIAS de 5,21% [4,82-5,61], également proche de celle observée en 2012 (5,34%). Quatre IAS sur 5 étaient acquises dans l’ES (78,0% [76,0-79,9]). La PIAS acquise dans l’ES n’était pas significativement différente en 2017 (4,09% [3,74-4,43]) par rapport à 2012 (3,87%). En revanche, la PIAS importée d’un autre ES a diminué en 2017 (1,03% [0,91-1,16]) par rapport à 2012 (1,20%) que ce soit en court séjour (-12%) ou hors court séjour (-25%). Le ratio infections/infectés en 2017 était égal à 1,05, identique au ratio observé en 2012 (1,06).
La PPI variait selon l’ES. Parmi les ES ayant inclus 20 patients ou plus (n=382/403 ES), la médiane des PPI par ES était égale à 4,00% [3,53-4,40]. Un quart des ES avait une PPI inférieure à 1,59% [1,21-2,22] et un autre quart une PPI supérieure à 6,36% [5,64-6,98]. La PPI variait selon la catégorie d’ES (tableau 3) et le type de séjour (tableau 4). Au sein d’une même catégorie d’ES, la PPI était également très variable selon les ES (figure 1). La PPI variait enfin selon la région (figure 2).
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'image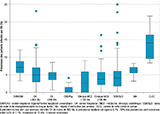 Agrandir l'image
Agrandir l'image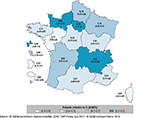 Agrandir l'image
Agrandir l'imagePar rapport à 2012, la PPI était plus élevée en 2017 en court séjour (6,21% [5,67-6,81] en 2017 versus 5,58% en 2012) et plus particulièrement en services de chirurgie (7,57% [6,46-8,86] en 2017 versus 5,57% en 2012). Elle était plus faible en 2017 par rapport à 2012 dans les services de moyen séjour (5,34% [4,84-5,88] en 2017 versus 6,55% en 2012) et de long séjour (3,01% [2,55-3,54] en 2017 versus 4,01% en 2012).
La PPI variait surtout selon les caractéristiques des patients et notamment selon leur exposition à certains facteurs de risque : être âgé de 65 ans et plus, avoir eu une intervention chirurgicale depuis l’admission, avoir une affection engageant le pronostic vital à 1 ou 5 ans, être immunodéprimé, avoir une affection maligne et être porteur d’un dispositif invasif (tableau 5). Ainsi, un patient présentant l’un ou l’autre de ces facteurs de risque présentait un risque 6,6 [5,1-8,6] fois plus élevé d’être infecté qu’un patient ne présentant aucun de ces facteurs de risque. Pour certains facteurs de risques d’infection (affections malignes, chirurgie depuis l’admission, cathétérisme), les RPPI étaient à la hausse en 2017 par rapport à 2012.
 Agrandir l'image
Agrandir l'imageLes infections urinaires, les infections du site opératoire, les pneumonies et les bactériémies représentaient 71,5% [69,1-73,7] des sites infectieux documentés, soit une prévalence des infections égale à 3,72% [3,38-4,06] (figure 3). La part relative des ISO parmi l’ensemble des infections dépassait celle des pneumonies en 2017 par rapport à 2012 où les pneumonies arrivaient au deuxième rang des localisations d’IAS.
 Agrandir l'image
Agrandir l'imageCette augmentation de la part des ISO entre 2012 (13,5%) et 2017 (15,9% [14,3-17,7]) concernait les ISO profondes et d’organe, mais pas les ISO superficielles. En outre, les patients qui présentaient au moins un facteur de risque d’infection en 2017 avaient 7,8 [4,7-12,8] fois plus de risques d’avoir une ISO profonde ou d’organe que les patients non exposés à un facteur de risque, alors qu’en 2012, ce ratio était moindre (RPPI=3,4).
La prévalence globale des patients présentant une bactériémie en 2017 (0,59% [0,49-0,71]) était proche de celle de 2012 (0,54%). En revanche, la prévalence des patients présentant une bactériémie parmi les patients porteurs d’un cathéter veineux central (KTVC) ou d’un PICC a diminué en 2017 (1,07% [0,68-1,69] et 1,16% [0,58-2,31] respectivement pour les KTVC et les PICC) par rapport à 2012 (2,2% et 3,4% respectivement pour les KTVC et les PICC) mais pas significativement parmi les patients porteurs d’une chambre implantable (0,81% [0,27-2,43] en 2017 versus 1,6% en 2012).
La prévalence des patients atteints d’une infection urinaire est restée stable entre 2012 (1,59%) et 2017 (1,48% [1,35-1,62]). Cette prévalence, qui atteignait 5,52% [4,78-6,35] chez les patients sondés, n’a pas évolué depuis 2012 (5,62%) chez ces patients.
Enfin, la prévalence des patients atteints de pneumonie est restée stable entre 2012 (0,89%) et 2017 (0,81% [0,70-0,93]). On note que la proportion de diagnostics de pneumonie hors gériatrie posés sans critère microbiologique a diminué entre 2012 et 2017, passant de près de la moitié des diagnostics de pneumonie (48,0%) à 39,8% [34,3-45,6].
Micro-organismes et résistance aux antibiotiques
Au moins un MO était isolé pour 72,4% [69,6-75,1] des IAS. Cette documentation microbiologique des infections était plus élevée en 2017 qu’en 2012 (68,2%). Les quatre MO les plus fréquents étaient par ordre décroissant Escherichia coli, Staphylococcus aureus, Enterococcus faecalis et Pseudomonas aeruginosa, représentant à eux seuls la moitié (50,2% [48,2-52,2]) des MO isolés d’IAS (tableau 6). Si les parts de E. coli, S. aureus, et P. aeruginosa ont diminué en 2017 par rapport à 2012, celle d’E. faecalis a augmenté passant de 4,6% en 2012 à 6,5% [5,6-7,5] des MO isolés d’IAS en 2017. Ainsi, E. faecalis arrivait au 3e rang des MO les plus fréquents en 2017 alors qu’il n’arrivait qu’au 5e rang en 2012, après P. aeruginosa et Klebsiella pneumoniae.
Clostridium difficile correspondait à 2,3% [1,8-3,0] des MO isolés d’IAS en 2017, pour une PPI égale à 0,11% [0,08-0,14], non différente significativement de celle observée en 2012 (0,11%). Après ajustement sur les caractéristiques des patients, la prévalence reste stable entre les deux enquêtes de 2012 et 2017 (p>0,05).
 Agrandir l'image
Agrandir l'imageLes caractéristiques de résistance aux antibiotiques étaient disponibles pour la majorité des souches concernées en 2017 (93,4% [91,7-94,7]) et davantage documentées qu’en 2012 (87,4%). Parmi les souches de S. aureus testées, 27,2% [22,0-33,1] étaient résistantes à la méticilline, pour une PPI à S. aureus résistant à la méticilline (SARM) de 0,16% [0,13-0,21]. Cette PPI à SARM a diminué en 2017 par rapport à 2012 (0,23%) ; ce résultat est confirmé en analyse multivariée, après ajustement sur les caractéristiques des patients (-7,5% de la PPI à SARM, p<0,001). La prévalence des infections à S. aureus sensible à la méticilline (SASM) est restée stable, égale à 0,44% [0,38-0,51] en 2017 et 0,44% en 2012. Parmi les entérocoques, la résistance aux glycopeptides concernait 0,4% [0,1-1,4] des souches d’E. faecalis et 5,1% [2,2-11,4] des souches d’Enterococcus faecium.
Parmi les bactéries à Gram négatif aérobies strictes, 13,5% [9,5-18,8] des souches de P. aeruginosa étaient résistantes aux carbapénèmes pour une PPI de 0,04% [0,02-0,06].
Pour les entérobactéries, 22,5% [20,0-25,2] des souches testées étaient résistantes aux céphalosporines de 3e génération (C3G) pour une PPI égale à 0,39% [0,33-0,46]. Cette PPI à entérobactéries résistantes aux C3G est restée stable entre 2017 et 2012 (0,37%), ce que confirme l’analyse multivariée. Sur l’ensemble des souches d’entérobactéries testées, 15,3% [13,2-17,7] étaient productrices de β-lactamases à spectre étendu (BLSE) pour une PPI de 0,27% [0,23-0,33]. Cette prévalence a augmenté en 2017 par rapport à 2012 (0,22%). Enfin, 0,6% [0,3-1,6] des souches d’entérobactéries étaient résistantes aux carbapénèmes pour une PPI de 0,01% [<0,01-0,03], proche de la PPI de 2012 (0,025%).
Discussion
L’ENP 2017 a mesuré la prévalence des patients infectés en établissement de santé en France : un jour donné, 1 patient hospitalisé sur 20 présentait au moins une IAS. Après ajustement sur les caractéristiques des patients, la prévalence globale des patients infectés est restée stable entre 2012 et 2017, alors qu’elle avait diminué régulièrement entre 2001 et 2012. Ce résultat justifie des études complémentaires afin d’analyser l’influence de facteurs non pris en compte dans cette enquête de prévalence, notamment la durée d’hospitalisation et les caractéristiques de l’organisation des soins à l’hôpital dont les évolutions récentes peuvent expliquer en partie cette stabilité de la PPI.
L’enquête de 2017 a permis de constater un vieillissement de la population des patients hospitalisés en ES depuis 2012. Pour les autres caractéristiques des patients recueillies dans le cadre des enquêtes, les deux populations de 2012 et 2017 ne sont pas différentes, à l’exception de la proportion de patients porteurs de PICC qui a augmenté de manière importante depuis 2012, en cohérence avec l’essor de cette nouvelle stratégie d’accès veineux en remplacement des cathéters veineux centraux classiques, comme rapporté dans la littérature 21.
La PPI varie largement selon les caractéristiques des ES, des services et des patients confirmant les résultats des précédentes enquêtes. L’évolution de la PPI est très contrastée en fonction des types de séjour. Elle augmente entre 2012 et 2017 en court séjour, en particulier en chirurgie et elle diminue en moyen et long séjour. Comme en 2012, l’enquête retrouve un lien entre une prévalence élevée et un âge supérieur à 45 ans, risque qui se renforce pour les plus de 65 ans. Les autres facteurs de risque d’infection bien décrits dans la littérature 22 sont le sexe masculin, le terrain défavorable en matière de gravité de l’état de santé du patient, une immunodépression, une affection maligne, un antécédent d’intervention chirurgicale, une durée de séjour de plus d’une semaine en particulier en court séjour, une exposition à un dispositif invasif quel qu’il soit (cathéter vasculaire, sonde urinaire, assistance respiratoire).
L’interprétation de ces facteurs de risque doit rester prudente car il s’agit d’une enquête transversale, réalisée un jour donné, qui ne permet pas de savoir si ces facteurs, comme les dispositifs invasifs en particulier, étaient présents ou non avant la survenue de l’infection, et donc d’établir un lien de causalité. La prise en compte de ces facteurs reste néanmoins importante, notamment pour comparer les PPI mesurées dans les populations de patients hospitalisés en 2012 et 2017. Les résultats de l’enquête ont effectivement montré une augmentation des RPPI entre 2012 et 2017 pour certains facteurs de risques : être atteint d’une affection maligne, être opéré depuis l’admission, avoir un dispositif invasif à demeure le jour de l’enquête et en particulier un cathéter. Le fait de réaliser l’enquête toujours à la même période de l’année, en mai et juin, permet de s’extraire de l’effet saisonnier sur la survenue des infections nosocomiales rapporté dans la littérature 23,24,25.
Les variations régionales de la prévalence des patients infectés doivent être interprétées avec prudence car elles peuvent être liées aux caractéristiques régionales des patients et des ES.
Les quatre sites infectieux les plus fréquents – infections urinaires (plus d’1 IAS sur 4), ISO (1 IAS sur 6), pneumonies (1 IAS sur 6) et bactériémies (plus d’1 IAS sur 10) – sont identiques en 2012 et 2017 9. Cependant, on constate une augmentation en 2017 de la proportion des ISO parmi l’ensemble des sièges d’infection, qui dépasse celle des pneumonies. L’amélioration de la spécificité des diagnostics de pneumonie et des infections urinaires, permettant d’évoquer des diagnostics différentiels non infectieux qui ne sont plus comptabilisés parmi les IAS, explique possiblement leur diminution relative par rapport aux ISO. En outre, l’augmentation des ISO profondes et de l’organe est d’autant plus marquante que la part des ISO superficielles diminuent. Le développement de l’ambulatoire entre 2012 et 2017 est susceptible d’expliquer la diminution de la prévalence des ISO superficielles qui ne sont plus observées et prises en charge dans les ES mais en ville. La prédominance de ces quatre principaux sites infectieux est également observée dans la plupart des pays européens en 2017 26. On note toutefois que, au niveau européen, les pneumonies arrivent au premier rang des sites infectieux (21,4%), suivies des infections urinaires (18,9%), des ISO (18,3%) puis des bactériémies (10,8%).
L’ENP permet aussi de décrire précisément l’écologie microbienne des IAS. E. coli, S. aureus, E. faecalis et P. aeruginosa restent les quatre MO les plus fréquents et représentent la moitié des MO isolés des IAS. L’augmentation de la part relative d’E. faecalis pourrait être due en partie à la différence de protocole, qui permet de renseigner en 2017 un 3e MO pour chacune des IAS, E. faecalis étant volontiers isolé d’infections polymicrobiennes, notamment abdominales, urinaires et cutanées (ISO en particulier).
La diminution de la prévalence des patients infectés à SARM, après ajustement sur les caractéristiques des patients et des ES, confirme la diminution des infections à SARM déjà constatée par les ENP depuis 2001 7,9. Cette diminution est cohérente avec les données en incidence obtenues par le réseau de surveillance « BMR-Raisin » qui a évalué la diminution de l’incidence des SARM à 31% entre 2012 et 2016, passant de 0,35 cas pour 1 000 journées d’hospitalisation (JH) à 0,24 cas pour 1 000 JH 27. Si la prévalence des infections à SARM a diminué entre 2012 et 2017, celle des infections à SASM est restée stable. Ces résultats sont cohérents avec ceux déjà publiés qui montrent que les infections à SARM ne remplacent pas les infections à SASM mais s’y ajoutent 28,29. L’augmentation de la prévalence brute des patients infectés par des entérobactéries productrices de β-lactamases à spectre étendu (EBLSE) entre 2012 et 2017 est également cohérente avec les données en incidence obtenues par le réseau de surveillance « BMR-Raisin », qui a mesuré une augmentation de 34% de l’incidence des EBLSE entre 2012 et 2016, passant de 0,53 cas pour 1 000 JH à 0,71 cas pour 1 000 JH. Cette augmentation semblait se stabiliser en 2017 27.
L’ENP 2017 est la première ENP des IAS réalisée à partir d’un échantillon d’ES français, alors que les ENP précédentes portaient sur la population entière des patients hospitalisés un jour donné. Cette approche a permis de contrôler la représentativité des données, garantie par la stratification de l’échantillon et l’application des poids de sondage, tout en réduisant la charge de travail globale des équipes d’hygiène mobilisées pour un nombre réduit d’ES. La sensibilisation et l’accompagnement par les CPias d’une sélection d’ES à la conduite de cette ENP a aussi contribué à une proportion de participation des ES sollicités plus importante en 2017 (89,8%) qu’en 2012 (74,7%) et à une amélioration de la qualité des données recueillies par les ES en 2017, mesurée par une moindre proportion de données manquantes par rapport aux enquêtes précédentes (données non présentées ici, disponibles dans le rapport 30).
En comparaison avec les autres pays européens, l’ECDC situe la France dans la moyenne des pays, la PPI en ES de court séjour au niveau européen étant de 5,5% [4,6-6,7] 26. Parmi les 31 pays participants, 14 pays (45%) présentaient une PPI supérieure à celle de la France. La Grèce présentait la PPI la plus élevée (10,0% [8,5-11,6]) et la Lituanie la moins élevée (2,9% [2,1-4,0]). Une estimation de l’incidence de patients infectés en France à partir des données de prévalence de 2017 1 a permis d’évaluer le poids annuel d’IAS en ES de court séjour à près de 500 000 patients infectés 26. En 2012, la PPI en France se situait plutôt dans la moyenne basse européenne (6,0% [5,7-6,3]). Parmi les 33 pays participants, 21 pays (64%) présentaient une PPI supérieure à celle de la France 31. Par rapport à 2012, le rang de la France en matière de PPI en ES de court séjour a donc reculé en 2017 au regard des autres pays européens.
Conclusion
La prévalence globale des patients infectés ne diminue plus entre 2012 et 2017, alors qu’elle avait diminué régulièrement entre 2001 et 2012. Ces résultats incitent à poursuivre les actions de prévention des infections associées aux soins en les ciblant sur les infections les plus fréquentes et/ou les plus graves (infections urinaires, infections du site opératoire, pneumonies, bactériémies).
Parmi les sites infectieux, la part des ISO profondes et d’organe augmente entre 2012 et 2017. La prévalence des patients atteints d’une ISO augmente chez les patients les plus fragiles et diminue chez les patients non exposés à des facteurs de risque d’infection.
Les variations régionales de la prévalence des patients infectés ou traités, si elles peuvent s’expliquer par celles des caractéristiques des patients ou des ES, doivent être connues et prises en compte dans le cadre d’une déclinaison régionale des actions désormais à promouvoir par les CPias et les missions nationales de prévention et de surveillance des IAS et de la résistance aux antibiotiques.
Remerciements
Les auteurs remercient l’ensemble des professionnels et équipes d’enquêteurs des établissements de santé qui ont participé à cette enquête.
Liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article. Cette étude n’a reçu aucun financement spécifique.
Références
france.fr/docs/etude-des-traitements-antibiotiques-a-partir-de-l-enquete-de-prevalence-nationale-2001
Circulaire&hit=1&r=39781
panoramas-de-la-drees/article/les-etablissements-de-sante-edition-2017
101_resources/Surveillance_NHSN/NHSN_9pscSSIcurrent_jan2015.pdf
prevalence.html
publiquefrance.fr/maladies-et-traumatismes/infections-associees-aux-soins-et-resistance-aux-antibiotiques/
infections-associees-aux-soins/documents/rapport-synthese/enquete-nationale-de-prevalence-2012-des-infections-nosocomiales-et-des-traitements-anti-infectieux-en-etablissements-de-sante.-mai-juin-2012.-prot




