Épidémiologie descriptive et évolution dans le temps et l’espace de l’incidence des maladies inflammatoires chroniques intestinales dans le nord-ouest de la France (1988-2014)
// Descriptive epidemiology and time and space evolution of the incidence of inflammatory bowel disease in Northwest France (1988-2014)
Résumé
Le registre Epimad a été créé en 1988 et couvre quatre départements du nord-ouest de la France (Nord, Pas-de-Calais, Somme et Seine-Maritime). Il a permis d’obtenir les premières données d’incidence des maladies inflammatoires chroniques intestinales (MICI) françaises. Ce registre couvre près de 6 millions d’habitants, soit 9,1% de la population française. La collection des cas repose sur une collaboration étroite entre les gastro-entérologues libéraux, hospitaliers et universitaires, adultes et pédiatres.
De 1988 à 2014 (dernière année validée), 19 266 cas incidents ont été enregistrés avec une forme certaine ou probable de MICI. Les gastro-entérologues en activité libérale ont déclaré 80% des cas. Sur la période, l’incidence de la maladie de Crohn (MC) a augmenté significativement de 5,3 à 7,6 pour 105 habitants, alors que celle de la rectocolite hémorragique (RCH) est restée stable à 4,4 pour 105 habitants. Depuis 2003 particulièrement, une explosion de l’incidence des MICI chez les adolescents est rapportée, passant de 4,2 à 9,5/105 (+126%) pour la MC et de 1,6 à 4,1/105 (+156%) pour la RCH. Une hétérogénéité spatiale et temporelle de l’incidence des MICI a été identifiée à l’échelle cantonale et quatre clusters présentant un sur-risque de MC ont été isolés.
Ces données vont permettre de mettre en place des études d’épidémiologie analytique afin d’identifier de possibles facteurs de risque environnementaux associés aux MICI.
Abstract
The EPIMAD registry, a prospective population-based study covering four Northern France districts (Nord, Pas-de-Calais, Somme and Seine-Maritime) was created in 1988. It contributed to provide the first data on the incidence of inflammatory bowel diseases (IBD) in France. The register covers nearly 6 million inhabitants, or 9.1% of the French population. The case collection is based on a close collaboration between liberal, hospital, academic, adult and pediatric gastroenterologists. From 1988 to 2014 (last validated year), 19,266 patients were enrolled, with definite and probable IBD. Eighty percent of these cases were reported by private gastroenterologists. Over the period, the incidence rate of Crohn’s Disease (CD) increased from 5.3 to 7.6 per 105 inhabitants, while the incidence of ulcerative colitis (UC) was stable at 4.4 per 105 inhabitants. Since 2003, we reported a dramatic increase in the incidence of IBD in adolescents (10-16 years), from 4.2 to 9.5/105 (+126%) for CD and from 1.6 to 4.1/105 (+156%) for UC. Spatial and temporal heterogeneity in the incidence of IBD was observed and four clusters with a high risk to develop CD were isolated. These data will enable analytical epidemiology studies to identify potential environmental risk factors associated to IBD.
Introduction
Les maladies inflammatoires chroniques de l’intestin (MICI) incluent la maladie de Crohn (MC) et la rectocolite hémorragique (RCH). Ce sont des inflammations chroniques du tube digestif, atteignant exclusivement le rectum et le côlon pour la RCH, et tout le tube digestif, avec une prédilection pour la région iléo-cæcale, pour la MC.
Bien que des progrès aient été récemment faits, en particulier dans le domaine génétique, dans la compréhension de leur physiopathologie, la (ou les) causes de ces deux maladies reste(nt) à ce jour inconnue(s) 1,2,3. La RCH et la MC augmentent peu ou pas la mortalité, mais en raison de leur survenue tôt dans la vie et de leur chronicité, elles induisent une morbidité élevée qui altère la qualité de vie des malades.
L’essentiel des données concernant la fréquence des MICI et leur prise en charge provient de centres experts ou de bases de données médico-administratives 4,5. Les patients suivis dans ces centres représentent un échantillon sélectionné et l’extrapolation de ces données à l’ensemble de la population est impossible. Un registre en population générale permet une collection exhaustive des informations d’une population, définie dans le temps et dans l’espace. Ce type d’étude permet la description précise de l’incidence, de la prévalence et de l’évolution dans le temps et l’espace de ces deux paramètres. Cette approche épidémiologique descriptive peut ainsi orienter vers des pistes étiologiques. Il n’existait en France aucune donnée sur l’incidence des MICI avant 1988, date à laquelle le registre Epimad a été bâti dans le nord-ouest de la France, par des épidémiologistes et des gastroentérologues universitaires et libéraux.
L’objectif de cet article est de présenter l’évolution spatiale et temporelle de l’incidence des MICI, la recherche de clusters (selon le principe du screening) et l’analyse des déterminants de cette incidence sur une période de 27 ans (1988-2014) dans le nord-ouest de la France.
Patients et méthodes
La méthode du registre Epimad a été décrite et publiée par ailleurs 6,7,8. En résumé, le registre couvre quatre départements du nord-ouest de la France (Nord, Pas-de-Calais, Somme et Seine-Maritime) (figure 1), qui comptaient 5,9 millions d’habitants au 1er janvier 2018, soit 9,1% de la population de la France métropolitaine 9. La source principale des données est constituée de l’ensemble des gastro-entérologues (GE) adultes et pédiatres de ces quatre départements (n=264), quel que soit leur mode d’exercice. Chaque GE déclare tout patient consultant pour la première fois avec des symptômes compatibles avec une MICI. Les GE sont contactés par téléphone au moins trois fois par an par un enquêteur, afin de connaître le nombre de nouveaux cas et envisager ou non la nécessité d’aller sur place. L’enquêteur se déplace ensuite sur le lieu de consultation du GE et collecte, dans un questionnaire dédié, les informations concernant chaque nouveau cas. Afin de s’assurer de la meilleure exhaustivité possible dans le recueil des cas, deux sources secondaires sont également utilisées : d’une part les données du PMSI (programme de médicalisation des systèmes d’information), d’autre part les laboratoires d’anatomo-pathologies.
 Agrandir l'image
Agrandir l'imageDes affiches et des flyers d’information à destination des patients sont fournis à chaque GE pour affichage dans leurs salles d’attente. Les procédures ont été validées par le Comité consultatif sur le traitement de l’information en matière de recherche (CCTIRS) et ont été déclarées à la Commission nationale de l’informatique et des libertés (Cnil).
Les principales données recueillies au diagnostic sont : l’âge, le sexe, la date du diagnostic, le délai diagnostique, ainsi que les données cliniques, radiologiques, endoscopiques et histologiques ayant permis de faire le diagnostic. Les examens endoscopiques et d’imagerie médicale réalisés pour faire le diagnostic sont également renseignés, permettant d’étudier l’évolution de la prise en charge diagnostique et les techniques diagnostiques utilisées par les GE en population générale. Chaque questionnaire est revu en aveugle par deux médecins experts, selon un algorithme diagnostique préétabli permettant d’établir un « diagnostic final » selon des critères diagnostiques validés et publiés 6.
La localisation digestive et le type de la MICI ont été classés selon la classification de Montréal. Pour la MC, la localisation digestive de la maladie uniquement à l’intestin grêle était notée L1, uniquement au côlon L2 et à la fois au côlon et à l’intestin grêle L3. Le type inflammatoire était classé B1, sténosant B2 et perforant B3. Pour la RCH, la localisation uniquement rectale était notée E1, au côlon gauche ne dépassant pas l’angle gauche E2, puis E3 pour extension après l’angle gauche 10.
Les données sont saisies via un serveur répondant aux qualités requises pour l’hébergement de données de santé à caractère personnel (agrément de l’Agence des systèmes d’information partagés de santé, Asip Santé). Chaque enquêteur effectue la saisie de ses propres dossiers après authentification sécurisée. La saisie des éléments d’identification d’une part et du questionnaire d’incidence d’autre part (reliés par le numéro de dossier) se fait avec chiffrement des données.
Les analyses statistiques sont effectuées grâce au logiciel SAS® version 9.4 TS level 1M1 et au logiciel R 3.2.4.
Les calculs d’incidence sont effectués sur des périodes de trois années consécutives. Ils ne prennent en compte que les diagnostics certains ou probables de MC et RCH et sont standardisés sur l’âge par méthode directe (par groupe d’âge quinquennal) sur la population type européenne 11. Les intervalles de confiance à 95% (IC95%) sont estimés par la méthode exacte, en utilisant une distribution gamma 12.
Pour étudier la répartition spatiale de l’incidence cumulée sur cette période, l’unité cantonale a été utilisée. Les résultats ont été exprimés par ratio standardisé d’incidence (SIR) et son intervalle de confiance à 95%. La variation spatiale de l’incidence de la MC entre les zones a été testée au moyen du test Potthoff-Whittinghill 13. La présence de l’autocorrélation entre les unités spatiales a été quantifiée à l’aide de l’indice de Moran (une valeur supérieure à 0 indique la présence d’autocorrélation) 14. La recherche de clusters de sur- et sous-incidence a été effectuée en utilisant la méthode des statistiques de balayage spatial elliptique 15.
Résultats
Incidence et évolution temporelle de l’incidence des MICI
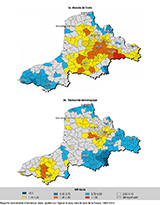
De 1988 à 2014, 19 266 cas incidents de MICI ont été recensés dans la base du registre, incluant 11 379 (59%) patients atteints de MC, 7 206 cas de RCH (37%) et 681 cas de colite chronique indéterminée (4%). Au cours de cette période, l’incidence moyenne annuelle de la MC était de 7,7/105 habitants, augmentant significativement de 5,3/105 en 1988-1990 à 7,6/105 en 2012-2014, alors que l’incidence moyenne de la RCH restait stable à 4,4/105 habitants sur toute la période 1988-2014. Nous avons mis en évidence une augmentation significative de l’incidence des MICI chez les adolescents (10-16 ans), surtout depuis 2003, de +4% par an pour la MC et +11% pour la RCH 16. Sur la totalité de la période, l’incidence de la MC chez l’adolescent (10-16 ans) est passée de 4,2/105 à 9,5/105 (+126%) et celle de la RCH de 1,6/105 à 4,1/105 (+156%) (figure 2). Dans la MC, 10% des cas étaient diagnostiqués avant l’âge de 17 ans et, dans la RCH, 5% pour cette même tranche d’âge. La fréquence de MC et de RCH pédiatriques (<17 ans au diagnostic) augmentait significativement, passant pour la MC de 10,1% de l’ensemble des cas de MC en 1988 à 13,5% en 2014 (p<10-3). Concernant la RCH, une constatation identique est faite avec une augmentation significative de la fréquence, de 4,8% de l’ensemble des cas de RCH en 1988 à 9,2% en 2014 (p<10-3) (données personnelles non publiées). Le ratio RCH/MC n’était supérieur à 1 que dans la tranche d’âge des patients de plus de 60 ans au moment du diagnostic.
 Agrandir l'image
Agrandir l'imagePrès de 80% des diagnostics de MICI étaient posés par les GE libéraux, 13% par les GE des hôpitaux généraux et 7% par ceux des CHU. Le délai médian entre le début des symptômes et le diagnostic était de 3 mois (IQR: 1-7). Le nombre de patients ayant un diagnostic posé plus de 9 mois après l’apparition des symptômes a diminué avec le temps. Depuis la création du registre, les GE réalisaient plus souvent une exploration complète du tube digestif par endoscopie et imagerie (86,5% en 2012-2014 vs 6,9% en 1988-1990 ; p<0,001).
Évolution spatiale de l’incidence des MICI
Grâce au nombre élevé de cas incidents, permettant une puissance statistique suffisante, la variation spatiale de l’incidence des MICI a été évaluée à l’unité cantonale au sein de la zone géographique du registre. Le nombre moyen cumulé de cas par canton était de 18,4 (1-183) pour la MC et 11,3 (0-148) pour la RCH. Pour les deux pathologies, il existait une hétérogénéité spatiale des SIR avec une autocorrélation significative (figure 3). La régression écologique ne retrouvait pas d’association avec l’index de défaveur sociale (index de Townsend). Quatre clusters de sur-incidence (couleurs chaudes ; RR=1,3 à 1,9) et 4 de sous-incidence (couleurs froides ; RR de 0,2 à 0,7) ont été isolés dans la MC (figure 4). Des études interventionnelles sur un mode cas-témoins sont programmées afin d’identifier des facteurs de risque environnementaux.
 Agrandir l'image
Agrandir l'image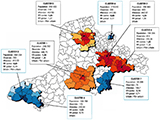 Agrandir l'image
Agrandir l'imagePhénotype au diagnostic et influence de l’âge
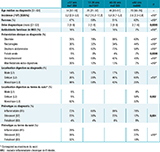
Les données du registre montrent une prédominance féminine dans la MC, avec un sexe-ratio F/H de 1,3, et masculine dans la RCH (sexe-ratio F/H=0,9). Dans les deux pathologies, la fréquence des antécédents familiaux de MICI diminue avec l’âge au diagnostic, reflétant probablement l’importance des facteurs génétiques chez les patients diagnostiqués les plus jeunes. D’une manière générale, les symptômes digestifs au diagnostic étaient moins fréquents chez les seniors, avec moins de diarrhée, de douleurs abdominales, de perte de poids, de fièvre et de manifestations extra-intestinales dans la MC (tableau 1), et moins de rectorragies et de douleurs abdominales dans la RCH (tableau 2).
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageDiscussion
Le nord-ouest de la France se caractérise par une incidence plus élevée de MC (7,7/105 en moyenne annuelle) que de RCH (4,4/105 en moyenne annuelle), alors que dans la plupart des autres pays européens l’incidence de la RCH est supérieure à celle de la MC 17.
Cette prédominance de la MC sur la RCH dans notre pays avait déjà été rapportée en 2006. Une incidence « médico-sociale », calculée à partir de la base médico-administrative des affections de longue durée (ALD), avait été évaluée par département pour les MICI entre le 1er janvier 2000 et le 31 décembre 2002. Pour toute la France, l’incidence « médico-sociale » de la MC était de 8,2/105 habitants et celle de la RCH de 7,2/105. Un gradient nord-sud avait été retrouvé pour la MC alors que la répartition des incidences de RCH était homogène dans tout le pays 18.
En Europe, la RCH a été la première des MICI à apparaître dans les années 1950 et, après avoir augmenté jusque dans les années 1980, son incidence est, dans l’ensemble, restée stable dans les centres où l’enregistrement des cas incidents a pu être poursuivi suffisamment longtemps comme en Écosse 19, en Suède 20 ou en Allemagne 21. La MC est apparue 10 à 15 ans plus tard, et son incidence a augmenté spectaculairement en Europe depuis les années 1970. Notre registre ayant débuté en 1988, il est possible que nous nous situions après le point d’inflexion, quand l’incidence de la MC a dépassé celle de RCH. Les études prospectives d’incidence en population générale sont tellement rares qu’il est en fait difficile de comparer nos résultats à ceux d’autres études. Ainsi, dans la littérature, l’amplitude de l’augmentation d’incidence varie de un à dix suivants les zones géographiques d’un même continent et bien sûr selon les méthodes d’enregistrement. Dans les pays émergents où les MICI apparaissent depuis les années 1990, le même scénario est observé 22.
Les données du registre montrent une prédominance féminine dans la MC et masculine dans la RCH, sauf chez l’enfant où l’inverse est observé, ce qui est concordant avec la littérature mais reste inexpliqué 23. Le rôle des hormones est très discuté 23.
Notre étude a montré une hétérogénéité spatiale significative des MICI et surtout de la MC dans le nord de la France au cours de la période 1988-2014. Cette hétérogénéité nous semble réelle et non liée à la méthode utilisée par le registre. En effet, un « contrôle de la fuite » est en partie effectué par le contact, une fois par an, des cabinets et services de gastroentérologie des zones géographiques limitrophes extra-registre situées dans l’Eure, l’Aisne et l’Oise afin de recueillir les dossiers des patients consultant dans ces départements alors qu’ils demeurent dans l’aire géographique du registre. La base nationale du PMSI est également utilisée depuis 2015. D’autre part, les zones de sur-incidence et sous-incidence sont différentes dans les deux pathologies avec une sur-incidence de la RCH en Seine-Maritime. Or ces deux pathologies inflammatoires de l’intestin se présentent de façon similaire.
En utilisant les statistiques d’analyse spatio-temporelle, quatre clusters de sur-incidence et quatre clusters de sous-incidence ont été identifiés. Cette méthode de statistiques de balayage spatial a déjà été utilisée précédemment dans des pathologies chroniques et notamment les MICI. Ainsi une étude réalisée au Canada a montré l’existence de clusters de sur-incidence de MC dans la ville de Winnipeg. Ces sur-risques de développer une MC étaient associés négativement avec les risques d’infections entériques saisonnières, argumentant l’hypothèse sur le rôle de l’hygiène dans le développement de la MC 24.
L’augmentation des cas pédiatriques de MICI, en particulier de la MC, est un phénomène mondial. Dans une revue exhaustive 25 des données d’incidence des MICI pédiatriques, parmi 28 études utilisables sur 139 publiées, 78% rapportaient une augmentation d’incidence dont 60% pour la MC et 20% pour la RCH. La Finlande a enregistré une augmentation des cas pédiatriques prédominant sur la RCH : de 1987 à 2003 l’incidence des MICI est passée de 3,9 à 7,0/105, dont 52% de RCH et 34% de MC 26.
Dans notre registre, le délai médian entre l’apparition des symptômes et le diagnostic ne varie pas depuis 30 ans (3 mois dans la MC et 2 mois dans la RCH) ; ce n’est donc pas un diagnostic plus précoce qui pourrait expliquer cette augmentation d’incidence 16.
Cette importante augmentation notamment de l’incidence de la RCH chez l’adolescent et l’adulte jeune pourrait être associée à l’effondrement du taux d’appendicectomie dans notre région depuis les années 2000. En effet, l’appendicectomie est un facteur protecteur déjà démontré de la RCH, sans que l’on connaisse son mode d’action 27. L’augmentation de l’incidence des MICI dans cette jeune population pourrait également être associée à une prescription d’antibiotiques dans l’enfance, plus importante dans la région nord-ouest de la France qu’au niveau national, susceptible de modifier l’écologie du microbiote et d’être à l’origine de ces pathologies inflammatoires chroniques 28,29.
L’apparition de cas incidents de MICI à un âge >60 ans est une réalité, démontrée au sein du registre Epimad et, depuis 2014, dans plusieurs autres études 30,31,32. Dans la région de notre étude, 9% des cas incidents avaient >60 ans, 11% des RCH et 5% des MC représentant une incidence standardisée sur le sexe dans cette tranche d’âge de 3,1 pour la RCH et 2,6 pour la MC. C’est dans cette seule tranche d’âge (>60 ans) que le ratio RCH/MC était >1 ; la RCH étant la plus fréquente des MICI chez les seniors 31. La différence de présentation clinique des MICI selon l’âge diagnostique peut être expliquée par une différence de localisation digestive. En effet, la MC diagnostiquée chez le senior était caractérisée par la prédominance de la localisation colique pure (L2) et du phénotype inflammatoire (B1), alors que les patients diagnostiqués à l’âge pédiatrique présentent plus souvent une localisation étendue iléocolique et un phénotype un peu plus compliqué (fistulisant ou sténosant). Pour la RCH, une localisation pancolique de la maladie était observée plus fréquemment chez les sujets les plus jeunes.
Conclusions et perspectives
Depuis 1988, le registre Epimad a construit un réseau ville-hôpital unique. Cette coopération permet de mener d’importants travaux témoignant du réel poids des MICI dans notre pays et de mieux connaitre l’incidence, son évolution au cours du temps et de l’espace ainsi que l’évolution de la maladie. La mise en évidence de clusters de sur-incidences et sous-incidences incite aujourd’hui à mettre en place de nouveaux travaux d’épidémiologie analytique dont l’objectif principal sera d’étudier des hypothèses, en particulier environnementales, à l’origine de ces pathologies.
Remerciements
Les auteurs remercient les enquêteurs du registre Epimad ainsi que tous les gastro-entérologues adultes et pédiatriques participant ou ayant participé au registre depuis sa création.
Références
458-66.
J Clin Epidemiol. 2014;67(8):887-96.
(1988-2007). Aliment Pharmacol Ther. 2011;33(10):1133-42.
57-68.




