Part et conséquences du diagnostic tardif de l’infection par le VIH aux Antilles françaises
// Proportion and consequences of late HIV diagnosis in French West Indies
Résumé
Objectif –
Mesurer la fréquence des diagnostics tardifs de l’infection par le VIH parmi les patients de la cohorte Dat’AIDS aux Antilles françaises (Martinique et Guadeloupe) et décrire leurs caractéristiques et leur évolution clinique et biologique par comparaison avec les patients diagnostiqués au même stade en France métropolitaine (16 centres).
Méthodes –
Les données des patients de la cohorte Dat’AIDS dont la date de diagnostic était comprise entre le 1er janvier 2014 et le 31 décembre 2015 ont été extraites. Les patients ont été classés en « Antilles » et « métropole » en fonction du centre dans lequel ils ont consulté après leur premier test de dépistage positif. Les variables démographiques initiales, les conditions du dépistage, l’évolution clinique et biologique des deux groupes ont été comparées à 6 et 12 mois du diagnostic. Le diagnostic à un stade avancé était défini par des CD4<200/mm3 au moment du diagnostic ou un sida dans les trois mois suivants.
Résultats –
Les analyses ont porté sur 2 597 patients, dont 254 diagnostiqués aux Antilles. Le diagnostic à un stade avancé concernait 36,6% des patients aux Antilles et 28,8% des patients en métropole (p=0,009). Le délai de mise sous traitement était plus long aux Antilles qu’en métropole : 34 jours en médiane (IQR 20-49) vs 24 jours (IQR 14-44), p=0,002. La proportion de patients ayant une charge virale <50 copies/ml à 6 mois était de 75,7%, sans différence entre les deux groupes.
Conclusion –
La fréquence du diagnostic à un stade avancé de l’infection par le VIH était plus importante aux Antilles qu’en métropole. L’évolution clinique et virologique des patients diagnostiqués à un stade avancé n’était pas différente entre les deux régions.
Abstract
Objective –
To measure the frequency of late HIV diagnosis among patients in the Dat’AIDS cohort in the French West Indies (Martinique and Guadeloupe), and describe their characteristics, their clinical and biological evolution, compared to patients diagnosed at the same stage in metropolitan France (16 centres).
Methods –
Data from patients from the Dat’AIDS cohort who had been diagnosed with HIV between 01/01/2014 and 31/12/2015 were selected. They were classified as “French West Indies” or as “Metropolitan” depending on the center where they consulted after the first positive diagnosis. The initial demographic variables, the reason for testing, the clinical and biological evolutions were compared after 6 and 12 months of diagnosis. “Diagnosis at an advanced stage of the disease” was defined as a CD4 count less than 200 cells/mm3 at the time of diagnosis or an AIDS defining condition in the first 3 months.
Results –
We studied 2,597 patients, including 254 diagnosed in the French West Indies. Diagnosis at an advanced stage of the disease was more frequent in French West Indies: 36.6% versus 28.8% of metropolitan patients (p=0.009). Time between diagnosis and treatment was longer in the French West Indies than in metropolitan France: median of 34 days (IQR 20-49) versus 24 days (IQR 14-44), p=0.002. The proportion of patients with a viral load <50 copies/ml after 6 months was of 75.7%, with no difference between groups.
Conclusion –
The frequency of advanced diagnosis of HIV infection was greater in the West Indies than in metropolitan France. The clinical and virological course of these patients was not different between the two regions.
Introduction
L’arsenal préventif vis-à-vis de l’infection par le virus de l’immunodéficience humaine (VIH) comporte i) la protection des personnes indemnes par l’usage du préservatif et les traitements pré- et post-exposition ; et ii) le traitement des personnes vivant avec le VIH afin d’atteindre une charge virale plasmatique indétectable, ce qui réduit considérablement le risque de transmission du virus. La connaissance par chacun de son statut vis-à-vis du VIH, accompagnée des mesures adéquates, est donc la pierre angulaire de cette prévention.
La part des diagnostics faits à un stade avancé de la pathologie 1 est estimée à 30% environ des nouveaux diagnostics, et cette proportion reste stable dans le temps depuis 2013 2. Les caractéristiques des sujets accédant tardivement au dépistage sont décrites en France depuis plus de 10 ans 3, mais les différentes actions de santé publique mises en œuvre pour réduire ce retard au diagnostic, en particulier depuis 2010 les recommandations d’élargissement du dépistage à tous les adultes une fois dans leur vie 4,5,6, ne semblent plus permettre d’en diminuer la proportion.
Les Antilles françaises sont une des régions de France où le taux de découvertes de séropositivité VIH est la plus élevée 2. Les caractéristiques des patients nouvellement diagnostiqués aux Antilles, ainsi que la fréquence du retard au diagnostic, ses caractéristiques et les conséquences pour les patients antillais méritent d’être mieux connues afin d’adapter les campagnes d’incitation au dépistage.
Notre objectif était de comparer la population récemment diagnostiquée aux Antilles à celle diagnostiquée en France métropolitaine pendant la même période et, plus spécifiquement, de mesurer la fréquence des diagnostics tardifs de l’infection par le VIH dans les deux centres de Martinique et Guadeloupe et décrire leurs caractéristiques ainsi que leur évolution clinique et biologique par comparaison avec les patients diagnostiqués au même stade en France métropolitaine (16 centres).
Méthode
La cohorte Dat’AIDS est constituée à partir des bases de données du dossier médical informatisé Nadis® de 18 centres français répondant aux exigences du contrôle qualité 7. Parmi ces 18 centres, deux se trouvent aux Antilles françaises (Martinique et Guadeloupe). Les patients de la cohorte dont la découverte de séropositivité se situait entre le 1er janvier 2014 et le 31 décembre 2015 et qui avaient consulté au moins une fois dans un des centres participants ont été classés en « diagnostic à un stade avancé de la maladie » si leur taux de lymphocytes CD4 au moment du diagnostic était <200/mm3 ou s’ils présentaient une manifestation clinique de sida dans les 3 mois suivant le dépistage 1. Les patients pour lesquels la base de données ne comportait pas de valeur de CD4 ni d’évènement classant sida dans les trois mois suivant la date de diagnostic ont été exclus. Pour l’analyse, les données ont été censurées au 31 décembre 2016 afin d’avoir au moins un an de recul sur l’évolution des patients. Les caractéristiques au moment du diagnostic, l’évolution clinique (sida au-delà des trois premiers mois de prise en charge), immunologique (proportion de patients ayant des CD4>200/mm3) et virologique (charge virale VIH plasmatique indétectable) après 6 et 12 mois de prise en charge sont décrites pour tous les patients diagnostiqués pendant la période d’étude, puis comparées, pour les patients diagnostiqués à un stade avancé, entre ceux diagnostiqués aux Antilles et ceux diagnostiqués en France métropolitaine.
Le délai entre diagnostic et premier traitement a été calculé par la différence des dates des deux évènements. La co-infection par le virus de l’hépatite B a été définie par la présence d’antigène HBs et la co-infection par le virus de l’hépatite C par une sérologie positive.
En cas de déménagement hors des Antilles en cours de suivi, les patients sont restés classés dans leur groupe initial.
Les variables qualitatives ont été comparées entre les groupes à l’aide du test du Chi2 ; les variables quantitatives sont décrites par leur médiane, premier et troisième quartile (IQR), et comparées à l’aide du test de Kruskal-Wallis. Les analyses ont été réalisées à l’aide de R (The R Foundation for Statistical Computing). Le contrôle de qualité des bases de données avant importation dans la cohorte impose une exhaustivité des données démographiques, de la date de diagnostic de VIH, du mode de transmission, de la date de mise sous traitement et de la mesure de la charge virale et du taux de CD4 au moins une fois par semestre. En revanche, la variable « motif de dépistage » n’est pas obligatoire, et l’interprétation des résultats doit en tenir compte. La proportion de valeurs manquantes est indiquée dans les résultats.
Résultats
Population des patients diagnostiqués en 2014 et 2015
La cohorte comportait 2 970 patients pour lesquels le diagnostic d’infection par le VIH a été porté entre le 1er janvier 2014 et le 31 décembre 2015. Parmi eux, 373 (14 diagnostiqués aux Antilles et 359 en métropole) ont été exclus de l’analyse en raison de l’absence de valeur de CD4 ou d’évènement classant sida dans les 3 mois suivant la date de diagnostic, rendant impossible la classification du moment du diagnostic. Les patients exclus ne différaient pas des patients analysés pour l’âge, le sexe ou le mode de transmission.
L’analyse a porté sur 2 597 patients diagnostiqués entre le 1er janvier 2014 et le 31 décembre 2015, dont 254 aux Antilles. Le tableau présente les caractéristiques des patients au moment du diagnostic. Les patients diagnostiqués aux Antilles étaient plus souvent infectés par voie hétérosexuelle et moins souvent co-infectés par les virus des hépatites que ceux diagnostiqués en métropole. Le diagnostic à un stade avancé, concernant 29,6% de la population totale, était plus fréquent aux Antilles qu’en métropole (36,6% vs 28,8% respectivement, p=0,009). Aux Antilles, le dépistage était plus souvent réalisé en raison de signes cliniques évocateurs d’infection par le VIH : 42,3% vs 33,0% en métropole (p<0,0001), mais il faut noter la part importante d’informations manquantes pour les patients dépistés en métropole. La proportion de diagnostics réalisés après un test rapide d’orientation diagnostique (TROD) était de 6,2% aux Antilles et de 9,8% en métropole (p=0,006).
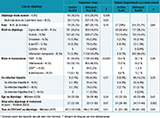 Agrandir l'image
Agrandir l'imageLe délai médian entre diagnostic et premier traitement antirétroviral était de 37 jours (IQR 22-59) aux Antilles et de 32 jours (IQR 15-63) en métropole (p=0,01). Après 6 mois de prise en charge, la proportion de patients ayant des CD4>200/mm3 était plus basse aux Antilles : 76,6% vs 87,5% en métropole (p<0,001) ; la charge virale était indétectable (<50 copies/ml) chez 85,0% des patients aux Antilles et 85,3% des patients en métropole (p=0,92). Après 12 mois de prise en charge, la proportion de patients ayant des CD4>200/mm3 était comparable dans les deux populations (84,7% et 88,7%, p=0,13) ; la charge virale était indétectable chez 86,9% des patients aux Antilles et 91% des patients en métropole (p=0,10).
Après un suivi médian de 19 mois (IQR 13-26), 83,5% des patients diagnostiqués aux Antilles étaient toujours suivis dans le même centre, 5,9% avaient changé de centre de prise en charge, 8,7% étaient perdus de vue et 1,6% étaient décédés. Pour les patients diagnostiqués en métropole ces proportions étaient respectivement de 86,0% ; 5,6% ; 7,3% et 1,1% (p=0,03 entre les deux régions).
Patients diagnostiqués à un stade avancé de la maladie
Les caractéristiques d’âge, de sexe et de mode de contamination au moment du diagnostic, décrites dans le tableau, ne différaient pas entre les deux territoires. Il s’agissait majoritairement d’hommes se déclarant hétérosexuels (65,1% des hommes diagnostiqués tardivement). La proportion de diagnostics à un stade avancé de la maladie réalisés après un TROD était de 6,9% aux Antilles et 10,6% en métropole (p=0,51).
Le délai médian entre diagnostic et premier traitement antirétroviral était de 34 jours (IQR 20-49) aux Antilles et de 24 jours (IQR 14-44) en métropole (p=0,002). La proportion de patients déclarant un sida au-delà des trois premiers mois de prise en charge était de 3,2% aux Antilles et 1,9% en métropole (p=0,41). Après six mois de prise en charge, la proportion de patients ayant des CD4>200/mm3 était de 50,8% aux Antilles et de 59,7% en métropole (p=0,19) ; après un an ces proportions étaient respectivement de 70,3% et 70,8% (p=0,94). Après six mois de prise en charge, la charge virale était indétectable (<50 copies/ml) chez 82,0% des patients aux Antilles et 74,7% en métropole (p=0,22).
Après un suivi médian de 19 mois (IQR 13-26), 86,0% des patients diagnostiqués aux Antilles étaient toujours suivis dans le centre, 3,2% avaient changé de centre de prise en charge, 6,5% étaient perdus de vue et 3,2% étaient décédés. Ces proportions pour les patients diagnostiqués en métropole étaient respectivement de 85,2% ; 4,4% ; 7,3% et 3,1% (p=0,10 entre les deux territoires).
Discussion
Les caractéristiques de la population diagnostiquée dans les centres métropolitains étaient assez proches de celles de l’ensemble des cas diagnostiqués dans les mêmes années en France 2. En revanche, dans la population diagnostiquée aux Antilles la transmission du VIH était plus fréquemment hétérosexuelle que dans les centres métropolitains (59,1% aux Antilles vs 40,8% en métropole, p<0,0001). La part des hommes ayant des rapports avec des hommes (HSH), bien que moins importante aux Antilles qu’en métropole (35,8 vs 49,6%), impose de maintenir les efforts de dépistage envers cette population dans tous les territoires. Ces différences, ainsi que la faible proportion de patients porteurs de co-infection par un virus hépatotrope, déjà décrites par les analyses des déclarations obligatoires, sont confirmées dans notre population 8.
Le diagnostic à un stade avancé de la maladie était plus fréquent aux Antilles que dans les centres métropolitains (36,6 et 28,8% respectivement, p=0,009), dans lesquels on observait une fréquence proche de celle décrite au niveau national 2. La proportion de patients présentant une pathologie classant sida dans les trois mois suivant le diagnostic était également plus élevée aux Antilles (15,4% vs 10,1% en métropole, p=0,03). La population diagnostiquée à un stade avancé de la maladie aux Antilles était majoritairement hétérosexuelle, constituée à 70% d’hommes et dont le dépistage a été réalisé en raison de signes cliniques évocateurs (69% des cas). Les données nationales pour la période 2014-2015 retrouvaient, en Martinique, une part des découvertes au stade sida plus élevée chez les hétérosexuels que chez les personnes avec un autre mode de contamination, elle-même plus élevée que chez les homosexuels. En Guadeloupe, cette part était équivalente entre les personnes ayant un autre mode de contamination et les hétérosexuels, mais moindre chez les homosexuels 8.
Il est sans doute trop tôt pour que les nouveaux moyens de dépistage (TROD et autotests) aient atteint la population « cachée » de l’épidémie. Cependant, il convient sans doute de réfléchir à élargir les actions de dépistage communautaire. Les données de la littérature indiquent qu’il faudra dépister davantage d’hommes hétérosexuels si l’on veut voir diminuer la fréquence du diagnostic tardif 9. Aux Antilles comme en métropole, nos résultats sont en accord avec cela. L’analyse des diagnostics tardifs montre qu’ils sont plus fréquents chez les hommes hétérosexuels que chez les HSH ou chez les femmes 3. L’application des recommandations de proposition de dépistage devrait aider à dépister ces hommes 5.
L’évolution clinique et biologique des patients diagnostiqués à un stade avancé de la pathologie reste préoccupante, à une époque où les traitements sont efficaces, bien tolérés et plus faciles à suivre. Le délai entre diagnostic et première prescription d’antirétroviraux est plus long aux Antilles, en particulier dans la population dépistée tardivement. Cette différence peut être expliquée par la nécessaire évaluation clinique (en particulier afin d’éliminer une tuberculose évolutive) chez les patients antillais. Il ne semble pas que ce délai allongé soit délétère, au regard des évolutions immuno-virologiques comparables entre les territoires. Cependant, au vu des résultats récemment publiés 10,11,12, il pourra être intéressant d’étudier si la modification de ce délai est bénéfique ou péjorative pour l’évolution des patients.
La proportion de patients ayant un taux de CD4 >200/ mm3 après six mois de prise en charge était plus faible aux Antilles (76,6% vs 87,5% en métropole, p<0,001). Cela traduit sans doute, sur l’ensemble de la population, le poids de la part des patients débutant leur prise en charge à un stade avancé de la maladie. La proportion de patients ayant une charge virale contrôlée après six mois de prise en charge est comparable entre Antilles et métropole, mais reste inférieure à l’objectif de 90%. La proportion de patients perdus de vue, comparable entre Antilles et métropole, doit inciter à la mise en œuvre d’actions pour ramener ces patients dans le soin, quel que soit le territoire de prise en charge.
La taille de la cohorte Dat’AIDS et la répartition des centres sur le territoire français permet d’estimer que la population suivie est assez représentative de la population suivie en France, notre population étant très proche de la base de données hospitalières française sur l’infection à VIH (cohorte FHDH-ANRS CO4), dont elle représente une large part. Les centres antillais prennent en charge la quasi-totalité des personnes vivant avec le VIH dans les départements concernés. Une des principales limites de notre étude est de n’avoir étudié que les patients ayant eu au moins un recours aux soins après le diagnostic. Il nous est impossible de savoir quelle proportion des patients a été diagnostiquée sans être ensuite prise en charge. Le choix de considérer la France métropolitaine comme une région homogène est réducteur et ne tient pas compte des différences régionales. Selon les données de Santé publique France, la part des diagnostics faits à un stade avancé est relativement comparable dans les régions métropolitaines et toujours plus faible qu’aux Antilles 13.
En conclusion, la fréquence du diagnostic tardif était plus importante aux Antilles qu’en métropole, mais l’évolution clinique et virologique de ces patients diagnostiqués à un stade avancé n’était pas différente entre ces deux territoires. Une réflexion sur les populations à cibler par des actions d’incitation au dépistage doit être menée pour mieux atteindre les personnes séropositives qui s’ignorent. Des actions pour limiter le nombre de patients perdus de vue doivent être menées dans tous les territoires.
Le groupe Dat’AIDS
C. Drobacheff-Thiébaut, A. Foltzer, K. Bouiller, L. Hustache-Mathieu, C. Chirouze, Q. Lepiller, F. Bozon, O. Babre, P. Muret (Besançon) ; H. Laurichesse, O. Lesens, M. Vidal, N. Mrozek, C. Aumeran, O. Baud, V. Corbin, P. Letertre, S. Casanova, C. Jacomet (Clermont-Ferrand) ; B. Hoen, I. Lamaury, I. Fabre, E. Curlier, R. Ouissa, K. Schepers, C. Herrmann-Storck, N. Dournon (Guadeloupe) ; D. Merrien, P. Perré, T. Guimard, O. Bollangier, S. Leautez, M. Morrier (La Roche sur Yon) ; F. Ader, F. Biron, A. Boibieux, L. Cotte, T. Ferry, P Miailhes, T. Perpoint, S. Roux, S. Degroodt, C. Brochier, F. Valour, C. Chidiac (Lyon) ; C. Dhiver, M. Saadia Mokhtari, A. Ménard, H. Tissot Dupont, C. Toméi, L. Meddeb, A.Y. Belkhir, I. Ravaux (Marseille – Hôpital Nord) ; S. Brégigeon, O. Zaegel-Faucher, V. Obry-Roguet, M. Orticoni, M.J. Soavi, I. Luquet-Besson, E. Ressiot, M. Carta-Padovani, M.J. Ducassou, H. Bertone, S. Galie, A. Galinier, M. Monclar, A.S. Ritleng, A. Ivanova, C. Blanco-Betancourt, C. Lions, I. Poizot-Martin (Marseille-Hôpital Ste Marguerite) ; S. Abel, R. Césaire, G. Dos Santos, L. Fagour, M. Illiaquer, F. Najioullah, D. Nguyen, M. Ouka, S. Pierre-François, J. Pasquier, M. Pircher, B. Rozé, A. Cabié (Martinique) ; N. Atoui, V. Le Moing, A. Makinson, N. Meftah, C. Merle de Boever, B. Montes, A. Montoya Ferrer, J. Reynes (Montpellier) M. André, L. Boyer, MP. Bouillon, M. Delestan, T. May (Nancy) ; C. Allavena, C. Bernaud, E. Billaud, C. Biron, B. Bonnet, S. Bouchez, D. Boutoille, C. Brunet-Cartier, N. Hall, T. Jovelin, P. Morineau, V. Reliquet, H. Hue, S. Sécher, M. Cavellec, A. Soria, V. Ferré, E. André-Garnier, A. Rodallec, L. Le Guen, M. Lefebvre, O. Grossi, P. Point, O. Aubry, L. Khatchatourian, F. Raffi (Nantes) ; P. Pugliese, S. Breaud, C. Ceppi, J. Courjon, E. Cua, J. Cottalorda, P. Dellamonica, E. Demonchy, A. De Monte, J. Durant, C. Etienne, S. Ferrando, J. G. Fuzibet, R. Garraffo, A. Joulie, K. Risso, V. Mondain, A. Naqvi, N. Oran, I. Perbost, S. Pillet, B. Prouvost-Keller, C. Pradier, S. Wehrlen-Pugliese, V. Rio, E. Rosenthal, S. Sausse, G. Zouzou. (Nice) ; L. Hocqueloux (Orléans) A. Cheret, C. Goujard, Y. Quertainmont, E. Teicher, N. Lerolle, D. Vittecoq, O. Deradji, F. Fourreau, C. Pallier, A. Barrail-Tran (Paris Hôpital Bicêtre) ; R. Landman, V. Joly, C. Rioux, S. Lariven, A. Gervais, F.X. Lescure, S. Matheron, F. Louni, C. Godard, Z. Julia, M. Chansombat, D. Rahli, C. Mackoumbou-Nkouka, C. Charpentier, D. Descamps, G. Peytavin, Y. Yazdanpanah (Paris-Hôpital Bichat) ; P.H. Consigny, G. Cessot, P. Bossi, J. Goesch, J. Gilquin, G. Benabdelmoumen, F. Lanternier, C. Charlier, K. Amazzough, B. Henry, B. Pilmis, C. Rouzaud, M. Morgand, F. Touam, C. Louisin, C. Duvivier, O. Lortholary, R. Guery, F. Danion, J. Lourenco, P. Parize, N. Etienne, M. Launay, C. Rouzioux, V. Avettand Fenoel (Paris-Pasteur Necker) M.A. Valantin, P. Flandre, F. Caby, R. Tubiana, R. Agher, S. Seang, L. Schneider, R. PaLich, C. Blanc, C. Katlama (Paris – Hôpital Pitié Salpêtrière), J.L. Berger, Y. N’Guyen, D. Lambert, D. Lebrun, I. Kmiec, M. Hentzien, V. Brodard, F. Bani-Sadr (Reims) ; E. Botelho-Nevers, A. Gagneux-Brunon, A. Frésard, F. Lucht (Saint-Etienne) ; P. Fischer, M. Partisani, C. Cheneau, M. Priester, M.L. Batard, C. Bernard-Henry, E. de Mautort, D. Rey (Strasbourg) ; M. Alvarez, N. Biezunski, A. Debard, C. Delpierre, P. Lansalot, L. Lelièvre, G. Martin-Blondel, D. Metsu, M. Piffaut, L. Porte, K. Saune, P. Delobel (Toulouse) ; F. Ajana, I. Alcaraz, V. Baclet, A. Boucher, P. Choisy, T. Huleux, B. Lafon-Desmurs, H. Melliez, A. Meybeck, A. Pasquet, M. Pradier, O. Robineau, N. Viget, M. Valette (Tourcoing).
Références
Corevih_Janvier2018.pdf




