Évolutions de la morbidité et de la mortalité liées au tabagisme chez les femmes en France métropolitaine : une situation préoccupante
// Trends of smoking-related morbidity and mortality in women in metropolitan France: an alarming situation
Résumé
Introduction –
La prévalence du tabagisme chez les femmes est en constante augmentation depuis le début des années 1970. Cet article propose d’en décrire l’impact, en France métropolitaine, sur les évolutions récentes de la morbi-mortalité de trois pathologies très liées au tabagisme (le cancer du poumon, la bronchopneumopathie chronique obstructive (BPCO) et l’infarctus du myocarde) et sur le nombre de décès attribuables au tabagisme pour toutes les pathologies liées au tabac.
Méthodes –
Les données de prévalence du tabagisme sont issues d’enquêtes en population générale par quotas (1974-1991), puis du Baromètre santé (1992-2017). Les données de morbidité proviennent des données d’hospitalisation du PMSI-MCO pour l’infarctus du myocarde et les exacerbations de BPCO, et des données des registres de cancer pour les estimations de l’incidence du cancer du poumon. Les données de mortalité sont extraites de la base nationale des causes médicales de décès. Les décès attribuables au tabagisme ont été calculés en combinant des données de mortalité, des taux de décès par cancer du poumon et des risques relatifs ajustés de décès associés au tabagisme.
Résultats –
L’incidence du cancer du poumon a augmenté de 72% chez les femmes entre 2002 et 2012, tandis qu’elle est restée stable chez les hommes. Pour les exacerbations de BPCO, l’incidence des patients hospitalisés a doublé entre 2002 et 2015 chez les femmes et augmenté de 30% chez les hommes. Pour l’infarctus du myocarde avant 65 ans, l’incidence a augmenté de 50% entre 2002 et 2015 chez les femmes et de 16% chez les hommes. De la même manière, la mortalité par cancer du poumon et BPCO a augmenté respectivement de 71% et 3% chez les femmes et diminué de 15% et 21% chez les hommes. Les augmentations les plus importantes de la prévalence du tabagisme et de la morbi-mortalité étaient observées chez les femmes de 45 à 64 ans. Enfin, le nombre estimé de décès attribuables au tabagisme a été multiplié par deux entre 2000 et 2014 chez les femmes.
Conclusion –
L’augmentation de la prévalence du tabagisme chez les femmes depuis les années 1970 a des répercussions majeures sur la morbi-mortalité des pathologies liées au tabac. Il est nécessaire de poursuivre les efforts portés sur la prévention du tabagisme en France et d’explorer la possibilité d’une aide à l’arrêt individuelle en fonction du sexe.
Abstract
Introduction –
The prevalence of smoking among women has been steadily increasing since the beginning of the 1970s. This study aims to describe the impact of tobacco on recent temporal trends in morbidity and mortality of 3 smoking-related diseases (lung cancer, chronic obstructive pulmonary disease (COPD) and myocardial infarction) and in the numbers of deaths attributable to tobacco for all tobacco-related conditions in metropolitan France.
Methods –
Smoking prevalence data were based on quota-sampling surveys (1974-1991) and population-based surveys (the Health Barometer 1992-2017). Morbidity was assessed through data on hospital admissions (PMSI-MCO) for myocardial infarction and COPD exacerbation, and through cancer registry data for lung cancer incidence estimates. Data on mortality came from the national database on medical causes of death. Smoking-related deaths were calculated by combining mortality data, lung cancer death rates, and adjusted relative risks of smoking-associated deaths.
Results –
The incidence of lung cancer increased by 72% among women between 2002 and 2012 while it remained stable among men. For COPD exacerbations, the incidence of hospitalized patients doubled between 2002 and 2015 in women and increased by 30% in men. For myocardial infarction before the age of 65, the incidence increased by 50% between 2002 and 2015 in women and by 16% in men. Likewise, mortality from lung cancer and COPD increased by 71% and 3% respectively among women and decreased by 15% and 21% among men. The highest increases in the prevalence of smoking and morbi-mortality were observed among women aged 45 to 64 years. Finally, the estimated number of women who died as a result of smoking doubled between 2000 and 2014.
Conclusion –
The increase in the prevalence of smoking among women since the 1970s has a major impact on the morbidity and mortality of tobacco-related diseases. It is necessary to maintain efforts in smoking prevention in France and to explore the possibility of gender-specific smoking cessation support.
Introduction
Dans les pays industrialisés, le tabagisme est la première cause de décès évitables et il est associé à un fardeau sanitaire considérable 1. Jusque dans les années 1950, fumer était une pratique marginale chez les femmes. Mais les comportements évoluant, les femmes sont progressivement entrées dans le tabagisme dans la seconde moitié du siècle dernier, pour atteindre aujourd’hui un niveau de consommation proche de celui des hommes 2. Cible privilégiée des industries du tabac, celles-ci ont usé de tous les artifices marketing pendant des décennies pour promouvoir leur produit auprès des femmes 3. En développant une image glamour et raffinée à travers la mode, la publicité, le cinéma ou la télévision, l’industrie du tabac s’est employée à façonner une image sociale positive de la cigarette auprès des femmes. Elle s’est également adaptée à ce nouveau marché en proposant des produits destinés spécifiquement aux femmes tels que les cigarettes aromatisées ou les cigarettes « slim ». Utilisant à leur avantage la pression sociale à rester minces pour les femmes, les publicitaires ont présenté la cigarette comme un moyen de contrôle de leur poids 4. Enfin, les publicitaires ont aussi utilisé l’argument de leur émancipation, pour inciter les femmes à fumer comme un moyen d’affirmer symboliquement leur égalité avec les hommes 4. Ils ont par ailleurs financé des associations défendant l’émancipation des femmes en politique et dans les entreprises, de même que celles défendant l’émancipation des femmes issues de minorités 4.
En France comme ailleurs, la conséquence de ce changement de comportements a été une progression de la prévalence du tabagisme féminin depuis 50 ans. En 2017, 24% des femmes de 18 à 75 ans déclaraient fumer quotidiennement contre 30% des hommes, et la tendance est relativement stable depuis les années 2000 5.
Il a été montré que, pour une même quantité de tabac consommée, les femmes avaient un risque d’infarctus du myocarde et de bronchopneumopathie chronique obstructive (BPCO) plus élevé que les hommes 6,7. Toutefois, concernant le cancer du poumon, des études ont montré des résultats discordants 8,9,10. Pour les femmes qui associent tabac et pilule contraceptive, le risque de problèmes vasculaires augmente significativement 11. Le tabagisme est aussi associé au risque d’infertilité féminine 12 et est à l’origine de nombreuses complications survenant pendant la grossesse ou le post-partum 13.
L’objectif de cet article est de décrire les tendances, depuis le début des années 2000, d’indicateurs de morbidité et de mortalité associés au tabagisme, par sexe, en lien avec l’évolution de la prévalence du tabagisme. La morbidité et la mortalité ont été analysées pour trois pathologies pour lesquelles le tabagisme est un facteur de risque majeur et qui constituent un marqueur des conséquences de l’épidémie de tabagisme dans la population : l’infarctus du myocarde, la BPCO et le cancer du poumon. Enfin, pour chaque sexe, des tendances récentes des décès attribuables au tabac pour toutes les pathologies causalement associées au tabagisme ont été estimées.
Méthodes
Prévalence du tabagisme
La prévalence du tabagisme quotidien a été mesurée par des enquêtes en population générale par quotas entre 1974 et 1991. Des enquêtes aléatoires, les Baromètres santé, ont ensuite été menées de 1992 à 2000 par le Comité français d’éducation pour la santé (CFES), puis par l’Institut national de prévention et d’éducation pour la santé (Inpes) et, depuis 2016, par Santé publique France. Les Baromètres santé abordent les attitudes et comportements de santé des Français. Ces enquêtes sont menées par téléphone auprès d’échantillons représentatifs de la population résidant en France métropolitaine et parlant le français 14. Elles ont été menées auprès de différentes tranches d’âge selon les années, avec comme tranche d’âge commune à toutes les enquêtes les personnes âgées de 18 à 75 ans.
Morbidité des principales pathologies liées au tabac
La morbidité liée à l’infarctus du myocarde et à la BPCO a été étudiée au travers des hospitalisations pour infarctus du myocarde ou pour exacerbation de BPCO, extraites de la base nationale du Programme de médicalisation des systèmes d’information en médecine, chirurgie, obstétrique (PMSI-MCO). Pour chaque année de la période d’étude (2002-2015), les patients âgés d’au moins 35 ans, résidant en France métropolitaine et hospitalisés, au moins une fois dans l’année, dans un hôpital public ou privé pour un infarctus du myocarde ou une exacerbation de BPCO ont été sélectionnés. Pour les patients hospitalisés plusieurs fois au cours d’une année pour un même motif, seul le premier séjour a été conservé. Les séjours de moins de deux jours dont l’issue n’était pas le décès ont été exclus. Les séjours pour infarctus du myocarde ont été définis par les codes I21, I22 et I23 de la 10e révision de la Classification internationale des maladies (CIM-10) en diagnostic principal (DP). Concernant les séjours pour exacerbation de BPCO, les séjours répondant à l’un des critères suivants ont été retenus : 1/ DP de maladie pulmonaire obstructive chronique avec infection aiguë des voies respiratoires (J44.0) ou avec épisode aigu non précisé (J44.1) ; 2/ DP d’insuffisance respiratoire aiguë (J96.0) ou d’infection respiratoire basse (J09-J18, J20-J22) avec un diagnostic associé significatif (DAS) de maladie pulmonaire obstructive chronique (J44) ou d’emphysème (J43) ; 3/ DP de maladie pulmonaire obstructive chronique (J44) ou d’emphysème (J43) avec un DAS d’exacerbation aiguë de BPCO (J44.0-J44.1), d’infection respiratoire basse (J10-J18, J20-J22) ou d’insuffisance respiratoire aiguë (J96.0) 15.
Les estimations d’incidence du cancer du poumon pour la période 2002-2012 ont été réalisées pour la France métropolitaine à partir des données d’incidence disponibles dans la base commune des registres de cancer du réseau Francim, codées selon la Classification internationale des maladies pour l’oncologie, 3e édition (CIM-O-3) 16.
Mortalité des principales pathologies liées au tabac
Les données de mortalité pour les trois pathologies étudiées (infarctus du myocarde, cancer du poumon et BPCO) ont été extraites de la base nationale du Centre d’épidémiologie sur les causes médicales de décès (Inserm-CépiDc). Les décès survenus entre 2000 et 2014 (dernière année validée mise à disposition par le CépiDC au moment de l’estimation) chez des personnes de plus de 35 ans, domiciliées en France métropolitaine et comportant un code CIM-10 d’infarctus du myocarde (I21-I23), de cancer du poumon (C33– C34) ou de BPCO (J40-J44) ont été sélectionnés.
Fraction de mortalité attribuable au tabac, toutes causes
Les nombres de décès attribuables au tabagisme ont été dérivés d’un calcul de fraction attribuable, qui désigne la proportion de cas d’une pathologie qui auraient pu être évités en l’absence de tabagisme dans la population. Nous avons utilisé la méthode d’estimation de Peto et coll. 17 modifiée par Parkin 18, qui combine des données de mortalité, des taux de décès par cancer du poumon et des risques relatifs ajustés de décès associés au tabagisme 19. Les pathologies malignes et non malignes associées à la consommation de tabac sont issues du rapport de l’Organisation mondiale de la santé (OMS) sur la mortalité attribuable au tabac 20. Pour les cancers, nous avons utilisé la liste actualisée par le Centre international de recherche contre le cancer (Circ) 21 avec l’introduction de deux nouvelles localisations (côlon-rectum et cancer de l’ovaire mucineux) dont le niveau de preuve sur la causalité avec le tabagisme est désormais considéré comme suffisant. Pour l’ensemble de ces pathologies, les données de mortalité de 2000 à 2014 provenaient de la base nationale des causes de décès (Inserm-CépiDc) survenus chez les personnes de plus de 35 ans résidant en France métropolitaine. Comme suggéré dans la publication de Ribassin-Majed et Hill 22, les nombres de décès ont été corrigés afin de prendre en compte les décès dont les certificats mentionnaient une cause mal définie et inconnue ou un cancer de localisation mal définie et non précisée. Enfin, pour chacune des pathologies liées au tabagisme, les risques relatifs de décès des fumeurs relativement aux non-fumeurs provenaient majoritairement d’analyses de la Cancer Prevention Study II (CPS-II), une très large cohorte américaine de plus d’un million de personnes suivies de 1982 à 2006 23,24,25,26,27,28.
Données de population
Les tailles des populations nationales (âges en années révolues) par classe d’âge et par année, estimées par l’Institut national de la statistique et des études économiques (Insee), ont été utilisées pour le calcul des taux bruts annuels. Les taux ont été standardisés en utilisant la population européenne de 2010 comme population de référence.
Analyses statistiques
Les évolutions annuelles moyennes des taux bruts par classe d’âge ont été calculées pour chaque sexe au moyen de régressions de Poisson, avec le logarithme des populations annuelles moyennes comme population d’exposition (en variable offset).
La fraction globale de décès attribuable au tabagisme et son évolution entre 2000 et 2014 ont été estimées en considérant l’ensemble des décès enregistrés chaque année en France métropolitaine, sans restriction d’âge, la part des décès attribuables au tabac chez les moins de 35 ans étant considérée comme négligeable. Les résultats sont présentés par sexe et pour les classes d’âge des 35-64 ans (décès prématurés) et des 65 ans et plus. La variation annuelle moyenne de la proportion des décès attribuables au tabac a été estimée au moyen d’un modèle log-binomial ajusté sur l’année , la classe d’âge et le sexe et en introduisant des composantes d’interaction entre le sexe et l’âge et entre l’année et l’âge.
Résultats
Prévalence du tabagisme quotidien
Depuis les années 1970 l’évolution de la prévalence du tabagisme est différenciée selon le sexe (figures 1). Chez les hommes, la consommation de tabac est passée de 60% dans les années 1970 à moins de 40% au début des années 2000, puis s’est stabilisée. Chez les femmes, le tabagisme s’est, au contraire, installé depuis les années 1970 et stabilisé autour de 30% jusqu’au début des années 2000. Après une baisse, la consommation de tabac chez les femmes est repartie à la hausse dans la deuxième moitié des années 2000, atteignant de nouveau 30% en 2010. En 2017, après quelques années de stabilité, le tabagisme quotidien est en baisse, aussi bien chez les hommes que les femmes (figures 1 et 2).
La relative stabilité de la prévalence du tabagisme chez les femmes ces dernières années résulte d’évolutions contrastées selon les classes d’âges. La prévalence du tabagisme quotidien a augmenté parmi les femmes âgées de 45-54 ans, passant de 21,5% en 2000 à 30,8% en 2017. Parmi celles âgées de 55-64 ans, la baisse observée en 2017 fait suite à un doublement de la prévalence entre 2000 (11,0%) et 2016 (21,1%). Ces augmentations correspondent à l’arrivée dans ces tranches d’âge des femmes nées entre 1950 et 1960, premières générations parmi lesquelles le tabagisme s’est répandu dans les années 1970 (figure 2). Dans la tranche d’âge des 35-44 ans, la prévalence du tabagisme a diminué chez les femmes entre 2000 et 2017.
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageMorbidité liée au tabac
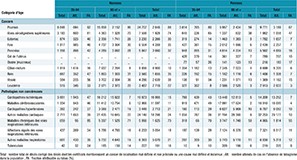
En 2015, on comptabilisait en France environ 65 300 patients hospitalisés pour un infarctus du myocarde, 79 000 patients hospitalisés pour une exacerbation de BPCO et, en 2012, 39 300 cas incidents de cancer du poumon (tableau 1). Près d’un tiers des patients étaient des femmes (31% pour l’infarctus, 37% pour les exacerbations de BPCO et 28% pour le cancer du poumon).
Le taux brut de femmes hospitalisées pour une exacerbation de BPCO (15,1/10 000) était 1,5 fois supérieur au taux de femmes hospitalisées pour un infarctus du myocarde (10,4/10 000) et 2,6 fois supérieurs aux taux d’incidence du cancer du poumon chez la femme (5,7/10 000).
Le sexe ratio (H/F) du taux standardisé était le plus bas pour les exacerbations de BPCO (2,3) et le plus élevé pour le cancer du poumon (3,1).
 Agrandir l'image
Agrandir l'imageEntre 2002 et 2012, le taux standardisé d’incidence du cancer du poumon a globalement augmenté de 72% chez les femmes alors qu’il est resté stable chez les hommes (données non présentées). Concernant les patients hospitalisés pour une exacerbation de BPCO, le taux a doublé chez les femmes entre 2002 et 2015 alors qu’il n’a augmenté que de 30% chez les hommes. Chez les femmes, les évolutions annuelles moyennes montrent des augmentations importantes pour la BPCO dans toutes les tranches d’âge, et à partir de 45-54 ans pour le cancer du poumon. Ces augmentations étaient significativement plus élevées chez les femmes que chez les hommes (figure 3). La classe d’âge la plus impactée était les 55 à 64 ans (+9,4%/an pour la BPCO et +8,3%/an pour le cancer du poumon).
Pour l’infarctus du myocarde, le taux de patients hospitalisés est resté stable entre 2002 et 2015. Cette stabilité masquait des évolutions très différentes en fonction de l’âge avec, chez les 35-65 ans, une hausse de plus de 50% du taux de femmes hospitalisées pour infarctus du myocarde, contre 16% chez les hommes. Cette augmentation était la plus importante chez les femmes âgées de 45 à 54 ans avec une variation annuelle moyenne de +4,8%. Après 65 ans, les taux de patients hospitalisés pour infarctus du myocarde étaient orientés à la baisse, aussi bien chez les hommes que chez les femmes.
 Agrandir l'image
Agrandir l'imageMortalité liée au tabac
En 2014, environ 31 400 décès par cancer du poumon, 14 500 par infarctus du myocarde et 8 500 par BPCO ont été comptabilisés (tableau 1). Pour le cancer du poumon, plus d’un quart (27%) concernait des femmes, contre 36% pour la BPCO et 41% pour l’infarctus du myocarde. Entre 2000 et 2014, le taux de mortalité par cancer du poumon a augmenté de plus de 71% chez les femmes alors qu’il a diminué de 15% chez les hommes (données non présentées). Cette hausse était particulièrement marquée chez les femmes de 55 à 64 ans et restait orientée à la hausse pour toutes les autres tranches d’âge à partir de 45 ans (figure 4). Pour la BPCO, le taux de mortalité a globalement augmenté de 3% chez les femmes entre 2000 et 2015 alors qu’il a diminué de 21% chez les hommes. L’augmentation de la mortalité touchait particulièrement les femmes entre 45 et 64 ans (figure 4). Contrairement aux deux pathologies précédentes, la mortalité par infarctus du myocarde est restée orientée à la baisse chez les hommes et les femmes entre 2000 et 2015. Il convient toutefois de noter que dans les tranches d’âges les plus jeunes (35-54 ans) la diminution de la mortalité était deux fois plus marquée chez les hommes que chez les femmes (figure 4).
 Agrandir l'image
Agrandir l'imageFractions de mortalité attribuables au tabac
En 2014, la fraction de décès attribuables au tabac était estimée à 20% pour les hommes (54 623 décès) et 7% pour les femmes (19 022 décès). Le tableau 2 détaille la fraction des décès attribuables au tabac par pathologie, estimée en 2014 chez les hommes et chez les femmes. Les évolutions du nombre de décès attribuables au tabac entre 2000 et 2014 présentaient des tendances contrastées en fonction du sexe (figure 5). Le pourcentage de décès attribuables au tabac chez les femmes montrait une très forte progression depuis l’année 2000, avec un taux de croissance annuel moyen continu de 6% entre 2000 et 2014 (contre une baisse de 1% pour les hommes), quel que soit le groupe d’âge. En conséquence, le nombre de femmes décédées en 2014 du fait de leur tabagisme était plus de deux fois supérieur au nombre estimé en 2000 (8 027 décès, soit 3,1% de tous les décès).
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageDiscussion
La propagation du tabagisme chez les femmes depuis le début des années 1970 se traduit depuis une dizaine d’années par une augmentation marquée de la prévalence du tabagisme chez les femmes de plus de 45 ans. Ces évolutions ont des conséquences majeures sur la morbi-mortalité des pathologies liées au tabagisme. En effet, si le nombre de cancers du poumon, de patients hospitalisés pour infarctus du myocarde ou pour exacerbation de BPCO ainsi que les décès dus à ces affections restent moins importants que chez les hommes, la dynamique d’évolution de ces pathologies est extrêmement préoccupante chez les femmes, notamment entre 45 et 64 ans.
Une évolution défavorable de la morbi-mortalité associée au tabagisme chez les femmes
Le cancer du poumon, la BPCO et l’infarctus du myocarde ont longtemps été considérées comme des pathologies presque exclusivement masculines. Compte tenu de leur dynamique extrêmement défavorable chez les femmes depuis plus d’une dizaine d’années, ces pathologies figurent aujourd’hui parmi les principales causes de mortalité féminine. Ainsi, le cancer du poumon devrait, dans un avenir proche, devenir la première cause de mortalité par cancer chez la femme devant le cancer du sein.
Le tabagisme reste le principal facteur de risque du cancer du poumon, de la BPCO et de l’infarctus du myocarde du sujet « jeune » 29,30. Ainsi, la dynamique du tabagisme dans la population féminine permet, à elle seule, d’expliquer les tendances temporelles décrites dans cet article. Les variations selon le sexe de l’incidence et de la mortalité du cancer du poumon et des exacerbations de BPCO observées en France témoignent d’une évolution différenciée de l’épidémie du tabagisme en fonction du sexe. Pour l’infarctus du myocarde, si le tabac reste le déterminant principal, notamment chez les moins de 65 ans, d’autres facteurs de risque pourraient-être impliqués après 65 ans. Néanmoins, comme pour le tabac, ils sont pour la plupart comportementaux et ont évolué de manière défavorable chez les femmes sur la même période (obésité, sédentarité, hypertension, cholestérol, stress).
Globalement, si le nombre de décès attribuables au tabac semble s’infléchir au cours du temps pour les hommes, c’est en revanche une augmentation très marquée qui est observée dans la population féminine. Cette tendance est, sans aucun doute, la conséquence du changement de comportement vis-à-vis du tabac qui s’est opéré pour les deux sexes à partir des années 1960, avec une diminution de la prévalence du tabagisme chez l’homme entre 1970 et 2000 contrastant avec une augmentation chez la femme.
La stabilité du tabagisme chez les femmes depuis le début des années 2000 est due à deux évolutions contrastées : une tendance à la baisse parmi les femmes de 18 à 35 ans et une forte hausse parmi les femmes de 45-64 ans. Cette dernière reflète un effet générationnel, avec l’arrivée dans ces tranches d’âge des femmes nées dans les années 1950. Dans ces générations le tabagisme féminin s’est véritablement installé dans les années 1960 et 1970 2.
Les niveaux de consommation en France sont encore très élevés, notamment en comparaison des pays anglo-saxons où la prévalence du tabagisme chez les femmes s’élevait en 2015 à 14% aux États-Unis et en Grande-Bretagne 31,32. Néanmoins, la diminution chez les femmes les plus jeunes (18-35 ans) constitue un signal positif. Si celle-ci perdurait, elle pourrait avoir un effet bénéfique sur l’incidence de l’infarctus du myocarde à relativement court terme 33,34 et sur l’incidence du cancer du poumon et de la BPCO à long terme. L’augmentation de la prévalence du tabagisme chez les femmes âgées de plus de 45 ans est, quant à elle, inquiétante 5. En effet, les tendances actuelles de la morbidité liée à la BPCO et au cancer du poumon reflètent les tendances passées du tabagisme, ces pathologies apparaissant après une exposition cumulée à la fumée de tabac sur un grand nombre d’années. Le fardeau lié à ces pathologies chez la femme devrait donc continuer de croître à court et moyen termes, même en cas de décroissance de la prévalence du tabagisme. De plus, ce phénomène devrait être amplifié par le vieillissement de la population et l’amélioration de la survie des patients atteints d’autres pathologies liés au tabac comme l’infarctus du myocarde.
Des évolutions similaires de la morbi-mortalité du cancer du poumon ont été décrites dans de nombreux autres pays européens où la prévalence du tabagisme chez les femmes a suivi la même dynamique qu’en France 35. Concernant les tendances des hospitalisations pour exacerbation de BPCO chez les femmes en Europe, peu de données sont disponibles. Au Pays Basque espagnol, alors que les taux ont augmenté entre 2000 et 2011 chez les femmes âgées de 50-64 ans, ils sont restés stables chez les femmes plus jeunes et ont diminué chez les femmes plus âgées 36. Quant à la mortalité par BPCO chez les femmes, elle est stable en France comme dans d’autres pays européens 37.
Dans certains pays ayant mis en place des politiques de lutte contre le tabagisme depuis plusieurs années, comme au Royaume-Uni où la diminution de la prévalence du tabagisme est récente, l’incidence du cancer du poumon chez la femme n’est qu’en légère augmentation et la mortalité chez la femme s’est stabilisée 38. Aux États-Unis, où la diminution de la prévalence du tabagisme date de plus d’une vingtaine d’années, l’incidence et la mortalité du cancer du poumon sont orientées à la baisse, y compris dans la population féminine 38,39. Dans ce même pays, les hospitalisations pour BPCO ont cessé d’augmenter depuis la fin des années 1990, chez les hommes comme chez les femmes 40. Néanmoins, si la mortalité par BPCO diminue chez les hommes depuis l’année 2000, l’augmentation se poursuit chez les femmes mais avec une bien moindre intensité 41. Concernant l’infarctus du myocarde, l’augmentation des hospitalisations chez les femmes de moins de 65 ans observée en France n’a été que très peu décrite dans les autres pays où l’incidence est stable ou en diminution, aussi bien chez les hommes que chez les femmes 42.
Évolution de la politique de prévention du tabagisme depuis les années 1990
Des actions de règlementation ont permis de limiter les stratégies marketing des industriels. La loi Evin de 1991 a interdit la publicité des produits du tabac. La loi de santé 2016 a rendu le paquet neutre obligatoire depuis le 1er janvier 2017, interdit les arômes ainsi que les noms de marque qui suggèrent un effet bénéfique du tabac et qui avaient été produites par les industriels notamment pour séduire un public féminin (« Slims », « Vogue », « Allure »).
Concernant les actions de prévention visant la promotion de l’arrêt du tabac, il convient de distinguer les actions d’incitation au sevrage, en général conduites au niveau populationnel (campagnes) et celles qui aident au sevrage, qui concernent le niveau individuel (prise en charge des fumeurs).
Concernant les actions d’incitation au sevrage, et plus particulièrement les campagnes médiatiques, la littérature ne permet pas de conclure à l’efficacité de campagnes spécifiques pour les femmes : les études ne mettent pas en évidence un impact genré des campagnes, les motivations pour arrêter de fumer sont, en partie, les mêmes chez les hommes et les femmes, et enfin les coûts de production de campagnes spécifiques seraient très importants 43,44. Néanmoins, une stratégie d’achat d’espace média adaptée pourrait permettre aux femmes d’être davantage exposées aux campagnes.
Si l’efficacité de campagne genrée d’incitation au sevrage n’est pas démontrée, il semble que pour l’aide à l’arrêt du tabac proposée aux fumeurs, cela pourrait être efficace. En effet, certaines études récentes montrent qu’il pourrait être pertinent de différencier les aides proposées selon le sexe au niveau individuel 45,46. Ainsi, il apparait de plus en plus clairement qu’une approche de l’aide à l’arrêt du tabac chez les femmes doit tenir compte des différences dans les processus d’addiction au tabac entre les hommes et les femmes 47,48,49 avec comme conséquence une sensibilité différente aux traitements existants 50,51. Pour les actions de communication grand public, l’étude d’une approche par sexe doit également être faite en fonction des motivations communes et différentes selon le genre 52.Cette voie reste à investiguer mais pourrait conduire à promouvoir des modalités de prise en charge différenciées en pratique clinique.
Forces et limites
Cette étude analyse pour la première fois en France de manière concomitante l’évolution récente de la prévalence du tabagisme et de la morbi-mortalité associée chez les femmes. L’estimation de la prévalence du tabagisme repose sur des données d’enquêtes déclaratives et peut donc être sujette à des biais. De plus, l’utilisation des bases PMSI constitue une des limites de cette étude, dans la mesure où seuls les patients hospitalisés pour un infarctus et pour une exacerbation de BPCO ont été comptabilisés, ce qui contribue à sous-estimer le fardeau réel de ces pathologies. Cette sous-estimation pourrait être extrêmement élevée pour la BPCO. En effet, le taux annuel d’exacerbations de BPCO varie selon les études, de 0,5 à 3,5 par patient et le taux annuel d’hospitalisations de 0,09 à 2,4 par patient 53. Dans l’analyse de la mortalité attribuable au tabagisme, les maladies hypertensives ont été incluses. Le lien causal entre le tabac et la survenue de ces pathologies reste très discuté au niveau international. Ainsi, leur inclusion pourrait avoir légèrement surestimé le nombre de décès attribuable au tabagisme. Enfin, dans cette étude, l’estimation du fardeau lié au tabagisme ne prend pas en compte la dégradation de la qualité de vie chez les fumeurs.
Conclusion
L’augmentation de la prévalence du tabagisme chez les femmes depuis les années 1970 a pour conséquence une évolution des marqueurs de morbidité et de mortalité très préoccupante dans cette population, notamment après 45 ans. Le niveau élevé de prévalence du tabagisme chez les femmes laisse présager un accroissement du fardeau lié à ces pathologies pendant encore plusieurs années. Si les campagnes de prévention globale du tabagisme doivent perdurer afin de dénormaliser l’usage du tabac, l’apport de moyens supplémentaires pour le développement et la mise en œuvre des campagnes pourrait permettre une segmentation des populations cibles afin d’en maximiser les effets bénéfiques. Par ailleurs, au niveau individuel, il pourrait être utile de fournir aux femmes fumeuses désireuses de sortir du tabagisme des aides au sevrage différentes de celles offertes aux hommes.
Références
adultsmokinghabitsingreatbritain/2016.




