Épidémie d’infections invasives à méningocoque B dans le Beaujolais (Rhône), 2016 : de l’alerte à la prise de décision de vaccination
// Community outbreak of serogroup B invasive meningococcal disease in Beaujolais (Rhône, France) 2016: From the alert to the decision to vaccinate
Résumé
Introduction –
Entre février et mars 2016, 4 cas d’infections invasives à méningocoque de sérogroupe B (IIMB) sont survenus sur une zone circonscrite du Beaujolais (Rhône).
Méthodes –
Une investigation épidémiologique a été mise en œuvre afin de décrire les cas, d’identifier d’éventuelles chaines de transmission, de conduire une évaluation du risque dans la population et de proposer des mesures de contrôle. Le Centre national de référence (CNR) des méningocoques a réalisé le typage des souches et vérifié qu’elles étaient couvertes par le vaccin Bexsero®. Conformément à l’algorithme décisionnel concernant la vaccination par Bexsero® défini dans l’instruction du 24 octobre 2014 de la Direction générale de la santé, une cellule d’expertise multidisciplinaire a été mobilisée pour évaluer la nécessité d’une campagne de vaccination et en définir les modalités.
Résultats –
Les 4 cas d’IIMB étaient liés à une même souche appartenant au complexe cc32, rare en France. Cette souche était couverte par Bexsero®. Le taux d’incidence des IIMB dans la plus petite zone regroupant les cas était de 23/100 000 habitants, dépassant le seuil épidémique. Ce foyer de cas signait l’introduction récente de cette souche et sa circulation active dans la population. À l’issue de la réunion d’expertise multidisciplinaire, l’Agence régionale de santé (ARS) a décidé de proposer la vaccination à la population âgée de 2 mois à 24 ans résidant dans la zone (4 331 personnes) et aux personnes travaillant, étant gardées ou scolarisées dans la zone.
Discussion –
Cette campagne était la première campagne de vaccination par Bexsero® organisée en France. L’étape la plus délicate a été la définition de la population cible, dans un contexte de difficultés d’approvisionnement du vaccin.
Abstract
Introduction –
Between February and March 2016, 4 cases of serogroup B invasive meningococcal disease (IMD) occurred in a limited geographical area of Beaujolais (Rhône).
Method –
An epidemiological investigation was carried out to describe the cases, identify possible chains of transmission, conduct a risk assessment in the population, and propose control measures. The Meningococci National Reference Center (NRC) performed the typing of the strains and checked whether these were covered by the Bexsero® vaccine. In compliance with the decision-making algorithm for vaccination with Bexsero® defined in the instruction of 24 October 2014 of the General Directorate of Health, a multidisciplinary expertise unit was mobilized to assess the need for a vaccination campaign and to define its modalities.
Results –
The 4 cases of serogroup B IMD were related to the same strain belonging to the rare cc32 complex in France. This strain was covered by the Bexsero® vaccine. The incidence rate of serogroup B IMD in the smallest clustered area of cases was 23/100,000, exceeding the epidemic threshold. This cluster of cases revealed the recent introduction of this strain and its active circulation in the population. At the end of the multidisciplinary expert meeting, the Regional Health Agency (ARS) decided to propose vaccination to the population aged from 2 months to 24 years old residing in the area (4,331 people) and to people who were employed, cared for or educated in the area.
Discussion –
This campaign was the first vaccination campaign by the Bexsero® vaccine organized in France. The most delicate step was the definition of the target population, in a context of supply difficulties of the vaccine.
Introduction
Les infections invasives à méningocoques (IIM) sont des infections transmissibles graves dues à Neisseria meningitidis, se manifestant essentiellement sous forme de méningite ou de septicémie, qui peuvent se compliquer de purpura fulminans et de choc septique mortel. Les IIM affectent surtout des sujets jeunes et la majorité des cas surviennent de manière sporadique en France. Leur surveillance est assurée par les Agences régionales de santé (ARS) et Santé publique France et elle repose sur la déclaration obligatoire (DO). Celle-ci permet de détecter les regroupements de cas et les augmentations d’incidence, de décrire l’évolution annuelle et les caractéristiques des cas 1. Le Centre national de référence (CNR) des méningocoques contribue à cette surveillance par le typage moléculaire des souches. Parmi les sérogroupes responsables d’infections invasives, le sérogroupe B est le plus fréquent (52% des IIM en France en 2016) 2. En 2013, le vaccin Bexsero® a obtenu l’autorisation de mise sur le marché (AMM) en Europe. Selon une étude du CNR, 85% [IC95%: 69-93] des souches invasives de sérogroupe B circulant en France en 2007-2008 étaient couvertes par Bexsero® 3. Ce vaccin n’est pas inscrit au calendrier vaccinal pour la vaccination en routine ; il est recommandé pour les populations à risque élevé de contracter une IIM (personnes immunodéprimées, personnel de laboratoire…) et aux populations ciblées dans le cadre de situations spécifiques (grappes de cas, épidémies…) 4.
Entre février et mars 2016, dans un délai de trois semaines, deux grappes de 2 cas d’IIMB survenus dans un petit secteur géographique du Beaujolais (Rhône) ont été signalées à l’ARS Auvergne-Rhône-Alpes 5. Parallèlement aux investigations et mesures de gestion habituelles autour des cas (chimioprophylaxie et/ou vaccination) 6, l’ARS a immédiatement sollicité l’appui de la Cellule d’intervention de Santé publique France en région (Cire) Auvergne-Rhône-Alpes afin d’analyser ce regroupement spatio-temporel inhabituel d’IIM.
Méthodes
Analyse épidémiologique de la situation
Les caractéristiques sociodémographiques et cliniques des cas ont d’abord été décrites et les liens épidémiologiques entre les cas ont été explorés afin d’identifier une éventuelle chaîne de transmission. Une évaluation du risque dans la population a été réalisée. Pour cette évaluation, la zone possible de circulation de la souche ou « zone épidémique » a été définie comme étant la plus petite zone géographique sans enclave incluant les communes de résidence des cas 6. Les calculs de risque ont été réalisés pour les IIMB, les cas étant rattachés à leur commune de résidence. Deux périodes ont été considérées : les 3 derniers mois pour les taux d’attaque et les 12 derniers mois pour les excès de cas. Les excès de cas ont été estimés par des ratios d’incidence standardisés (SIR), correspondant au ratio du nombre de cas observés sur le nombre de cas attendus. Les SIR ont été calculés pour la zone épidémique, après standardisation directe en considérant les données de population de France métropolitaine comme population de référence. Les données de population étaient issues du recensement de la population 2012 (RP2012, exploitation principale) de l’Institut national de la statistique et des études économiques (Insee).
Investigations microbiologiques
Les souches et/ou prélèvements biologiques ont été envoyés au CNR pour confirmation du sérogroupe et génotypage (séquençage des gènes porA, fetA et penA et complexe clonal par la technique Multilocus Sequence Typing (MLST) 7). Les données de typage sont exprimées par la formule génotypique (« Groupe:PorA-VR1,PorA-VR2:FetA:cc » combinant groupe, région variable VR1 et VR2 de la protéine PorA, région variable de la protéine FetA et complexe clonal. Les souches de sérogroupe B correspondant à des cas groupés sont testées, pour prédire leur couverture par le vaccin Bexsero®, par la technique Meningococcal Antigen Typing System (MATS) 3 qui consiste à déterminer la corrélation entre les antigènes inclus dans le vaccin et ceux exprimés par la souche bactérienne. La couverture d’une souche par le vaccin est prédite si elle exprime au moins l’un des trois composants du vaccin (fHbp, NHBA ou NadA) à un niveau supérieur au seuil corrélé avec la protection et/ou en présence de la séquence P1.4 de PorA. De plus, une étude de l’activité bactéricide du sérum en présence de complément humain (hSBA) a été réalisée grâce à un pool de sérums de personnes vaccinées avec deux doses de Bexsero® (comparaison de l’activité bactéricide d’un pool de sérums avant vaccination et un mois après la deuxième dose du vaccin) 8.
Critères d’alerte et décision vaccinale
Comme le recommande l’instruction de la Direction générale de la santé (DGS) du 24 octobre 2014 relative à la prophylaxie des IIM 6, l’ARS a organisé le 25 mars 2016 une réunion d’expertise multidisciplinaire regroupant des représentants de Santé publique France, du CNR, de la DGS, de l’Établissement de préparation et de réponse aux urgences sanitaires (Eprus) (1), de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM), de l’Inspection académique du Rhône, de la Protection maternelle et infantile du Rhône, du Centre de santé et de prévention de Villefranche-sur-Saône, un infectiologue et un membre du Comité technique des vaccinations (CTV) du Haut Conseil de la santé publique (HCSP). Elle avait comme objectifs de présenter l’analyse de la situation épidémiologique, d’étudier l’intérêt de vacciner la population selon les critères définis dans l’algorithme décisionnel pour la vaccination par Bexsero® (figure 1) et de définir, le cas échant, la population ciblée par la vaccination 6,9.
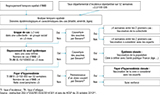 Agrandir l'image
Agrandir l'imageRésultats
Description des cas
Les 4 cas sont survenus entre la fin février et la mi-mars dans un secteur restreint du Beaujolais situé au nord-ouest de Villefranche-sur-Saône (tableau 1).
 Agrandir l'image
Agrandir l'imageLes 2 premiers cas concernaient des jeunes de 17 ans (cas 1 et 2), résidant dans deux communes éloignées d’une dizaine de kilomètres. Aucun lien épidémiologique n’a pu être mis en évidence entre eux, hormis la fréquentation d’un « bal des conscrits » le 20 février 2016, soit respectivement 9 et 12 jours avant la date de début des signes de chacun. Ce délai a été considéré comme trop long pour faire l’hypothèse d’une exposition commune des 2 cas lors du bal. Des porteurs asymptomatiques intermédiaires ont pu jouer un rôle dans la chaîne de transmission. À ce stade, il n’a pas été décidé de vacciner les sujets contacts de chacun des 2 cas, car il n’était pas possible de définir une communauté de vie (cf. figure 1).
Une deuxième grappe de cas est survenue trois semaines après celle des premiers cas. Cette grappe incluait 2 cas survenus à moins de 24h d’intervalle (cas co-primaires : cas 3 et 4). Elle concernait deux fillettes de 3-4 ans, appartenant à une même collectivité puisqu’elles étaient scolarisées dans la même classe à l’école maternelle de leur commune de résidence (située respectivement à 6 et 5 kilomètres des communes de résidence des cas 1 et 2). Ces 2 cas ne représentaient qu’une seule et même chaîne de transmission. Ils étaient probablement liés à un contact commun au sein de l’école maternelle, seule exposition commune. Conformément à la circulaire (2 cas dans le même établissement), l’ensemble de la collectivité (adultes et enfants du groupe scolaire) a été vaccinée.
Aucun contact commun aux deux grappes de cas n’a été mis en évidence.
Parmi ces 4 cas, 2 ont connu une évolution favorable et 2 ont présenté des séquelles (cutanées, rénales et auditives).
Caractéristiques biologiques de la souche circulante
Les souches des 4 cas étaient identiques et appartenaient à une souche du complexe clonal cc32 présentant une formule génotypique rare « B:P1.19,15:F4-28:cc32 » avec le marqueur additionnel penA52. Les souches appartenant au cc32 hyperinvasif sont fréquentes en France et représentaient 26% des IIMB sur la période 2006-2015 1 ; elles ont également été responsables de la situation hyperendémique en Normandie entre 2003 et 2012, mais avec une souche ayant une formule génotypique différente « B:P1.7,16:F3-3:cc32 », contrôlée par la vaccination par MenBvac® 10. Par contre, cette combinaison de marqueurs « B:P1.19,15:F4-28:cc32 » avec le marqueur additionnel penA52 est rare parmi les souches cc32 en France, puisque seulement 3 autres cas avaient été recensés par le CNR dans différentes régions depuis 2009. Cela signifiait que cette souche circulait faiblement et ce regroupement spatio-temporel faisait craindre l’introduction récente de ce clone dans une population non immune.
Le test MATS a montré la couverture de cette souche par un des trois antigènes du méningocoque utilisés dans le vaccin Bexsero®, ce qui suggérait une efficacité vaccinale prédite d’au moins 80%. Cette prédiction a été confortée par un test de bactéricidie : le dosage de l’activité bactéricide (hSBA) a montré un titre bactéricide de 2 dans le pool de sérums avant vaccination et de 128 dans le pool de sérums après vaccination. Cet accroissement du titre hSBA était corrélé avec la protection contre cette souche par Bexsero®.
Analyse du risque
La zone épidémique, d’environ 15 kilomètres de diamètre, était constituée de 12 communes et comprenait 13 319 habitants (figure 2). Toutes les communes de la zone appartenaient au même bassin de vie selon la définition de l’Insee (plus petit territoire sur lequel les habitants ont accès aux équipements et services les plus courants), sauf la commune située au nord-ouest de la zone. Cette dernière a été incluse en raison de la tenue d’un bal des conscrits sur cette période, entraînant des liens entre les habitants de cette commune et ceux du reste de la zone.
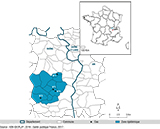 Agrandir l'image
Agrandir l'imageEn considérant la survenue de trois épisodes d’IIM dans cette zone géographique (les cas co-primaires comptant comme une seule chaîne de transmission pour l’évaluation du risque), le taux d’attaque sur la zone était de 23 cas/100 000 habitants, dépassant le seuil épidémique. L’ensemble des critères épidémiques étaient donc remplis sur cette zone (survenue dans une même communauté, dans un délai inférieur ou égal à 3 mois, d’au moins 3 cas sans contact direct entre eux, rattachables à des souches identiques et taux d’attaque primaire au moins égal à 10 cas/100 000 habitants 6). Un excès de cas significatif (96 fois supérieur au niveau national) était observé chez les 0-24 ans (tableau 2). L’absence de lien direct entre ces trois épisodes traduisait la circulation apparente de la souche dans la population de la zone via des porteurs asymptomatiques.
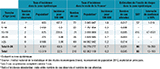 Agrandir l'image
Agrandir l'imagePrise de décision
Sur la base des résultats de l’analyse du risque (épidémie clonale, excès de risque importants et portage asymptomatique dans la population), une vaccination de la population a été décidée par l’ARS après avis de la cellule d’expertise multidisciplinaire. Cette vaccination visait à éviter l’installation plus durable de cette souche dans le secteur 11.
La population ciblée était constituée des personnes âgées de 2 mois à 24 ans résidant, travaillant, étant gardées ou scolarisées dans la zone épidémique. Cette tranche d’âge a été choisie du fait des risques observés dans cette population, et en raison de la fréquence du portage du méningocoque et de l’incidence élevée des IIM chez les jeunes adultes. Par ailleurs, cette tranche d’âge correspondait également à la population ciblée par le calendrier vaccinal pour la vaccination contre le méningocoque C.
Une surveillance épidémiologique et microbiologique renforcée a également été mise en place. Elle comprenait : un rappel aux professionnels de santé de la nécessité du signalement sans délai ; une investigation épidémiologique approfondie autour de chaque signalement pour rechercher d’éventuels liens directs ou indirects entre les cas ; un envoi des souches ou prélèvements au CNR pour génotypage en urgence et une transmission des résultats du CNR sans délai à l’ARS et à Santé publique France. Le périmètre de cette surveillance renforcée concernait le département du Rhône et trois départements limitrophes : Ain, Loire et Saône-et-Loire (en lien avec l’ARS Bourgogne-Franche-Comté).
Discussion
La situation épidémiologique observée dans cette zone du Beaujolais correspondait à une épidémie clonale d’IIMB liée à un clone très rare en France, faisant craindre une installation durable de cette souche dans le secteur. La souche étant couverte par le vaccin Bexsero®, une vaccination a été proposée à la population dans laquelle elle circulait et, conformément à l’instruction de la DGS, son périmètre a été défini après consultation d’une cellule d’expertise multidisciplinaire. Cette décision de campagne de vaccination par Bexsero® était la première en France depuis son AMM en 2013. La méthodologie mise en œuvre pour répondre à cette situation s’est appuyée sur les recommandations du HCSP (avec l’algorithme décisionnel) qui se sont avérées très utiles pour produire les éléments d’aide à la décision de vaccination.
Dans cette analyse, l’étape la plus délicate a été la définition de la zone épidémique. Au-delà des critères statistiques (taux d’attaque supérieur au seuil épidémique) et des risques estimés, la zone devait non seulement être homogène d’un point de vue géographique mais aussi en termes de bassin de vie. Une zone trop petite pouvait, d’une part, laisser une partie de la population non protégée et, d’autre part, rendre inefficace l’éradication de la circulation de la souche. Une zone trop large pouvait conduire à vacciner certaines personnes inutilement et induire des coûts et des effets secondaires potentiels non justifiés. La définition de la zone cible a dû également prendre en compte la disponibilité en quantité limitée du vaccin, dont le schéma vaccinal comprend plusieurs doses (deux à quatre selon l’âge). Par ailleurs, ce vaccin récent, non recommandé en routine dans le calendrier vaccinal, était mal connu de la population et des professionnels de santé. Dans ce contexte, il était particulièrement important de pouvoir expliquer à la population le choix de la population-cible et la stratégie de vaccination afin qu’elle soit bien acceptée. En pratique, la définition de la zone épidémique a posé question aux habitants du secteur, notamment en raison du mélange incontournable des collégiens et lycéens résidant dans la zone avec ceux résidant dans les communes avoisinantes. C’est pourquoi cette étape de définition de la zone épidémique est essentielle et doit associer, aux côtés des experts, des personnes connaissant parfaitement le terrain et les habitudes de vie de la population. Ainsi, des élus des communes concernées pourraient à l’avenir être sollicités afin de bénéficier de leur connaissance du maillage territorial et garantir la bonne acceptation des mesures de gestion proposées.
Fin juin 2016, un cinquième cas lié à cette souche est survenu chez un adolescent de l’Ain, de l’autre côté de la Saône, à une dizaine de kilomètres de la zone épidémique. Ce cas, qui a connu une évolution favorable, n’avait ni lien épidémiologique ni habitudes de vie liées à la zone épidémique. La situation épidémiologique a été revue lors d’une réunion d’experts restreinte le 1er juillet 2016. Ce cinquième cas étant survenu plus de 3 mois après le dernier cas du foyer, le taux d’attaque calculé sur les 3 derniers mois était inférieur au seuil épidémique. En l’absence de remplissage des critères épidémiques, l’extension du périmètre de la vaccination n’a pas été retenue. Cependant, la survenue de ce dernier cas montrait que la souche avait pu continuer à circuler dans la zone et que cela justifiait d’autant plus la surveillance renforcée. L’alerte a donc été levée, mais la surveillance renforcée a été maintenue pendant plusieurs mois. Depuis cette date, aucun nouveau cas d’IIMB dû à cette souche n’a été notifié dans cette zone de la région Auvergne-Rhône-Alpes.
Remerciements
Les auteurs remercient les participants à la réunion d’experts (A.M. Durand, C. Godin, B. Morel et R. Simon de l’ARS Auvergne-Rhône-Alpes, C. Saura, A. Lepoutre et M. Zurbaran de Santé publique France, A.E. Deghmane du CNR, B. Worms et C. Lazarus de la DGS, A. Charron de l’ANSM, C. Cros et F. Imler-Weber de l’Inspection académique, A.S. Ronnaux-Baron du CDHS, les Pr T. Debord, infectiologue et D. Floret, pédiatre), E. Vaissière de la Cire Auvergne-Rhône-Alpes pour la réalisation de la carte, A.S. Barret et D. Lévy-Bruhl de Santé publique France pour leur relecture de l’article.




