Surveillance de l’hépatite E en France, 2002-2016
// Hepatitis E surveillance in France, 2002-2016
Résumé
Introduction –
Depuis 2002, la surveillance de l’hépatite E repose sur le Centre national de référence (CNR) des virus des hépatites à transmission entérique (hépatites A et E). Ces dernières années, d’importantes avancées scientifiques ont amélioré les connaissances sur l’infection par le virus de l’hépatite E (VHE) dans les pays industrialisés. L’objectif est de décrire les sources de données et les résultats épidémiologiques sur l’infection à VHE au cours de la période 2002-2016 en France métropolitaine.
Méthodes –
Les données proviennent du CNR (nombre de personnes testées, de cas importés/autochtones (IgM/PCR positives), de génotypes), de deux laboratoires centralisateurs privés (nombre de demandes de tests diagnostiques, de personnes positives (IgM/PCR)), de la base de consommation inter-régimes du Système national des données de santé (nombre de tests remboursés en soins de ville), de la base du programme de médicalisation des systèmes d’information (nombre de séjours/personnes hospitalisés pour hépatite E) et des investigations de cas groupés.
Résultats –
Entre 2002 et 2016, le nombre de personnes pour lesquelles des échantillons ont été adressés pour un diagnostic d’hépatite E a augmenté de façon exponentielle (209 vs 76 000). Une augmentation du nombre de cas diagnostiqués a également été observée, concernant principalement les cas autochtones (9 vs 2 292). Depuis 2007, plus de 90% des souches autochtones étaient de génotype 3. Parallèlement, le nombre de personnes hospitalisées pour hépatite E a augmenté (57 vs 653), avec des taux d’incidence annuelle plus élevés dans les régions du Sud. Les sources de contamination suspectées lors d’épisodes de cas groupés ont été le plus souvent la consommation de saucisses de foie cru de porc.
Conclusion –
À partir de 2010, la disponibilité de tests diagnostiques et une meilleure connaissance de l’hépatite E ont entrainé une augmentation considérable du nombre de personnes testées, d’où une incidence croissante du nombre de cas autochtones. Le porc, principal réservoir du VHE en France, est à l’origine d’une transmission alimentaire, particulièrement les produits à base de foie cru. La prévention repose sur l’information des consommateurs quant à la nécessaire cuisson à cœur de ces produits.
Abstract
Introduction –
In France, since 2002, hepatitis E surveillance has been based on the National Reference Center (NRC) for enteric-transmitted hepatitis viruses (hepatitis A and E). These last years, major scientific advances improved the knowledge on HEV infection in industrialized countries. The objective is to describe HEV infection data sources and epidemiological results in mainland France over the period 2002-2016.
Methods –
Data sources are from the NRC (numbers of tested persons, of imported/autochthonous cases (IgM/PCR (+)), of genotypes), from two private laboratories (numbers of HEV requests, of positive IgM/PCR cases), from reimbursement data of anti-HEV EIA tests in private practice (number of reimbursed tests), from hospital discharge reports (numbers of stays/hospitalized persons for HEV infection) and from cluster investigations.
Results –
From 2002 to 2016, the number of persons for whom a diagnosis of HEV infection was performed increased dramatically (209 vs 76,000). An increased number of diagnosed cases was also noted, primarily for autochthonous cases (9 vs 2,292). Since 2007, more than 90% of autochthonous strains were genotype 3. Concomitantly, the number of persons hospitalized for hepatitis E increased (57 vs 653) with higher annual incidence rates in southern regions. In clusters, suspected sources of contamination were more often consumption of raw pork liver sausages.
Conclusion –
Since 2010, the reliability of HEV diagnostic tests and a better understanding of HEV infection caused a dramatic increase in the number of tested persons and an increasing incidence of autochthonous cases. Pork, main HEV reservoir in France, is responsible for foodborne routes of transmission, particularly consumption of raw pork liver products. Thorough cooking is the major recommendation to prevent HEV foodborne transmission.
Introduction
Depuis 2002, Santé publique France s’appuie, pour la surveillance de l’hépatite E, sur le Centre national de référence (CNR) des virus à transmission entérique (hépatites A et E). Ces quinze dernières années, d’importantes avancées scientifiques ont amélioré les connaissances et le diagnostic de l’infection par le virus de l’hépatite E (VHE) dans les pays industrialisés, expliquant en partie l’évolution observée des données de surveillance de cette infection.
L’infection par le VHE est le plus fréquemment asymptomatique ou pauci-symptomatique (60 à 98% des cas) 1,2. Cependant, des formes symptomatiques ressemblant à celles de l’hépatite A avec présence d’ictère (68-86%) peuvent apparaître après une incubation de 2 à 8 semaines (40 jours en moyenne). Les hépatites fulminantes semblent exceptionnelles lors des infections dues aux génotypes circulant dans les pays industrialisés mais des formes chroniques ont été décrites chez des patients immunodéprimés 3, pouvant évoluer vers la cirrhose hépatique. Le virus de l’hépatite E peut également être responsable d’atteintes extra-hépatiques, en particulier neurologiques centrales ou périphériques 4. Il existe peu de données sur la mortalité due à l’infection par le VHE dans les pays industrialisés.
Le diagnostic d’hépatite E repose sur la recherche d’anticorps spécifiques IgM et IgG et sur la détection du génome viral dans le sang ou les selles. Une infection aiguë est définie par la présence d’IgM anti-VHE dans le sang ou par la présence du virus dans le sang ou les selles. La présence d’IgG anti-VHE témoigne d’une exposition antérieure au VHE.
Depuis 2010, des tests sérologiques plus performants sont disponibles, contribuant à une augmentation des prescriptions, associées à une meilleure connaissance par les médecins de cette infection. La sensibilité des tests IgG anti-VHE s’est améliorée, affectant les résultats des données de séroprévalence anti-VHE. En 2011, la séroprévalence IgG anti-VHE, obtenue en testant les mêmes prélèvements de donneurs de sang du Sud-Ouest, était de 52,5% avec un nouveau test validé sensible alors qu’elle était de 16% avec un test peu sensible 5. Par ailleurs, la spécificité de ces nouveaux tests est supérieure à 99% 6.
Au début des années 2000, la plupart des cas d’hépatite E diagnostiqués dans les pays industrialisés étaient des cas importés à la suite d’un séjour dans un pays où l’accès à l’eau potable et l’assainissement étaient peu maîtrisés. Puis une transmission autochtone a été suspectée chez des patients n’ayant pas voyagé, suggérant des modes de transmission autres que la voie hydrique 7,8,9,10. La transmission autochtone la plus fréquemment documentée était alimentaire, par consommation de produits contaminés issus d’animaux réservoirs du VHE (porc, sanglier, cerf) 11,12,13.
L’objectif de cet article est de décrire les sources de données et les résultats épidémiologiques sur l’infection à VHE au cours de la période 2002-2016 en France métropolitaine.
Méthodes
Les données du CNR
La surveillance de l’hépatite E par le CNR repose sur l’envoi volontaire par des laboratoires publics et privés d’échantillons (sang, selles) pour confirmer le diagnostic (présence d’ARN et/ou d’IgM anti-VHE) ou pour typage des souches. Par ailleurs, le CNR recense l’activité annuelle (nombre de prélèvements, nombre de cas diagnostiqués) de laboratoires hospitaliers pratiquant le diagnostic VHE, de même que celle de deux laboratoires privés centralisateurs (Eurofins Biomnis, Cerba).
Les objectifs sont le suivi des tendances de l’incidence (cas importés/autochtones) et la détermination des génotypes circulants et leurs tendances. Les données de surveillance sont présentées sous forme agrégée dans un rapport annuel d’activité. Au cours de la période 2002-2016, les données disponibles étaient le nombre de personnes testées, le nombre de cas diagnostiqués (importés, autochtones), les caractéristiques des cas diagnostiqués (âge, sexe, zone géographique de résidence) et les résultats de typage des souches. En raison du changement de CNR en 2012 et de la disponibilité progressive de tests anti-VHE plus sensibles, deux périodes seront différenciées pour l’analyse des données : 2002-2011 et 2012-2016. Les tendances entre les deux périodes ont été analysées à l’aide du test de Chow de rupture des tendances.
Les données des laboratoires privés centralisateurs
Depuis 2014, les données VHE des trois sites de deux laboratoires centralisateurs privés (Eurofins Biomnis, Cerba) sont extraites et transférées de manière régulière et automatique à Santé publique France. Les objectifs sont de suivre l’évolution temporo-spatiale du nombre de demandes de test diagnostique et du nombre de personnes avec au moins un prélèvement positif.
L’analyse a porté sur les enregistrements ayant une date de prélèvement entre 2014 et 2016. Les variables extraites étaient : numéro d’anonymat, date de naissance, sexe, date du prélèvement, codes postaux (patient/médecin prescripteur/laboratoire préleveur), IgM (quantitatif, qualitatif) et PCR. Un prélèvement positif pour l’hépatite E a été défini comme un prélèvement avec présence d’IgM anti-VHE ou PCR positive.
Une personne positive pour l’hépatite E était définie comme une personne ayant eu au moins un prélèvement avec présence d’IgM anti-VHE ou une PCR positive au cours de la période 2014-2016.
Les données de consommation de sérologies VHE dans le Système national des données de santé
La base de données de consommation inter-régimes de l’Assurance maladie est alimentée par les données de remboursement des soins de ville. Elle concerne les bénéficiaires des régimes d’assurance maladie ayant « consommé » des soins, mais ne renseigne pas les résultats des examens biologiques. Pour l’hépatite E, les données disponibles étaient le nombre de sérologies VHE remboursées (acte biologique codé 1743, anticorps anti-VHE par EIA). Une sérologie comprend la recherche d’IgM avec ou sans recherche d’IgG. L’objectif était de suivre l’évolution temporo-spatiale du nombre de tests remboursés.
L’analyse a porté sur la période 2010-2014 ; les variables disponibles étaient l’âge, le sexe et le département de domicile du patient.
Les données d’hospitalisation du PMSI
Le programme de médicalisation des systèmes d’information (PMSI) est une base nationale de données des séjours dans les hôpitaux publics et privés. Les informations médicales sont codées selon la 10e édition de la classification internationale des maladies (CIM-10) avec une hiérarchie de diagnostics : diagnostic principal, diagnostic relié au diagnostic principal, diagnostics associés. Les séjours hospitaliers avec un code CIM-10 B 17.2 pour hépatite E en diagnostic principal, diagnostic relié au diagnostic principal ou associé ont été extraits. Les objectifs étaient de suivre l’évolution temporo-spatiale du nombre de séjours hospitaliers pour hépatite E et du nombre de personnes hospitalisées avec un diagnostic d’hépatite E.
L’analyse a porté sur la période 2004-2016 ; les variables disponibles étaient l’âge, le sexe, le département de domicile, le mois et l’année d’hospitalisation.
Les investigations d’épisodes de cas groupés d’hépatite E
En présence d’une suspicion de cas d’hépatite E regroupés dans le temps et l’espace, une investigation est menée pour recenser les cas, identifier la source de contamination et prendre les mesures de contrôle et de prévention adaptées. Depuis 2009, un questionnaire standardisé recueille les informations suivantes : âge, sexe, profession, signes cliniques, hospitalisation, résultats biologiques, existence de comorbidité(s), existence d’exposition(s) à risque dans les 2 à 10 semaines avant l’apparition des signes cliniques (voyage hors métropole, contact avec d’autre(s) cas d’hépatite E, contact avec des animaux de compagnie, de ferme, de gibier, consommations alimentaires). Les consommations alimentaires de produits à base de porc avec leur mode habituel de cuisson, de gibier, de coquillages, de fruits non pelés, de légumes crus et d’eau sont détaillées. Devant une suspicion d’épisode de cas groupés, les prélèvements sanguins sont envoyés au CNR pour typage des souches.
Résultats
Les données du CNR
En quinze ans (2002-2016) de surveillance de l’hépatite E, le nombre de personnes pour lesquelles des échantillons ont été adressés pour un diagnostic d’hépatite E a augmenté de façon exponentielle (209 vs 76 000) (tableau 1, figure 1). Au cours de la première période (2002-2011), le nombre de personnes testées a augmenté régulièrement chaque année. L’année 2012 (nomination d’un nouveau CNR) a vu une augmentation très importante du nombre de personnes testées par rapport à 2011 (multiplication par 5). Cette augmentation s’est poursuivie en 2013 (multiplication par 2) puis avec une moindre intensité les années suivantes (tableau 1).
De 2002 à 2011, le nombre total de cas diagnostiqués a régulièrement augmenté (13 vs 266), suivi entre 2012 et 2016 d’une forte augmentation. L’augmentation portait essentiellement sur le nombre de cas autochtones (9 en 2002 vs 2 292 en 2016) ; le nombre de cas importés est resté stable (tableau 1, figure 1). Le test de Chow montre une différence significative de tendance (p<0,001) à la fois pour le nombre de personnes testées et le nombre de cas autochtones entre la période 2002-2011 et la période 2012-2016.
Au cours de la période 2002-2011, la proportion de cas diagnostiqués parmi les personnes testées est restée relativement stable, entre 6% à 10% puis à partir de 2012, une tendance à la diminution a été observée, de 5% à 3% (tableau 1, figure 1).
 Agrandir l'image
Agrandir l'image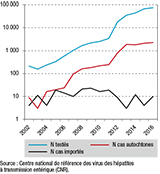 Agrandir l'image
Agrandir l'imageLes caractéristiques des cas autochtones en termes de sexe ou d’âge ont peu évolué depuis 2002. Les cas autochtones étaient plutôt des hommes, âgés de 50 ans et plus en moyenne. Les cas recensés par le CNR résidaient dans toutes les régions métropolitaines, avec une prédominance dans le Sud au moins jusqu’en 2010 et moins nette les années suivantes (données non présentées).
Chaque année, plus de 80% des échantillons ARN(+) ont été génotypés. Depuis 2007, la très grande majorité (>90%) des souches de cas autochtones étaient de génotype 3 (tableau 2). Les génotypes 1, 2 et 4 étaient tous des souches de cas importés sauf à partir de 2011 pour le génotype 4 (tous cas autochtones). Parmi les différents sous-types de génotype 3, le sous-type 3f était prédominant depuis 2007 (>60%), suivi du sous-type 3chi (9% en 2007 à 31% en 2013) (tableau 3). Entre 2013 et 2016, la proportion de sous-type 3chi était d’environ 35% (tableau 3).
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imageLes données des laboratoires privés centralisateurs
Au total, 94 358 prélèvements ont été recensés : 26 180 en 2014, 31 772 en 2015 et 36 406 en 2016 (+40% entre 2014 et 2016). Entre 2014 et 2016, le nombre total annuel de prélèvements a augmenté dans la très grande majorité des régions (données non présentées). Si l’on regroupe les régions métropolitaines en deux zones géographiques, Sud (Aquitaine, Auvergne, Corse, Languedoc-Roussillon, Limousin, Midi-Pyrénées, Poitou-Charentes, Provence-Alpes-Côte d’Azur et Rhône-Alpes) et Nord, le taux de prélèvements positifs était significativement différent entre les deux zones, respectivement 6,8% et 5,3% (p<0,001).
Après exclusion des prélèvements multiples positifs pour une même personne au cours de la période 2014-2016, 4 706 personnes ont eu un diagnostic d’hépatite E au sein d’un des deux laboratoires, respectivement 1 601 en 2014, 1 527 en 2015 et 1 578 en 2016. Parmi ces 4 706 personnes positives, 60% étaient de sexe masculin et 65% étaient âgées de 40 à 69 ans (âge moyen : 54,4 ans). Elles résidaient principalement en Provence-Alpes-Côte d’Azur, Midi-Pyrénées, Languedoc-Roussillon, Rhône-Alpes et Île-de-France.
Les données de consommation de sérologies VHE dans le Système national des données de santé
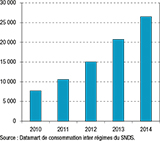
Entre 2010 et 2014, une tendance croissante du nombre de tests remboursés a été observée (figure 2). L’âge et le sexe des personnes ayant bénéficié d’un remboursement d’un test anticorps anti-VHE étaient disponibles pour la période 2012-2014. Au cours de cette période, les remboursements ont concerné 52% de femmes et 48% d’hommes et l’âge médian était de 50 ans. Le nombre de tests anticorps anti-VHE remboursés a augmenté progressivement pour toutes les régions entre 2010 et 2014, avec une progression plus importante pour les régions Corse, Midi-Pyrénées, Provence-Alpes-Côte d’Azur et Languedoc-Roussillon (figure 3).
 Agrandir l'image
Agrandir l'image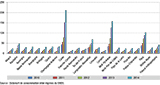 Agrandir l'image
Agrandir l'imageLes données d’hospitalisation du PMSI
Entre 2004 et 2016, le nombre total de personnes hospitalisées en France métropolitaine pour hépatite E était de 3 908. Une tendance à l’augmentation régulière du nombre de personnes hospitalisées a été observée au cours de la période, de 57 en 2004 à 653 en 2016. Les cas hospitalisés étaient plutôt des hommes (69%) et l’âge moyen était de 55,2 ans.
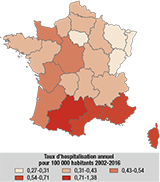
Le taux d’incidence annuelle d’hospitalisation était de 0,5/100 000 habitants en France métropolitaine. Par région, les taux d’incidence annuelle d’hospitalisation étaient variables, de 0,3 à 1,4/100 000 habitants, et plus élevés dans les régions du Sud (1,4 en région Midi-Pyrénées, 0,7 en Languedoc-Roussillon et Provence-Alpes-Côte d’Azur et 0,6 en Corse) (figure 4).
 Agrandir l'image
Agrandir l'imageLes investigations d’épisodes de cas groupés d’hépatite E
Depuis 2005, des épisodes de cas groupés d’hépatite E ont été investigués par Santé publique France, les Agences régionales de santé et le CNR. Les sources suspectées de contamination ont été les figatelli consommés peu cuits ou crus, du jambon fumé « maison », un porcelet farci cuit à la broche et de l’eau d’un puits privé (tableau 4) 14,15,16,17,18.
Ces épisodes étaient généralement de petite taille (≤10 cas), à l’exception de l’épisode investigué en Bretagne (lié à la consommation d’un porcelet) où une enquête de cohorte rétrospective avec sérologie anti-VHE a permis de diagnostiquer 17 cas, dont des cas asymptomatiques avec IgM positives, témoins d’une infection récente 2.
Pour aucune de ces investigations, une comparaison des souches humaines et alimentaire n’a été possible. Il faut noter que lors de l’investigation en Auvergne en 2015, le génome viral a été retrouvé dans l’eau du puits privé suspecté par l’enquête épidémiologique d’être la source de contamination. Il n’a pas été possible d’amplifier le génome pour une comparaison avec les souches humaines en raison d’une contamination virale très faible 18.
 Agrandir l'image
Agrandir l'imageDiscussion
En 2002, lors de la mise en place de la surveillance par le CNR, l’hépatite E autochtone apparaissait comme émergente en France, comme dans les autres pays industrialisés. Le nombre de cas diagnostiqués était faible et les connaissances sur son épidémiologie étaient limitées. À partir de 2010, la disponibilité de tests diagnostiques sérologiques et moléculaires performants, avec un recours accru à des tests commerciaux, a entraîné une augmentation du nombre de personnes testées avec un nombre de cas autochtones dépassant très largement le nombre de cas importés. Cette tendance à l’augmentation a été retrouvée dans les données du CNR mais aussi dans les données de remboursement des sérologies VHE, reflet du nombre de personnes testées. Par ailleurs, l’augmentation des prescriptions des tests diagnostiques au cours du temps était aussi liée à une meilleure connaissance de cette infection par les médecins. Parallèlement, une augmentation du nombre de personnes hospitalisées avec un diagnostic d’hépatite E a été observée au cours de la même période. Dans les hôpitaux, les tests diagnostiques ont été disponibles dès 2004, même s’ils étaient peu sensibles à cette époque. De plus, une proposition de dépistage plus fréquente dans le cadre du suivi hospitalier de patients immunodéprimés a été mise en place à partir de 2008 19. L’augmentation du nombre de cas diagnostiqués sur les dernières années ne peut donc pas être attribuée uniquement à la mise en place de ces mesures et reflète vraisemblablement une augmentation réelle du nombre de cas.
Depuis 2012, le CNR s’appuie sur un réseau de laboratoires volontaires publics et privés. Ce réseau a évolué au cours du temps, tant dans la participation des laboratoires (augmentation du nombre de laboratoires, type de participation ponctuelle/au long cours) que dans leur répartition géographique observée en métropole (laboratoires plutôt localisés dans le Sud de la France au début de la surveillance). En parallèle avec l’arrivée de tests diagnostiques performants et une meilleure connaissance des médecins, la très forte augmentation du nombre de cas autochtones d’hépatite E en 2012 pourrait être en partie aussi expliquée par la participation d’un réseau de laboratoires plus exhaustif que celui du CNR précédent. Par ailleurs, le nombre de cas autochtones recensés par le CNR reste probablement sous-estimé, si l’on se base sur les résultats d’études de séroprévalence chez les donneurs de sang 20. En effet, les cas recensés par la surveillance du CNR sont majoritairement des cas symptomatiques d’hépatite E chez des personnes immunocompétentes. Les infections asymptomatiques à VHE ne sont donc pas recensées. Par ailleurs, s’agissant d’une maladie très fréquente et dont la gestion de chaque cas ne nécessite pas de mesure particulière, l’exhaustivité de la surveillance n’est pas un objectif. Cependant, si l’hépatite E ne remplit pas les critères d’une maladie à déclaration obligatoire, des pistes seront explorées à partir de 2018 pour, en particulier, assurer la stabilité du réseau de laboratoires volontaires du CNR et sa représentativité pour le suivi des tendances de l’incidence et de la circulation des génotypes.
Les caractéristiques des cas autochtones étaient cohérentes entre les différentes sources et stables au cours du temps, avec un âge moyen autour de 50-55 ans et une prédominance masculine. Les cas résidaient dans toutes les régions métropolitaines mais avec une prédominance dans les régions du Sud (Midi-Pyrénées, Corse, Provence-Alpes-Côte d’Azur, Languedoc-Roussillon). Cette dernière caractéristique est retrouvée dans les données d’hospitalisation mais aussi dans celles de remboursement des tests anticorps anti-VHE prescrits en ville. Cette disparité géographique a été documentée dans une étude nationale de séroprévalence chez les donneurs de sang. La séroprévalence nationale anti-IgG VHE y était de 22,4% [IC95%: 21,6%-23,2%], mais nettement plus élevée dans les régions du Sud-Ouest, Sud-Est et Nord-Est 20. De plus, globalement 1% [0,8%-1,2%] des donneurs de sang avaient des IgM anti-VHE positives, ce qui pose la question de la sécurité transfusionnelle. Depuis 2015, des dons sont testés pour garder 20 à 30% du stock de plasma non infecté pour les besoins en transfusion, en particulier pour les personnes immunodéprimées. Des discussions sont en cours pour l’introduction d’un dépistage génomique viral systématique des dons de sang à partir de 2019.
La surveillance du CNR est la seule source documentant les tendances de la circulation des génotypes chez l’Homme. Le génotype 3 est retrouvé chez l’Homme et les Suidés (porcs, sangliers…) 21. Une étude française comparant les séquences virales VHE des cas autochtones d’hépatite E et de foies de porc collectés dans des abattoirs a montré une même distribution par sous-type dans les populations humaine et porcine, et plus de 99% d’homologie entre les séquences virales d’origine humaine et animale 22. Par ailleurs, une étude française a montré que le VHE circule dans 65% des élevages de porcs et que la prévalence de l’ARN VHE dans les foies de porc prélevés à l’abattoir, entrant donc dans la chaîne alimentaire, était de 4% 23.
La transmission par consommation de produits carnés contaminés crus ou insuffisamment cuits, en particulier à base de foie cru de porc comme les figatelli, a été suspectée puis documentée 12,13. En 2011, dans une étude nationale, les prévalences VHE dans les produits à base de foie de porc destinés à la consommation étaient de 3% dans les foies séchés et de 30% dans les figatelli 24. Dans l’étude nationale française chez les donneurs de sang, la prévalence anti-VHE était plus élevée parmi les personnes déclarant manger du porc, des saucisses de foie, du gibier et des abats 20. En conséquence, la consommation de foie ou de préparations à base de foie cru ou peu cuit représente un risque élevé de contamination par le VHE.
Une étude récente a estimé pour la métropole le nombre annuel de cas symptomatiques et de cas hospitalisés pour des pathogènes transmis à l’Homme par l’alimentation au cours de la période 2008-2013 25. Pour le VHE, les nombres annuels moyens de cas symptomatiques et de cas hospitalisés ont été estimés respectivement à 68 007 et 546, dont 59 320 et 482 par transmission alimentaire. Le fardeau du VHE est important ; la transmission alimentaire a peut-être été surestimée (75-100%) dans cette étude mais elle est à l’heure actuelle la voie de transmission la mieux documentée.
Enfin une étude cas-témoin nationale menée récemment par le CNR a étudié les facteurs de risque d’hépatite E en France. L’étude montre à nouveau un risque augmenté chez les patients consommant des saucisses à base de foie de porc et chez ceux en contact avec des animaux de ferme 26. Cette étude rapporte par ailleurs une fréquence importante de manifestations neurologiques secondaires à l’infection, notamment chez les patients immunocompétents.
Il est recommandé de cuire à cœur les produits les plus à risque, en particulier ceux à base de foie cru de porc (saucisses de foie fraîches ou sèches, figatelli) et les produits à base de sanglier ou de cerf. En effet, une cuisson à cœur à 71°C pendant 20 minutes permet d’inactiver le VHE 27. Un étiquetage obligatoire des produits à base de foie cru de porc a été mis en place en 2009, recommandant une cuisson à cœur. La consommation de ces produits, même cuits, est à déconseiller chez les personnes à risque de développer une forme grave d’hépatite E (patients immunodéprimés, patients atteints d’une hépatopathie chronique préexistante). Par ailleurs, la prévention des cas importés d’hépatite E repose sur les recommandations aux voyageurs sur les risques entériques, en particulier hydriques 28.
D’autres sources de contamination sont suspectées, comme la consommation de coquillages, de légumes ou fruits contaminés par contact avec une eau souillée. De plus, une contamination manuportée liée à une hygiène des mains insuffisante, par contact direct avec les animaux réservoirs vivants ou leurs carcasses (chasseurs, personnes travaillant dans les abattoirs, éleveurs, vétérinaires…) a aussi été suspectée 29. Enfin, des facteurs de risque environnementaux sont suspectés, en particulier le fait de vivre en milieu rural et le rôle d’autres potentiels animaux réservoirs (cervidés, lapins de garenne, rongeurs) 30.
En conclusion, grâce à l’évolution des connaissances scientifiques et des données de la surveillance, l’hépatite E est reconnue à ce jour comme une infection autochtone fréquente avec une transmission alimentaire, alors qu’elle était considérée comme une infection importée peu fréquente. Au vu des connaissances acquises, les suidés sont le principal réservoir en raison d’une prévalence importante de l’infection à VHE dans les élevages de porcs. Bien que les connaissances se soient améliorées, les sources et modes de contamination nécessitent d’être mieux explorés. Les premières études ont permis de documenter les expositions et de générer des hypothèses. À ce stade, ces hypothèses méritent d’être vérifiées par davantage d’études analytiques. Il est par ailleurs nécessaire, à ce jour, d’axer la recherche sur les mesures de contrôle possibles de la circulation du virus de l’hépatite E dans les élevages porcins dans les pays industrialisés, afin d’en diminuer la transmission à l’Homme. Comme pour toute infection d’origine alimentaire, la prévention repose sur les mesures de cuisson mais aussi sur l’information des consommateurs.
Remerciements
Aux Agences régionales de santé et aux Cellules d’intervention en région de Santé publique France (Cire), aux laboratoires Eurofins Biomnis et Cerba pour leur participation aux investigations et à la surveillance.




