Infections génito-urinaires et risque de cancer de la prostate : étude EPICAP
// Genito-urinary infections and prostate cancer risk: The French EPICAP study
Résumé
Introduction –
Les infections génito-urinaires, dont la prostatite, augmenteraient le risque de cancer de la prostate en raison de l’inflammation chronique qu’elles pourraient induire. Nous avons étudié l’association entre plusieurs infections génito-urinaires et le risque de survenue d’un cancer de la prostate (CaP) à partir des données de l’étude EPICAP.
Méthodes –
EPICAP est une étude cas-témoins réalisée en population générale dans le département de l’Hérault entre 2012 et 2014. Au total, 819 cas incidents et 879 témoins ont été inclus. Les facteurs de risque établis ou suspectés de CaP, ainsi que les antécédents personnels d’infections génito-urinaires (prostatite, urétrite, orchi-épididymite, pyélonéphrite aigüe) ont été recueillis à l’aide d’un questionnaire standardisé lors d’un entretien individuel. Les odds ratios (OR) et leur intervalle de confiance à 95% ont été estimés à l’aide d’une régression logistique non conditionnelle.
Résultats –
Globalement, 139 (18%) cas et 98 (12%) témoins ont déclaré avoir au moins un antécédent personnel d’infection génito-urinaire (OR=1,64 [1,23-2,20]). Ce risque était d’autant plus élevé que le nombre d’infections augmentait (p-tendance <0,05). Les antécédents personnels de prostatite chronique et de pyélonéphrite aiguë augmentaient plus spécifiquement le risque de survenue d’un CaP (OR=2,95 [1,26-6,92] et OR=2,66 [1,29-5,51], respectivement).
Conclusion –
Nos résultats renforcent l’hypothèse selon laquelle l’inflammation chronique, générée par des antécédents d’infections génito-urinaires, pourrait jouer un rôle dans la carcinogenèse prostatique.
Abstract
Introduction –
Genitourinary infections, including prostatitis, may increase the risk of prostate cancer due to chronic inflammation they may cause. We investigated the association between several genitourinary infections and the occurrence of prostate cancer (PCa) based on data from the EPICAP study.
Methods –
EPICAP is a population-based case-control study conducted in the Hérault district in France, between 2012 and 2014. A total of 819 incident cases and 879 controls were included. During a personal interview, a standardized questionnaire was used to collect data about known or suspected risk factors of PCa, and personal history of genitourinary infections (prostatitis, urethritis, orchi-epididymitis, acute pyelonephritis). Odds Ratios (OR) and their 95% confidence interval were estimated using multivariate unconditional logistic regression.
Results –
Overall, 139 (18%) cases and 98 (12%) controls reported having at least one personal history of genitourinary infections (OR=1.64 [1.23-2.20]). The risk increased with the number of infections (p-trend<0.05). The association was specifically observed with personal history of chronic prostatitis and acute pyelonephritis (OR=2.95 [1.26-6.92] and OR=2.66 [1.29-5.51], respectively).
Conclusion –
Our results support the hypothesis that chronic inflammation, generated by a personal history of genitourinary infections, may play a role in prostate carcinogenesis.
Introduction
Le cancer de la prostate (CaP) est le premier cancer chez l’homme dans les pays industrialisés, avec une incidence annuelle en France de 98 pour 100 000 hommes, soit 53 917 nouveaux cas diagnostiqués en 2011 1. Malgré une morbidité et une mortalité relativement importantes (près de 9 000 décès en France en 2011) 2, seuls l’âge, l’origine ethnique et les antécédents familiaux de CaP sont des facteurs de risques établis pour ce cancer et, en dehors de ces facteurs, son étiologie reste largement inexpliquée. Des études chez des migrants ont montré que les taux d’incidence dans des populations chinoises ou japonaises vivant aux États-Unis étaient beaucoup plus élevés que ceux observés dans leur pays natal, suggérant l’influence de facteurs environnementaux (au sens large du terme) ou liés au mode de vie 3.
Les grandes pistes de recherche actuelles concernant l’étiologie du cancer de la prostate se concentrent autour du rôle de l’environnement, des infections et de l’inflammation chronique, des hormones et du métabolisme, ainsi que des facteurs de prédisposition génétique, avec un intérêt croissant à l’égard des interrelations complexes qui pourraient exister entre ces différents facteurs.
L’inflammation chronique a été associée au développement de plusieurs cancers via un agent infectieux ou environnemental spécifique 4,5. Dans ce contexte, l’inflammation chronique de la prostate pourrait participer à la carcinogénèse prostatique 6,7. En effet, la présence d’infiltrats inflammatoires localisés près de zones d’atrophie inflammatoire proliférative (PAI) et de néoplasie intra-épithéliale prostatique (PIN), considérées comme des lésions prostatiques pouvant être précancéreuses, a contribué à renforcer l’hypothèse d’un lien possible entre l’inflammation chronique prostatique et le cancer de la prostate 6,7,8.
De nombreuses études épidémiologiques ont suggéré que les infections à tropisme prostatique pourraient également jouer un rôle dans la carcinogenèse prostatique en raison d’un éventuel rôle propre ou de l’inflammation chronique qu’elles entraîneraient 9,10. Parmi ces infections, les infections sexuellement transmissibles et les antécédents personnels de prostatite ont fait l’objet d’une attention croissante ces 20 dernières années, et certaines ont été associées positivement au risque de survenue du CaP 11,12,13. Cependant, les résultats étaient contradictoires d’une étude à l’autre et peu d’entre elles ont approfondi le lien observé avec les antécédents personnels de prostatite, notamment sur le caractère aigu ou chronique de la prostatite, le nombre de prostatites, le délai de survenue entre la prostatite et celle du CaP, ou encore sur leur rôle dans l’agressivité du CaP. Seule une étude canadienne récente a étendu l’étude des antécédents personnels de prostatite à d’autres infections génito-urinaires basses comme l’urétrite et l’orchi-épididymite 14. Aucune étude ne s’est intéressée à des infections urinaires hautes comme la pyélonéphrite aiguë.
Dans ce contexte, notre objectif était d’étudier le rôle de plusieurs infections génito-urinaires et leur combinaison dans le risque de survenue du cancer de la prostate à partir des données de l’étude EPICAP (EPIdémiologie du CAncer de la Prostate).
Matériel et méthode
L’étude EPICAP dans le département de l’Hérault (France) entre 2012 et 2014. Son objectif général était d’étudier le rôle des facteurs environnementaux et génétiques dans la survenue des cancers de la prostate 15.
Sélection des sujets
Les cas éligibles étaient tous les cas incidents, histologiquement confirmés, âgés de moins de 75 ans, ayant eu un premier diagnostic de CaP en 2012-2013 et résidant dans le département de l’Hérault au moment du diagnostic. Les cas étaient identifiés par recherche active et en temps réel par trois infirmières de recherche clinique dans l’ensemble des établissements et cabinets d’urologie du département prenant en charge ce type de patients.
Les témoins éligibles étaient des hommes âgés de moins de 75 ans, résidant dans le département de l’Hérault et ne déclarant pas de CaP au moment de leur inclusion dans l’étude.
Les témoins étaient identifiés par tirage au sort par un institut de sondage (Ipsos) à partir de fichiers d’appels intégrant les listes téléphoniques blanches et rouges. Des quotas ont été définis pour l’âge et la catégorie socioprofessionnelle (CSP). Les témoins étaient appariés aux cas par fréquence d’âge (classes d’âge de 5 ans). Ainsi, la distribution par âge des témoins reflétait la distribution par âge des cas de cancer. La répartition par CSP du groupe témoin reflétait la répartition par CSP de l’ensemble du département, connue d’après le recensement de la population, afin d’éviter des problèmes de sélection.
Au total, parmi les 1 098 cas et 1 109 témoins éligibles, 819 cas et 879 témoins ont été inclus, soit des taux de participation respectifs de 75% et 79% (figure).
Recueil des données
Le recueil des données a été effectué par les infirmières de recherche clinique au domicile des participants (cas et témoins) au cours d’un entretien en face-à-face assisté par ordinateur : système CAPI (Computer Assisted Personal Interview). Les conditions du recueil des données étaient analogues pour les cas et les témoins. À l’issue de l’entretien, des mesures anthropométriques (poids, taille, tour de taille, tour de hanches) ainsi qu’un prélèvement sanguin ou, à défaut, un recueil de salive ont été effectués.
Le questionnaire général standardisé permettait de recueillir des informations détaillées sur les caractéristiques sociodémographiques usuelles, les antécédents personnels médicaux et les traitements médicamenteux, l’historique du poids au cours de la vie, les antécédents familiaux de cancer, le mode de vie (consommations d’alcool et de tabac, activité physique), l’histoire résidentielle et l’histoire professionnelle complète.
Parmi les antécédents personnels d’infections génito-urinaires, des informations concernant les antécédents de prostatite, d’urétrite, d’orchi-épididymite et de pyélonéphrite aiguë ont été recueillies. Pour les antécédents de prostatite, le caractère aigu ou chronique ainsi que la date de survenue étaient également demandés.
Les données médicales spécifiques aux cas ont été recueillies par les infirmières de recherche clinique à partir du dossier médical des urologues au moment du diagnostic et complétées a posteriori par les données du registre des cancers de l’Hérault (valeur du PSA – prostate-specific antigen – au diagnostic, score de Gleason, stade TNM et traitements réalisés).
Analyses statistiques
Les analyses statistiques ont été réalisées à l’aide du logiciel statistique SAS® version 9.4 (SAS Institute Inc., Cary, NC, États-Unis).
Les antécédents d’infections génito-urinaires du groupe 1 ont été définis comme avoir eu au moins un antécédent de prostatite, d’urétrite ou d’orchi-épididymite. Les antécédents d’infections génito-urinaires du groupe 2 comprenaient ceux du groupe 1 plus les antécédents de pyélonéphrite aiguë.
Les odds ratios (OR) et leur intervalle de confiance à 95% (IC95%) ont été estimés à l’aide d’une régression logistique non conditionnelle, afin d’étudier les associations entre les infections génito-urinaires et le risque de cancer de la prostate. L’ensemble des analyses a été systématiquement ajusté sur l’âge, l’origine ethnique et les antécédents familiaux de cancer de la prostate. Des ajustements complémentaires sur la consommation régulière d’anti-inflammatoires non stéroïdiens, la présence d’une hypertrophie bénigne de la prostate (HBP) et l’indice de masse corporelle (IMC) ont également été réalisés.
Les analyses ont également été réalisées en fonction de l’agressivité tumorale définie par le score de Gleason (score faible : Gleason <7, score intermédiaire : Gleason égal à 7, score élevé : Gleason >7 ou 4+3). Ces analyses ont été effectuées à l’aide d’une régression logistique multinomiale non conditionnelle.
Plusieurs analyses de sensibilité ont également été réalisées afin de tester la robustesse de nos résultats. Nous avons notamment restreint le groupe des témoins à ceux ayant déclaré avoir eu un antécédent de dépistage du CaP normal afin de nous affranchir le plus possible des témoins qui pourraient être des cas potentiels, compte tenu de la fréquence de la maladie. Nous avons également restreint notre groupe témoins à ceux ayant déclaré avoir bénéficié de plus de cinq dosages de PSA afin de nous permettre de limiter un éventuel biais de détection.
Résultats
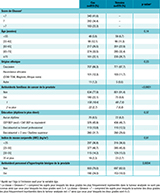
Les caractéristiques de la population d’étude sont décrites dans le tableau 1. Parmi les 819 cas inclus, 340 (42%) avaient un score de Gleason faible, 282 (34%) un score intermédiaire et 183 (22%) un score élevé.
La distribution d’âge des cas par classes de cinq ans était similaire à celle observée chez les témoins (p=0,14) et un âge moyen de 65 ans était observé pour les cas et les témoins (p=0,53). La population d’étude était d’origine caucasienne pour 86% des cas et 88% des témoins (p=0,23). Le niveau d’éducation était comparable entre les cas et les témoins, avec près de la moitié des sujets non titulaires du baccalauréat (p=0,37). L’IMC mesuré au moment de l’entretien était également comparable entre les cas et les témoins (p=0,91). En revanche, les cas avaient plus fréquemment déclaré un antécédent personnel d’hypertrophie bénigne de la prostate que les témoins (p=0,0004).
Comme attendu d’après la littérature, les antécédents familiaux de cancer de la prostate étaient plus fréquents chez les cas que chez les témoins (p<0,0001).
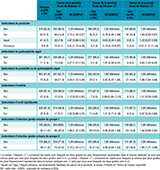
Le tableau 2 présente les associations entre chacune des infections génito-urinaires étudiées et le risque de survenue de CaP, ainsi que les associations pour l’ensemble des infections génito-urinaires. Avec une prévalence des antécédents personnels de prostatite de 10% chez les cas et 7% chez les témoins, nous avons observé une association statistiquement significative entre un antécédent personnel de prostatite et le risque de cancer de la prostate (OR=1,49 ; IC95%: [1,05-2,12]). Cette association était spécifiquement observée chez les sujets ayant un antécédent personnel de prostatite chronique (OR=2,95 [1,26-6,92]). En revanche, aucune association n’a été observée avec le nombre de prostatites.
Une association significative était également observée avec un antécédent personnel de pyélonéphrite aiguë (OR=2,66 [1,29-5,51]). En revanche, aucune association n’a été observée avec les antécédents personnels d’urétrite ou d’orchi-épididymite.
Globalement, la prévalence de l’ensemble des infections génito-urinaires, dans notre population, était de 18% chez les cas et 12% chez les témoins. Avoir au moins un antécédent personnel d’infections génito-urinaires était significativement associé à une augmentation du risque de CaP (OR=1,46 [1,08-1,98] pour les infections du groupe 1 et OR=1,64 [1,23-2,20] pour les infections du groupe 2 ; p-tendance <0,05) ; le risque augmentait avec le nombre d’infections (OR=2,26 [0,90-5,68] pour deux ou plus infections du groupe 1 et OR=2,45 [1,04-5,76] pour deux ou plus infections du groupe 2).
 Agrandir l'image
Agrandir l'image
L’ensemble des associations était plus spécifiquement observé pour les cancers de faible score et pour ceux de score élevé (tableau 3). Avoir au moins un antécédent personnel d’infections génito-urinaires était associé positivement aux cancers de faible grade (OR=2,19 [1,54-3,11]) et de grade élevé (OR=1,90 [1,21-2,98]), alors qu’aucune association n’était observée pour les cancers de score intermédiaire (OR=0,99 [0,64-1,53]).
 Agrandir l'image
Agrandir l'image
Discussion
Globalement, nous avons observé une association entre les antécédents d’infections génito-urinaires et le risque de survenue d’un CaP (OR=1,64 [1,23-2,20]). Cette association concernait spécifiquement les antécédents personnels de prostatite chronique (OR=2,95 [1,26-6,92]) et de pyélonéphrite aiguë (OR=2,66 [1,29-5,51]). L’ensemble des associations était observé, en particulier pour les cancers de score faible et ceux de score élevé.
Ces résultats sont issus d’une étude cas-témoins réalisée en population générale dans le département de l’Hérault. Ce type d’étude est en effet bien adapté pour étudier simultanément un grand nombre de facteurs de risque, comme prévu dans le protocole EPICAP 15. La réalisation d’une étude en population générale (recrutement exhaustif de cas incidents dans une zone géographique bien déterminée et recrutement raisonné de témoins en population), la mise en place de quotas sur l’âge (témoins comparables aux cas) et la CSP (témoins comparables à la population de l’Hérault), ainsi qu’un biais de survie limité (huit décès, soit 0,7% des cas éligibles) ont permis de minimiser un possible biais de sélection et constituent ainsi une des forces de notre étude.
Toutefois, une limite de notre étude concerne l’auto-déclaration des antécédents personnels d’infections génito-urinaires, qui peut engendrer un possible biais de mémorisation ou de classement. Néanmoins, le recueil des données par questionnaire standardisé, les conditions d’entretien analogues chez les cas et les témoins, la spécificité des associations observées (antécédents personnels de prostatite chronique et de pyélonéphrite aigüe), une prévalence d’antécédents personnels de prostatite comparable à celle observée dans les pays d’Amérique du Nord 16 ainsi que la relation « dose-réponse » observée pour l’ensemble des infections génito-urinaires ont permis de minimiser ces biais potentiels.
Les résultats observés soulèvent également la possibilité d’un éventuel biais de détection. Néanmoins, le délai moyen entre les antécédents personnels de prostatite et la date de référence (date de diagnostic pour les cas et date de l’entretien pour les témoins) était de 16,7 ans chez les cas et de 10,7 ans chez les témoins (p=0,09). De plus, les analyses réalisées chez les sujets n’ayant pas déclaré un antécédent personnel d’hyperplasie bénigne de la prostate, ainsi que l’analyse de sensibilité restreignant le groupe de témoins à ceux ayant déclaré avoir eu plus de cinq dosages de PSA, ne modifiaient pas nos résultats. L’ensemble de ces arguments va à l’encontre d’un éventuel biais de détection.
Après prise en compte de potentiels facteurs de confusion comme les antécédents familiaux de CaP, facteur de risque établi de CaP, ainsi que d’autres facteurs comme le niveau d’éducation, l’IMC ou encore un antécédent personnel d’hyperplasie bénigne de la prostate (plus fréquent chez les cas que chez les témoins), nos résultats restent inchangés.
À notre connaissance, 32 études se sont intéressées au rôle des antécédents personnels de prostatite sur le risque de survenue d’un cancer de la prostate. À l’exception d’une étude canadienne récente 14, la totalité de ces études a fait l’objet de deux méta-analyses incluant des études cas-témoins réalisées entre 1971 et 2012 12,13. Les méta-ORs calculés étaient de 1,57 [1,01-2,45] et de 1,64 [1,36-1,98] respectivement, très proches des résultats que nous avons observés ainsi que de ceux observés dans l’étude canadienne (OR=1,81 [1,44-2,27]) 14. Néanmoins, sur l’ensemble de cette littérature, une seule étude s’est intéressée au caractère chronique de la prostatite, observant une association pour un antécédent personnel de prostatite d’une durée supérieure à un an 17. De même, seule l’étude canadienne s’est intéressée à d’autres infections génito-urinaires basses que les antécédents de prostatite, en observant une augmentation du risque de CaP pour l’ensemble des infections génito-urinaires (OR=1,34 [1,14-1,58]). Nous avons observé des résultats très similaires avec un OR de 1,46 [1,08-1,98] et de 1,64 [1,23-2,20] lorsque nous avons également inclus les antécédents personnels de pyélonéphrites aiguës, encore jamais étudiés dans la littérature. La pyélonéphrite est une infection urinaire haute très rare chez l’homme, qui pourrait, néanmoins, refléter les conséquences d’une prostatite symptomatique.
Très peu d’études disposaient d’informations relatives au caractère agressif ou non du CaP. Nos associations, observées spécifiquement chez les sujets ayant un cancer de faible score et un cancer de score élevé, étaient également similaires à celles observées dans l’étude canadienne. Ces résultats pourraient être expliqués par un possible biais de détection pour les associations observées chez les sujets de score de Gleason faible. En revanche, les associations observées chez les sujets de score de Gleason élevé étaient en faveur d’un risque de cancer plus agressif chez les sujets ayant un antécédent d’infection génito-urinaire.
En conclusion, nos résultats renforcent l’hypothèse selon laquelle l’inflammation chronique, générée par des antécédents d’infections génito-urinaires, pourrait jouer un rôle dans la carcinogenèse prostatique. Afin d’approfondir ces résultats et d’aller plus loin dans l’hypothèse du rôle de l’inflammation chronique dans le risque de survenue du CaP, nos futures analyses porteront sur le rôle d’autres infections telles que les infections sexuellement transmissibles, ainsi que sur celui des polymorphismes des gènes impliqués dans la réponse immunitaire aux infections et à l’inflammation.
Financements
L’étude EPICAP a été financée par la Ligue nationale contre le cancer, la Ligue contre le cancer du Val-de-Marne, la Fondation de France et l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail.
Remerciements
Nous remercions les infirmières de recherche clinique (AL. Astolfi, C. Bernard, O. Boyer, MH. De Campo, S. Margaroli, L. N’Diaye, S. Perrier-Bonnet) qui ont interrogé les participants de l’étude, ainsi que l’ensemble des services d’urologie du département, qui nous ont permis de recruter les sujets atteints d’un cancer de la prostate.
Nous tenons également à remercier l’ensemble des membres du EPICAP Study Group :
Urologues : D. Ayuso, B. Segui (Centre Hospitalier Bassin de Thau, Sète) ; A. Guillaume, JP. Constans, O. Delbos, P. Lanfray, D. Rizet, E. Cuénant (Cabinet d’urologie du Polygone, Montpellier) ; M. Locci (Centre hospitalier, Béziers) ; E. Cuénant (Clinique Sainte Thérèse, Sète) ; N. Drianno, B. Marc, P. Soares (Polyclinique Saint-Privat, Béziers) ; A. Faix, S. Abdel Hamid, B. Segui (Service d’urologie, Clinique Beau Soleil, Montpellier) ; S. Abdel Hamid, (Clinique Saint-Louis, Ganges) ; R. Thuret, L. Cabaniols, M. Robert (CHU, Hôpital Lapeyronie, Montpellier).
C. Prad, N. Soller (Registre des tumeurs de l’Hérault, Montpellier).
Anatomopathologistes : D. Brel, L. Schweizer, P. Nayraud, C. Lecam-Savin (Béziers) ; R. Daniel, JB Perdigou, C. Compan, M. Granier, JL Bouzigues, E. Broquerie, J. Simony, F. Bibeau, P. Baldet, I. Serre (Montpellier), ML Gaume (Sète).
F. Montels (Service de biologie médicale, Institut du cancer de Montpellier).
Laboratoires de biologie : Mr Dumas (Béziers) ; Mme Buono (Sète) ; Mme Bonnefille (Lodève) ; Mr Ruiz (Lunel) ; Mr Paleirac (Clermont-l’Hérault).