Quel déploiement du Programme national de dépistage organisé du cancer du col de l’utérus en France en 2022 ?
// Deployment of the national organized screening programme for cervical cancer in France, 2022
Résumé
Contexte –
Chaque année en France, le cancer du col de l’utérus touche près de 3 000 nouvelles femmes et cause 1 100 décès, alors que l’Organisation mondiale de la santé (OMS) a indiqué que ce type de cancer pouvait être éradiqué grâce au dépistage et à la vaccination contre le papillomavirus humain. Depuis 2018, le dépistage du cancer du col de l’utérus en France repose sur le Programme national de dépistage organisé du cancer du col de l’utérus (PNDOCCU). L’objectif de ce travail était d’observer les pratiques de dépistage après la mise en place du PNDOCCU et l’intégration du test HPV dans le dépistage en 2020 (pour les femmes âgées de 30 à 65 ans) à partir de données de vie réelle.
Méthode –
Les données proviennent du Système national des données de santé (SNDS), qui couvre l’ensemble de la population française. Tous les actes de dépistage du cancer du col de l’utérus chez les femmes âgées de 25 à 65 ans de 2017 à 2022 ont été extraits.
Résultats –
En 2022, le PNDOCCU était à un stade de déploiement inégal selon les régions, pouvant s’expliquer en partie par des retards de mises en place causés par la pandémie de Covid-19. En 2022, 4,77 millions de tests ont été effectués dont 530 871 suite à une invitation. Le test HPV représentait 72% des actes de dépistage chez les femmes âgées de 30 à 65 ans. La proportion de tests sur invitation était de 11,1% : 10,3% chez les 25-29 ans, 9,6% chez les 30-39 ans, 10,0% chez les 40-49 ans, 12,4% chez les 50-59 ans et 15,8% chez les 60-65 ans.
Conclusion –
Grâce aux données du SNDS, il a été possible de mettre en évidence une évolution positive des pratiques pour tendre vers les recommandations en vigueur. D’autres explorations sont à mener concernant les parcours de dépistage : profil des femmes, rôle des invitations sur la participation à long terme.
Abstract
Background –
Each year in France, nearly 3,000 women develop cervical cancer and 1,100 die from the disease, yet the World Health Organization (WHO) considers that it is possible to eradicate this type of cancer through screening and HPV vaccination. In 2018, France launched an organized national screening programme for cervical cancer. Our objective was to observe screening practices after the programme’s rollout and after the integration of HPV testing into screening in 2020 (for women aged 30 to 65 years) using real-life data.
Method –
We used data from the French National Health Data System (SNDS), which covers the entire French population. All procedures related to cervical cancer screening for women aged 25 to 65 years from 2017 to 2022 were extracted.
Results –
In 2022, the programme was unequally deployed across regions, primarily due to implementation delays caused by the COVID-19 pandemic. In 2022, 4.77 million tests were carried out, 530,871 of them by invitation. The HPV test accounted for 72% of screening procedures among women aged 30 to 65. The proportion of screenings by invitation was 11.1%: 10.3% (25–29-year-olds), 9.6% (30–39), 10.0% (40–49), 12.4% (50–59), and 15.8% (60–65).
Conclusion –
The data from the SNDS has highlighted that cervical cancer screening practices are moving towards compliance with the recommendations in force. Further investigations on screening pathways are necessary, including women’s profiles and the role of invitations in long-term participation.
Contexte
L’Organisation mondiale de la santé (OMS) vise à éradiquer le cancer du col de l’utérus (CCU) en recommandant le dépistage et la vaccination contre le papillomavirus humain (HPV) responsable de ce cancer 1.
En France, en 2018, 2 920 nouveaux cas du CCU et 1 117 décès ont été estimés 2. Le taux de couverture triennal du dépistage du CCU (encadré 1) pour la période 2016-2018 chez les femmes âgées de 25 à 65 ans était de 59,6%, avec des disparités selon les régions et les classes d’âge. En effet, la couverture diminue significativement avec l’âge à partir de 50 ans, pour atteindre 44,4% à 60-65 ans. Les disparités géographiques étaient également marquées, avec des taux allant de 16,7% (Mayotte) à 69% (Bas-Rhin). Les taux de couverture les plus faibles (<50%) se retrouvaient en Seine-Saint-Denis ainsi que dans les DROM (départements et régions d’outre-mer), à l’exception de La Réunion 5.
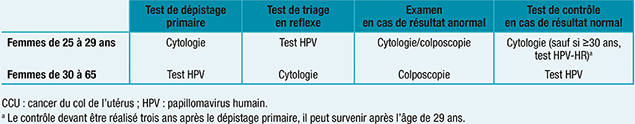
–Co-testing : réalisation systématique d’une cytologie et d’un test de détection du papillomavirus à haut risque (HPV-HR) quel que soit le résultat de l’un ou l’autre des tests ;
–Test de dépistage primaire : test utilisé en première intention dans le cadre du dépistage (test HPV ou examen cytologique selon l’âge de la femme) ;
–Test de triage : test effectué en seconde intention après un test de dépistage primaire anormal ou positif, son résultat permet de définir la conduite à tenir ;
–Test réflexe : test de triage réalisé à partir du même prélèvement que le test de dépistage primaire ;
–Séquence de dépistage : elle comprend le test de dépistage primaire suivi du test de triage le cas échéant ;
–Dépistage spontané : dépistage réalisé à la demande de la femme ou suite à une incitation par un professionnel de santé ;
–Taux de couverture du dépistage organisé du cancer du col de l’utérus : nombre de femmes de 25 à 65 ans ayant réalisé au moins un dépistage en 3 ans et 6 mois sur la population éligible (population Insee – Institut national de la statistique et des études économiques –, femmes ayant subi une hystérectomie totale exclues).
En France jusqu’en 2018, le dépistage du CCU était avant tout fondé sur un dépistage cytologique triennal spontané, conjugué avec des expérimentations locales ou régionales de dépistage organisé (reposant notamment sur des invitations par courrier de femmes non participantes) 6. Un Programme national de dépistage organisé du cancer du col de l’utérus (PNDOCCU) a été mis en place en 2018 avec pour objectif de réduire l’incidence ainsi que la mortalité par CCU de 30% à 10 ans. Pour atteindre cet objectif, le PNDOCCU avait pour objectifs secondaires d’augmenter le taux de couverture de dépistage à 80%, de réduire les inégalités sociales de dépistage et d’améliorer la qualité des pratiques professionnelles. Lors du déploiement du PNDOCCU, une modification de la séquence de dépistage est intervenue chez les femmes de 30 à 65 ans (encadré 2). Le PNDOCCU repose sur :
–un processus d’invitations et de relances à destination des femmes non à jour de leur dépistage ;
–le suivi de la population cible ayant obtenu des résultats anormaux ou positifs au test de dépistage qu’elles aient participé spontanément (dépistage spontané) ou qu’elles aient été invitées par courrier à participer (dépistage sur invitation) ;
–un renforcement de l’information des professionnels de santé et des femmes ;
–des actions spécifiques ou des stratégies complémentaires (soutien au dépistage, médiation sanitaire, autotests, unités mobiles, etc.) ;
–et la diversification des préleveurs par la formation.
Les modalités de dépistage et de suivi du CCU sont fondées sur les recommandations de la Haute Autorité de santé (HAS) et de l’Institut national du cancer (INCa). La population cible concerne les femmes immunocompétentes âgées de 25 à 65 ans n’ayant pas subi d’hystérectomie totale, vaccinées ou non contre le HPV. Le test HPV, présentant une meilleure sensibilité que le test cytologique, est préconisé en dépistage primaire tous les cinq ans pour les femmes de 30 à 65 ans. Entre 25 et 29 ans, les recommandations antérieures continuent de s’appliquer.
Ainsi après le remboursement effectif de l’acte en mars 2020 par l’Assurance maladie, le schéma de dépistage suivant s’applique selon la classe d’âge :
–pour les femmes de 25 à 29 ans asymptomatiques un test cytologique tous les trois ans (après deux tests normaux consécutifs réalisés à un an d’intervalle). En cas de cytologie anormale, un test HPV réflexe sera réalisé ;
–pour les femmes âgées de 30 à 65 ans asymptomatiques, un test HPV de dépistage primaire. En cas de test HPV positif, une cytologie réflexe sera réalisée Le co-testing n’est pas recommandé en dépistage.
La mise en œuvre du programme en région s’appuie sur les centres régionaux de coordination des dépistages des cancers (CRCDC) 10.
Ce travail décrit les pratiques de dépistage en 2022 à partir de données de vie réelle quasi-exhaustives. Il s’intéresse à la réalisation du test suite à une invitation quatre années après la mise en place du PNDOCCU, ainsi qu’à l’intégration du test HPV dans le dépistage primaire en 2020.
Matériel et méthodes
Source de données
Les données proviennent du Système national des données de santé (SNDS) 11 couvrant la quasi-exhaustivité de la population française, y compris les DROM (66 millions d’habitants). Cette base collige toutes les prestations présentées au remboursement de l’Assurance maladie (séjours hospitaliers, soins ambulatoires, tests de biologie ou anatomopathologie) dans les établissements de santé publics et privés et les cabinets libéraux avec leur date d’exécution. Les identifiants des personnes sont pseudonymisés mais ils permettent de relier les différentes prestations d’une même personne. Les résultats des examens médicaux ne sont pas recueillis.
Collecte des données
Tous les actes de dépistage du CCU réalisés de 2017 à 2022 pour les femmes âgées de 25 à 65 ans ont été extraits (examens cytopathologiques (EC) et/ou tests HPV, réalisés spontanément ou sur invitation) et caractérisés par date, âge et département de résidence de la femme. Le libellé du code a permis de distinguer le type de test de dépistage (EC/HPV) et les modalités de dépistage (spontané/invitation) (annexe).
Analyses statistiques
L’activité a été décrite en nombre d’actes et de femmes ayant bénéficié d’au moins un acte, stratifiée par période, classes d’âge, type de test de dépistage (EC/HPV), modalité de dépistage (spontané/invitation) et région de résidence de la femme.
Pour une année, le nombre de dépistages et de femmes concernées est calculé de façon triennale (année de référence plus les deux années précédentes) conformément au rythme de dépistage de 3 ans.
En effet, malgré le changement de fréquence du test dépistage depuis 2019 (5 ans au lieu de 3 ans), le premier test HPV devant être réalisé 3 ans après le dernier test cytologique, la période de trois ans reste adaptée pour l’observation des pratiques jusqu’en 2022.
L’analyse a par ailleurs identifié la réalisation de test HPV chez les femmes de 25-29 ans alors que la cytologie est recommandée dans cette classe d’âge, et la réalisation de cytologie chez les femmes de 30-65 ans alors que le test HPV est recommandé dans cette classe d’âge.
Approbation éthique
Cette étude a été réalisée dans le cadre de l’accès permanent au SNDS dont dispose l’Institut national du cancer (INCa) (décret n°2016-1871 du 26 décembre 2016 relatif au traitement de données à caractère personnel dénommé « Système national des données de santé »).
Résultats
Résultats généraux
Environ 4,5 millions de tests de dépistage (EC ou HPV) sont réalisés annuellement. En 2017, avant le déploiement du PNDOCCU, 4,729 millions de tests ont été réalisés pour 4,377 millions de femmes âgées entre 25 et 65 ans. En 2022, 4,768 millions de tests ont été réalisés pour 3,927 millions de femmes âgées entre 25 et 65 ans. En 2020, par rapport à 2019, le nombre total de tests et le nombre de femmes ayant eu au moins un test avaient diminué respectivement de 6,4% et de 10,2% (figure 1a), diminution partiellement compensée par une augmentation en 2021.
 Agrandir l'image
Agrandir l'imageSur les trois périodes de trois ans incluant l’année 2020 du premier confinement (2018-2020, 2019-2021 et 2020-2022), le nombre de femmes ayant eu un test de dépistage a diminué respectivement de 3,2%, 1,4% et 0,8% par rapport à la période 2017-2019 avant Covid-19 (figure 1b). En 2020, hormis de mars à mai, le volume d’activité mensuel était similaire aux années précédentes (figure 2).
 Agrandir l'image
Agrandir l'imageAugmentation du nombre de dépistages (EC ou test HPV) sur invitation
En 2022, 530 871 dépistages sur invitation avaient eu lieu avec une augmentation progressive de la part des dépistages sur invitation depuis 2018 (0,4%) jusqu’à 2022 (11,1%). La proportion de dépistage sur invitation selon l’âge était en 2022 de 10,3% chez les 25-29 ans, de 9,6% chez les 30-39 ans, de 10,0% chez les 40-49 ans, de 12,4% chez les 50-59 ans et de 15,8% chez les 60-65 ans.
Parmi les 25-29 ans, la proportion de tests sur invitation était plus élevée pour les femmes de 26 ans (13,1 %) que pour les autres (25 ans : 7,4%, 27 ans : 10,1%, 28 ans : 9,8% et 29 ans : 10,5%).
De fortes disparités régionales du pourcentage de tests réalisés suite à une invitation étaient observées, les extrêmes étant en Guyane (2,2%) et à Mayotte (73%) (tableau 1). Des écarts existaient également en France métropolitaine (de 4,7% en Bourgogne-Franche-Comté à 17,7% en Pays de la Loire), et quelle que soit la tranche d’âge.
 Agrandir l'image
Agrandir l'imageIntégration des nouvelles recommandations dans les pratiques
En 2022, 3,160 millions de tests HPV avaient été réalisés, soit une augmentation de la proportion de 4% en 2018 à 66,3% en 2022 (2019 : 4,4%, 2020 : 26,8%, 2021 : 61,2%). Chez les femmes de 30-65 ans, cette proportion était de 72,4% (tableau 1), l’augmentation était marquée dès mai 2020, et les tests HPV devenaient plus nombreux que les EC dès décembre 2020 (figure 3).
 Agrandir l'image
Agrandir l'imageDans la classe d’âge 30-65 ans, la proportion de tests HPV variait selon les régions de 62,0% (Guyane) à 82,0% (Normandie) (tableau 1).
Tests HPV chez les femmes âgées de 25 à 29 ans en 2022
Les tests HPV ont été réalisés après une cytologie datant de moins de 7 jours (64,9%), de moins de 4 mois (2,3%) ou de plus de 4 mois (11,4%). Pour 17,0% des femmes, il s’agissait du seul dépistage retrouvé depuis 2017 après l’âge de 25 ans et pour 4,4% des femmes le précédent dépistage était également un test HPV (tableau 2). Dans 14,8 % des cas, une cytologie et un test HPV étaient réalisés le même jour.
 Agrandir l'image
Agrandir l'imageExamen cytologique chez les femmes âgées de 30 à 65 ans en 2022
L’EC a été réalisé après un test HPV datant de moins de sept jours pour 52,6% des femmes de 30 à 65 ans, de moins de quatre mois pour 1,6% d’entre elles ou de plus de quatre mois pour 3,9%. Pour 5,2% des femmes, il s’agissait du seul dépistage retrouvé depuis 2017 après l’âge de 25 ans et pour 36,6% des femmes le précédent dépistage était également une cytologie (tableau 2). Dans 19,5% des cas, une cytologie et un test HPV étaient réalisés le même jour.
Discussion
Principaux résultats
Cette étude est la première sur la mise en place du PNDOCCU en France sur des données nationales quasi exhaustives en vie réelle (SNDS), représentant plus de 98% de la population française. L’objectif de ce travail était d’observer les pratiques de dépistage après la mise en place du programme national en 2018 et l’intégration du test HPV dans le dépistage en 2020. En 2022, quatre ans après le déploiement du PNDOCCU, les tests HPV représentaient 2/3 des tests réalisés chez les femmes de 25-65 ans et près de 3/4 (72,4%) parmi les femmes de 30-65 ans. Plus d’un test de dépistage sur 10 (11,1%) était réalisé à la suite d’une invitation.
Augmentation du nombre de dépistages sur invitation
C’est parmi les femmes de 60-65 ans que la participation sur invitation est la plus élevée. Chez les femmes de 25 à 29 ans la participation est plus élevée chez les 26 ans (13,1%). Le premier dépistage devant être réalisé à l’âge de 25 ans, cela met en évidence le rôle clé de l’invitation dans l’entrée dans le dépistage.
Le PNDOCCU a débuté en 2018 avec un premier envoi d’invitations en 2019. Afin de contrôler la montée en charge des invitations et limiter les pertes de chance pour les femmes, les CRCDC ont commencé par inviter les femmes d’âges les plus élevés (0,9% de participation sur la base de l’invitation du CRCDC), puis la pandémie a retardé l’extension des invitations aux groupes plus jeunes en 2020. En 2021, environ 80% des CRCDC ont déclaré avoir invité toutes les femmes éligibles (données INCa non publiées). Sur la période 2018-2020, le taux de couverture du dépistage est nettement plus faible pour les femmes de 60-65 ans (45%) que pour les plus jeunes (65% à 25-45 ans) 5. Les invitations n’étant envoyées qu’aux femmes n’ayant pas fait de dépistage depuis trois ans, ceci a probablement conduit à inviter une part plus importante de femmes de plus de 60 ans et pourrait expliquer le pourcentage de dépistage sur invitation plus élevé pour cette classe d’âge. Néanmoins, le pourcentage de dépistage sur invitation parait encore insuffisant pour compenser le faible taux de couverture après 60 ans.
Des variations régionales du pourcentage de dépistage sur invitation sont constatées y compris en France métropolitaine. Le pourcentage est élevé dans les DROM (sauf en Guyane), régions où le taux de couverture du dépistage était le plus faible 6.
À Mayotte, le dépistage du CCU a été déployé par un CRCDC nouvellement créé qui organise la réalisation des prélèvements via des stratégies « d’aller vers » et centralise la réception des résultats de cytologies et de biologie. Cette organisation particulière, adaptée aux spécificités et contraintes du territoire et aux caractéristiques de sa population, explique le niveau élevé de participation sur invitation toutes classes d’âges confondues (73%). Toutefois, les données de Mayotte concernent les femmes affiliées à la Sécurité sociale avec des droits ouverts (AME comprise). Il est probable que, même si les femmes non affiliées représentent un faible pourcentage, les données des tests de dépistage soient sous estimées par le SNDS (données INCa non publiées).
Intégration du test HPV dans le dépistage primaire
Une augmentation du nombre de tests HPV a été constatée depuis son remboursement par l’Assurance maladie en mars 2020 dans l’indication de dépistage primaire pour les femmes de 30 à 65 ans. Malgré cette forte progression, la transition (EC, test HPV) n’était pas complète en 2022 et de probables pratiques non conformes aux recommandations ont été mises en évidence. Ainsi, alors que les cytologies ne sont recommandées de 30 à 65 ans qu’après un test HPV positif, pour 36,6% des femmes de 30-65 ans ayant eu une cytologie en 2022, le précédent dépistage était également une cytologie. Alors que chez les femmes de 25-29 ans, la cytologie est recommandée en dépistage primaire, des tests HPV ont été retrouvés pour des femmes dont c’était le seul dépistage depuis 2017 après l’âge de 25 ans (17,0% des femmes avec test HPV en 2022) ou dont le précédent test était un test HPV (4,4%).
Une femme sur 7 (14,8%) de 25 à 29 ans a eu un test HPV et un EC le même jour. Ce taux est plus élevé qu’attendu, car seuls 4% des tests cytologiques de dépistage révèlent une anomalie et, parmi ceux-ci, environ 70% nécessiteraient un test HPV 6,7. Il n’est pas possible de différencier l’indication des tests HPV inclus dans ces résultats, mais probablement qu’une partie de cette proportion de 14,8% est liée à des pratiques de co-testing, bien que non recommandées en France. Près d’une femme sur cinq (19,5%) âgée de 30 à 65 ans a eu un test HPV et une cytologie le même jour. Ce taux est également plus élevé que les 10 à 15% de tests HPV-HR positifs attendus 7,8,9.
En 2022, 17,0% des femmes de 25 à 29 ans testées pour le HPV n’avaient aucun autre dépistage depuis 2017. Là encore, en l’absence de cotations différenciées entre test HPV de dépistage et test HPV de contrôle, il n’est pas possible d’écarter l’hypothèse de pratiques non conformes aux recommandations. De plus, des disparités régionales sont à noter dans la montée en charge des tests HPV.
Ces constats illustrent la nécessité de poursuivre la conduite du changement auprès des professionnels afin que les pratiques soient conformes aux recommandations, et de limiter les disparités d’une région à l’autre.
La crise Covid-19 et la mise en place du PNDOCCU
Comme dans de nombreux pays 12,13,14,15,16,17,18, la crise sanitaire liée au Covid-19 a eu un impact sur la participation aux dépistages, notamment organisés, des cancers en France (cancer du sein 19, cancer colorectal 20 et cancer du col de l’utérus), en particulier pendant la période de confinement strict entre le 17 mars et le 11 mai 2020. Durant cette période, l’envoi des invitations aux dépistages organisés par les CRCDC a été interrompu, avec une reprise progressive entre juin et septembre 2020. Toutefois, cette baisse de participation a été partiellement compensée dans les autres mois de la période cumulée 2020-2021.
La situation particulière française (mise en place du programme et transition vers le test HPV) concernant le PNDOCCU lors de la crise Covid-19 rend difficile la comparaison avec les autres pays, qui ont soit un déploiement du programme effectif avec une transition des tests HPV réalisés pour les femmes d’âge supérieur à 30 ans (Pays-Bas, Turquie) , soit des recommandations pour la tranche d’âge au test HPV différentes (Pays de Galles), soit un déploiement du programme envisagé avec une transition vers le test HPV effectuée (Royaume-Uni, Finlande, Suède) 21. Ainsi, sur les trois périodes de trois ans incluant l’année 2020 du premier confinement, le nombre de femmes ayant eu un test de dépistage a diminué. Cette diminution peut s’expliquer par la baisse importante du nombre d’actes de mars à mai 2020, en raison du premier confinement. Toutefois, nous constatons sur le territoire français que la baisse du nombre d’actes de dépistage du CCU a été moins prononcée que celle du cancer du sein et du cancer colorectal 19,20. Cela est dû au fait que les invitations au dépistage du CCU ciblent les femmes non participantes, contrairement aux deux autres programmes qui visent l’ensemble de la population. En effet, la principale modalité d’entrée dans le dépistage repose sur le dépistage spontané. Ainsi, une partie du dépistage spontané a été maintenue, l’activité des professionnels impliqués dans le dépistage du CCU ayant été moins affectée par la pandémie que celle des professionnels chargés des autres dépistages organisés (radiologues et médecins généralistes). La participation initiale au dépistage du CCU est également plus élevée 6.
Le PNDOCCU aura atteint ses objectifs s’il permet que chaque femme réalise le dépistage selon les recommandations. La connaissance conjointe du taux de participation et de la part des dépistages sur invitation est nécessaire à l’évaluation du programme pour s’assurer que les invitations compensent l’absence de participation spontanée. À cet effet, d’autres travaux menés sur les données du SNDS ont permis de montrer que les trajectoires de dépistage sur sept ans des femmes ayant réalisé un dépistage en 2021 différaient selon que ce dépistage était spontané ou sur invitation. Les femmes sans dépistage ou avec des dépistages trop distants étaient surreprésentées parmi celles ayant réalisé un dépistage sur invitation 22.
Limites
La non-distinction dans le codage actuel des tests HPV primaires et des tests de contrôle ne permet pas d’identifier les pratiques inadaptées, non conformes aux recommandations en vigueur, et de mettre en place des actions de formation ciblées pour les professionnels de santé. Une sensibilisation auprès des professionnels et de l’Assurance maladie pour améliorer la qualité des données et, par-delà la qualité du programme, serait bénéfique.
De même, la pratique de codage actuelle de l’acte ne permet pas d’identifier correctement le prescripteur via le SNDS. Cette information, si elle était exploitable, serait utile pour guider les efforts de formations ou d’informations à mettre en œuvre selon les différentes catégories de prescripteurs (médecins généralistes, gynécologues ou sages-femmes). Une sensibilisation des biologistes et anatomopathologistes à la codification serait bénéfique pour améliorer la qualité des données.
Conclusion
Le programme de dépistage organisé du cancer du col de l’utérus est en cours de déploiement au niveau national, les données du Système national des données de santé montrent une évolution rapide des pratiques pour tendre vers les recommandations en vigueur. Cependant des disparités entre régions peuvent être dues pour partie à la pandémie de Covid-19 en 2020.
D’autres explorations sont à mener concernant les parcours de dépistage : profil des femmes, rôle des invitations sur la participation à long terme.
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.
Références
Citer cet article
 Agrandir l'image
Agrandir l'image



