Infections à Echinococcus spp. en France hexagonale : évolution de l’incidence des nouvelles hospitalisations sur la période 2006-2022
// Echinococcus spp. infections in mainland France: Evolution of the incidence of new hospitalizations, 2006–2022
Résumé
Introduction –
L’échinococcose alvéolaire (EA) est une zoonose due à l’infection de l’être humain par le parasite Echinococcus multilocularis, et l’échinococcose kystique (EK) est due à Echinococcus granulosus. Nous avons utilisé les données du Programme de médicalisation des systèmes d’information (PMSI) pour analyser les tendances géographiques et temporelles de l’incidence de nouveaux cas hospitalisés avec échinococcose en France hexagonale.
Méthodes –
Les patients avec au moins un diagnostic codé par la Classification internationale des maladies, version 10 (CIM-10), d’infection à Echinococcus entre 2006 et 2022, ont été différenciés entre infections à Echinococcus multilocularis (EA), Echinococcus granulosus (EK) ou Echinococcus sans précision de l’espèce (Esp). L’incidence annuelle correspondait au nombre de nouveaux cas hospitalisés avec une infection à Echinococcus chaque année, rapporté à la population. Les évolutions de l’incidence ont été analysées par régression linéaire.
Résultats –
Au total 4 454 patients ont été inclus : 407 patients EA, 1 546 patients EK, 160 patients avec codages EA et EK, et 2 341 patients Esp. Les patients EA étaient principalement identifiés en Bourgogne-Franche-Comté, Grand Est et Auvergne-Rhône-Alpes. L’incidence annuelle moyenne dans l’Hexagone était de 0,04 cas hospitalisés/100 000 habitants, en diminution. La majorité des patients EK résidaient en Île-de-France, Auvergne-Rhône-Alpes, Provence-Alpes-Côte d’Azur et Grand Est. L’incidence annuelle moyenne était de 0,14/100 000 habitants, en diminution.
Conclusion –
Les tendances nationales montraient une diminution du nombre de nouveaux cas hospitalisés avec une EA ou une EK entre 2006 et 2022. Aucune région ne présentait d’augmentation de l’incidence de cas hospitalisés. Des imprécisions et possibles erreurs de codage des diagnostics limitent l’interprétation des diminutions observées.
Abstract
Introduction –
Alveolar echinococcosis (AE) is a zoonosis provoked in humans infected with the tapeworm Echinococcus multilocularis and cystic echinococcosis (CE) is provoked by infection with Echinococcus granulosus. We used data collected from French hospitals through the Medicalized Information System Program (PMSI) to analyze the geographical and temporal trends of new cases hospitalized with echinococcosis in mainland France.
Methods –
All patients hospitalized between 2006 and 2022 with at least one ICD-10 diagnostic code for Echinococcus infection were included. Patients were characterized according to the species causing the infection: Echinococcus multilocularis (AE), Echinococcus granulosus (CE) or unspecified Echinococcus (Esp). Annual incidence rates were calculated as the annual number of new patients identified divided by the total population. Trends of incidence over time were determined by linear regression analysis.
Results –
A total of 4,454 patients were included: 407 AE patients, 1,546 CE patients, 160 patients with both AE and CE codes, and 2,341 Esp patients. AE patients were mostly identified within the regions of Bourgogne-Franche-Comté, Grand Est and Auvergne-Rhône-Alpes. The mean annual incidence rate for mainland France was 0.04 hospitalized cases/100,000 inhabitants, with a decreasing trend. The majority of CE patients resided in the regions of Île-de-France, Auvergne-Rhône-Alpes, Provence-Alpes-Côte d’Azur and Grand Est. The mean annual incidence rate for mainland France was 0.14/100,000 inhabitants, with a decreasing trend.
Conclusion –
This analysis indicates a decrease in the number of new AE and CE patients between 2006 and 2022. No individual region showed an increase of new hospitalized patients. However, ICD-10 coding inaccuracies or errors hinder the interpretation of trends.
Introduction
Les échinococcoses sont des parasitoses zoonotiques causées par les larves d’un cestode du genre Echinococcus. L’échinococcose alvéolaire (EA) est due au développement du stade larvaire d’Echinococcus multilocularis chez l’être humain principalement au niveau du foie. Le cycle parasitaire se déroule principalement dans la faune sauvage entre le renard (hôte définitif) et les micromammifères rongeurs (hôtes intermédiaires), et dans une moindre mesure dans la faune domestique entre les chiens ou chats et les rongeurs 1. Les œufs du parasite, éliminés dans les déjections de carnivores, sont disséminés dans l’environnement. L’être humain se contamine accidentellement en ingérant des œufs présents sur des végétaux souillés (baies, pissenlits…) ou sur le pelage des hôtes définitifs. Chez les patients immunocompétents, les symptômes peuvent apparaître de nombreuses années après l’infestation. C’est une maladie rare, mais grave par son évolution invasive et sa capacité métastatique 2. En France, jusqu’à la fin des années 1990, la zone connue de présence du parasite dans la faune sauvage était limitée au Nord-Est et à l’Auvergne. Des campagnes d’analyse d’infestation des renards ont été menées entre 2000 et 2010 : elles appuyaient l’hypothèse d’une augmentation de la prévalence du parasite dans les zones d’endémicité historiques du Nord-Est, ainsi que d’une extension géographique, marquée vers l’Ouest 3,4, laissant craindre un risque d’augmentation des contaminations autochtones en France.
L’échinococcose kystique (EK) est due au développement du stade larvaire d’Echinococcus granuleuses, sensu lato, chez l’être humain, principalement au niveau du foie (60%), mais aussi du poumon (30%), ou d’autres localisations plus rares (reins, rate, os, cerveau). Le cycle parasitaire se déroule entre des hôtes définitifs carnivores (principalement le chien), et des hôtes intermédiaires herbivores (surtout ovins et caprins). L’homme est un hôte accidentel, qui se contamine par l’ingestion d’œufs de parasites présents sur le pelage du chien ou sur des végétaux consommés crus, souillés par des déjections infectantes. La présentation clinique est d’une grande diversité, souvent asymptomatique et de découverte fortuite, mais parfois la maladie est révélée par un tableau clinique aigu traduisant souvent un accident de fissuration ou de rupture du kyste pouvant mettre en jeu le pronostic vital 5,6. L’EK est moins sévère que l’EA mais reste une maladie invalidante, qui pèse sur le système de soins 7. C’est une zoonose cosmopolite, qui sévit dans les zones d’élevage extensif, principalement sur le pourtour méditerranéen, dans le nord et l’est de l’Afrique, en Europe de l’Est, en Amérique latine, et en Asie centrale 8. En France, l’identification en 2012 à l’abattage d’animaux de rente infestés par E. granulosus a montré que le parasite est présent sur le territoire et a soulevé la question du risque zoonotique autochtone 9. Les circonstances de contaminations humaines semblent toutefois spécifiques à des activités à risques (bergers, éleveurs de mouton, propriétaires de chiens en liberté) 10 peu répandues en France.
En France, la surveillance de l’EA est basée depuis 2003 sur le réseau de déclarants volontaires FrancEchino, coordonné depuis 2012 par le Centre national de référence Echinococcoses (CNR-E) 11. En 2023, le registre national de l’EA regroupait les données démographiques et médicales de 960 patients diagnostiqués entre 1982 et 2022. Une augmentation du nombre annuel de nouveaux cas diagnostiqués était observée 12.
La surveillance de l’EK a été initiée en 2017 avec la création de l’Observatoire français des cas d’échinococcose kystique (Ofrekys), coordonné par le CNR-E : la dispersion géographique des cas sur le territoire et leur prise en charge variée est un obstacle à l’exhaustivité du recueil de données. Les données d’Ofrekys disponibles en 2023 rassemblent les informations détaillées sur 103 cas diagnostiqués jusqu’en 2022, ce recueil n’étant pas exhaustif 12.
La présente étude a pour objectif d’utiliser les données du Programme de médicalisation des systèmes d’information (PMSI) pour identifier les cas hospitalisés avec une EA ou une EK. L’analyse des tendances temporelles et géographiques de l’incidence des nouveaux cas hospitalisés avec une échinococcose pourrait permettre d’identifier des signaux d’émergence ou d’augmentation des contaminations par Echinococcus en France hexagonale (1).
Méthodes
Les données du PMSI 13, qui repose sur le recueil de données médico-administratives des séjours hospitaliers, ont été utilisées. Les patients ont été inclus dans l’analyse s’ils présentaient au moins un diagnostic d’infection à Echinococcus (CIM-10 B67.0 à B67.9) lors d’un séjour hospitalier entre 2006 et 2022. Pour ce faire, l’ensemble des séjours hospitaliers en médecine, chirurgie, obstétrique (MCO) entre 2005 et 2022 codés avec un diagnostic principal (DP), relié (DR) ou associé (DAS) correspondant à un code de la Classification internationale des maladies (version 10), CIM-10 B67, ont été extraits (extraction 12 juin 2023). Les séjours sans identifiant valide ou avec des erreurs de codage ont été exclus de l’analyse. L’année du premier séjour de chaque patient avec un code Echinococcus a été considérée comme l’année de première prise en charge hospitalière du patient en France. Les patients avec une prise en charge en 2005 ont été exclus de l’analyse, car il n’était pas possible de certifier qu’il s’agissait de l’année de première prise en charge, en l’absence de données pour les années précédentes. L’analyse a porté sur les patients résidant en France hexagonale.
Les patients inclus dans l’analyse ont été différenciés en quatre profils, selon les codes CIM-10 identifiés sur l’ensemble de leurs séjours hospitaliers :
1) patients avec au moins un diagnostic d’infection à Echinococcus multilocularis et aucun diagnostic d’infection à Echinococcus granulosus, dénommés EA ;
2) patients avec au moins un diagnostic d’infection à Echinococcus granulosus et aucun diagnostic d’infection à Echinococcus multilocularis, dénommés EK ;
3) patients avec au moins un diagnostic d’infection à Echinococcus multilocularis et au moins un diagnostic d’infection à Echinococcus granulosus, dénommés EAEK ;
4) patients avec uniquement des diagnostics d’infection à Echinococcus sans précision de l’espèce, dénommés Esp.
L’âge du patient et sa région de résidence lors du premier séjour ont été utilisés pour l’analyse descriptive.
Pour les calculs d’incidences, seul le premier séjour identifié sur l’ensemble de la période 2006-2022 a été pris en compte pour chaque patient. L’incidence annuelle correspondait au nombre de nouveaux cas hospitalisés avec une infection à Echinococcus identifiés chaque année, rapporté à la population (2), et était exprimée en nombre de nouveaux cas hospitalisés pour 100 000 habitants par an (cas/100 000/an). Les incidences ont été calculées pour la France hexagonale et pour chaque région. Des incidences annuelles moyennes ont été calculées pour la période 2006-2022.
Les évolutions temporelles de l’incidence en France hexagonale et dans chaque région ont été analysées par régression linéaire (fonction lm du package R stats).
Les logiciels SAS Software® (8.3 ; SAS Institute Inc. 2020) et R Statistical Software® (4.3.1 ; R Core Team 2023) ont été utilisés.
Résultats
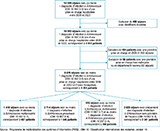
Au total 4 454 nouveaux cas hospitalisés avec une échinococcose entre 2006 et 2022 ont été identifiés, totalisants 8 076 séjours : 407 patients EA (1 418 séjours), 1 546 patients EK (2 714 séjours), 160 patients EAEK (916 séjours) et 2 341 patients Esp (3 028 séjours) (figure 1, tableau 1).
 Agrandir l'image
Agrandir l'image Agrandir l'image
Agrandir l'imagePatients avec codages EA
Les patients EA présentaient un âge moyen de 56 ans à leur première hospitalisation et 50% étaient des hommes. La moitié des patients résidaient en Bourgogne-Franche-Comté (26%) et Grand Est (24%). Quarante pour cent avaient eu un seul séjour hospitalier avec échinococcose (EA) sur la période 2006-2022 (tableau 1).
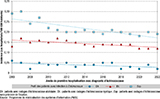
Sur l’ensemble de la période d’analyse, l’incidence annuelle moyenne était de 0,04 cas/100 000 habitants. L’analyse de régression de l’incidence montrait une diminution annuelle de 0,001/100 000 (R-carré ajusté=0,21 ; p=0,037) en France hexagonale entre 2006 et 2022 (tableau 2, figure 2).
La Bourgogne-Franche-Comté et le Grand Est présentaient les effectifs et incidences de nouveaux cas hospitalisés les plus élevés. L’incidence des résidents nouvellement hospitalisés avec EA était statistiquement significativement décroissante en Bourgogne-Franche-Comté, Auvergne-Rhône-Alpes, Corse et Provence-Alpes-Côte d’Azur. Aucune région ne présentait d’augmentation statistiquement significative de l’incidence annuelle.
 Agrandir l'image
Agrandir l'image2006-2022
 Agrandir l'image
Agrandir l'imagePatients avec codages EK
Les patients EK présentaient un âge moyen à leur première hospitalisation de 49 ans et 51% étaient des hommes. La majorité des cas (66%) résidaient en Île-de-France (22%), Auvergne-Rhône-Alpes (17%), Provence-Alpes-Côte d’Azur (14%) et Grand Est (13%). Plus de la moitié (63%) avaient eu un seul séjour hospitalier avec échinococcose (EK) sur la période 2006-2022 (tableau 1).
Sur l’ensemble de la période d’analyse, l’incidence annuelle moyenne était de 0,14/100 000. L’analyse de régression de l’incidence montrait une diminution annuelle de 0,0022/100 000 (R-carré ajusté=0,44 ; p=0,002) en France hexagonale entre 2006 et 2022 (tableau 3, figure 2).
La Corse présentait l’incidence la plus élevée (0,65/100 000/an), mais ne comptait que 2 nouveaux cas hospitalisés par an en moyenne. Les régions Provence-Alpes-Côte d’Azur et Grand Est présentaient des incidences (respectivement 0,26 et 0,21/100 000/an) et des effectifs (respectivement 13 et 12 nouveaux cas hospitalisés par an en moyenne) élevés. L’Île-de-France rassemblait le nombre le plus élevé de nouveaux cas hospitalisés, avec en moyenne 20 cas par an, pour une incidence annuelle moyenne de 0,17/100 000. Les diminutions de l’incidence étaient statistiquement significatives en Corse et Auvergne-Rhône-Alpes. Aucune région ne présentait d’augmentation statistiquement significative de l’incidence annuelle.
 Agrandir l'image
Agrandir l'imagePatients avec codages EAEK
Les patients EAEK étaient minoritaires, ils présentaient un profil plus proche des patients EA que des patients EK, en terme de distribution géographique et suivi hospitalier (tableau 1). L’analyse des séjours avec un DP codé B67 de ces patients montraient que 56% des séjours correspondaient à un DP d’infection à Echinococcus multilocularis, 31% d’infection à Echinococcus granulosus et 13% d’infection à Echinococcus sans précision de l’espèce.
Dans une sous-analyse, les patients EAEK ont été regroupés avec les patients EA. L’incidence annuelle moyenne des nouveaux patients EAEK avec EA était de 0,05/100 000. L’analyse de régression de l’incidence montrait une diminution annuelle de 0,002/100 000 (R-carré ajusté=0,47 ; p=0,001) en France hexagonale entre 2006 et 2022. Les diminutions par région étaient statistiquement significatives en Bourgogne-Franche-Comté, Corse, Provence-Alpes-Côte d’Azur et Auvergne-Rhône-Alpes. L’incidence était en augmentation statistiquement significative dans les Pays de la Loire.
Patients avec codages Esp
Les patients Esp représentaient plus de la moitié des cas inclus (53%). Ils présentaient un âge moyen à leur première hospitalisation de 54 ans et 51% étaient des hommes. La moitié des patients identifiés résidaient en Île-de-France (23%), Provence-Alpes-Côte d’Azur (15%) et Auvergne-Rhône-Alpes (14%). La plupart (82%) avaient eu un seul séjour hospitalier avec échinococcose (sans précision de l’espèce) sur la période 2006-2022 (tableau 1).
Sur l’ensemble de la période d’analyse, l’incidence annuelle moyenne était de 0,22/100 000. L’analyse de régression de l’incidence montrait une diminution annuelle de 0,006/100 000 (R-carré ajusté=0,64 ; p<0,001) en France hexagonale entre 2006 et 2022 (tableau 4, figure 2).
La Corse et la Provence-Alpes-Côte d’Azur présentaient les incidences annuelles moyennes les plus élevées (supérieures à 0,40/100 000). Les régions Auvergne-Rhône-Alpes, Île-de-France, Occitanie et Provence-Alpes-Côte d’Azur présentaient des tendances significatives à la diminution de l’incidence. La Bourgogne-Franche-Comté et la Normandie présentaient une augmentation de l’incidence à la limite de la significativité statistique. L’Île-de-France rassemblait le nombre le plus élevé de nouveaux cas hospitalisés, avec en moyenne 32 cas par an.
Le profil des patients Esp était plus proche de celui des patients EK que celui des patients EA concernant la distribution géographique et le suivi hospitalier (94% des patients Esp avec moins de 3 séjours, contre 83% des patients EK et 58% des patients EA).
Dans une sous-analyse, les patients Esp ont été regroupés avec les patients EK. L’incidence annuelle moyenne des patients Esp avec EK était alors de 0,36/100 000/an. L’analyse de régression de l’incidence en France hexagonale montrait une diminution annuelle de 0,008/100 000 (R-carré ajusté=0,72 ; p<0,001). Les diminutions de l’incidence étaient statistiquement significatives en Corse, Provence-Alpes-Côte d’Azur, Occitanie, Auvergne-Rhône-Alpes, Grand Est et Île-de-France. Aucune région ne présentait d’augmentation statistiquement significative de l’incidence annuelle.
 Agrandir l'image
Agrandir l'imageDiscussion
L’analyse des données hospitalières a permis l’identification des patients nouvellement hospitalisés avec une échinococcose, montrant que l’incidence annuelle des nouveaux cas hospitalisés en France hexagonale était globalement en diminution pour les deux formes d’échinococcose. Aucune région ne présente de tendance à l’augmentation des nouveaux cas hospitalisés.
L’incidence des cas hospitalisés avec EA était la plus élevée dans le Nord-Est de la France, les régions Bourgogne-Franche-Comté et Grand Est étant les plus touchées. Ces résultats concordent avec les données publiées par le CNR-E qui identifie une concentration des cas d’EA diagnostiqués et inclus dans le registre FrancEchino depuis 1982 dans ces régions 12, qui sont aussi les zones d’endémie historiques du parasite dans la faune sauvage 3.
Les diminutions des nouveaux cas hospitalisés avec EA au cours du temps contrastent toutefois avec les données publiées par le CNR-E qui observe une augmentation du nombre annuel de cas d’EA recensés dans le registre FrancEchino, passant de 18 cas diagnostiqués en 2006 à 40 cas diagnostiqués en 2022 (année en cours de consolidation) 12. La complétude des données du registre est assurée par les cliniciens experts du CNR-E. L’augmentation du nombre de cas d’EA enregistrés dans le registre, en regard de la diminution des nouveaux cas hospitalisés dans les 15 dernières années, pourrait s’expliquer par l’augmentation des cas avec un premier diagnostic posé à un stade précoce, du fait de l’amélioration des performances des techniques d’imagerie et de leur utilisation de plus en plus massive. Les données du registre montrent une augmentation de la proportion de diagnostics fortuits chez les nouveaux cas, à un stade asymptomatique, au cours du temps (60% sur 2014-2018, 50% sur 2003-2013, 37% sur 1992-2002) 2. Ces cas asymptomatiques ou moins sévères nécessiteraient uniquement un suivi par consultations externes (suivi du traitement par albendazole), sans hospitalisation, et pourraient ne pas être identifiés par le PMSI. En raison de l’augmentation des prises en charge initiales hors circuit d’hospitalisation, les données du PMSI ne permettraient donc pas d’estimer l’incidence des cas en France.
Si l’on considère qu’une grande part des cas d’EK en France sont importés, la diminution des nouvelles hospitalisations pourrait être le reflet, outre d’un suivi en consultation externe pour les mêmes raisons que pour l’EA, d’une diminution des contaminations ou d’une amélioration de la prise en charge dans les pays d’origine, entraînant une diminution des récidives qui sont une cause fréquente de prise en charge en hospitalisation.
Les régions les plus touchées pour les cas hospitalisés avec EK (incidences les plus élevées) étaient les régions du Sud-Est de la France, en particulier la Corse et la Provence-Alpes-Côte d’Azur. Dans ces deux régions, le parasite a été identifié dans les élevages ovins et porcins 9 et le type d’élevage pratiqué (activités pastorales) peut expliquer quelques cas autochtones. L’incidence élevée en Île-de-France est probablement liée à la présence de populations immigrées originaires de pays endémiques. L’identification du Grand Est et de la Bourgogne-Franche-Comté parmi les régions fortement touchées est à première vue surprenante, ces régions étant plutôt connues comme des zones d’endémie dans la faune sauvage pour Echinococcus multilocularis, responsable de l’EA. Aucun élément, à notre connaissance, ne peut expliquer un plus grand nombre de cas importés d’EK dans ces zones, ou un risque plus élevé de contaminations autochtones par Echinococcus granulosus. L’absence d’information sur l’origine importée ou autochtone de l’infection pour les cas d’EK identifiés dans le PMSI limite la compréhension de l’épidémiologie de la maladie et l’évaluation du risque zoonotique autochtone.
En effet, la principale limite de notre étude réside dans la qualité du codage des diagnostics dans le PMSI : plus de la moitié des patients inclus dans cette étude présentaient uniquement des séjours avec diagnostics codés échinococcose sans précision de l’espèce. Ils représentaient plus de 60% des patients résidant en Bretagne, Nouvelle-Aquitaine, Occitanie et Provence-Alpes-Côte d’Azur. Ils étaient moins fréquents en Bourgogne-Franche-Comté et dans le Grand Est (respectivement 36% et 40% des patients inclus). Ces codages sans précision de l’espèce semblaient donc un peu moins fréquents dans des zones historiquement confrontées à l’EA, où les cliniciens seraient plus précis dans leur codage que les cliniciens des zones historiquement non touchées par l’EA. Ces disparités d’activité de codage complexifient aussi les interprétations des tendances par région.
Dans une précédente étude conduite en 2014 par Santé publique France sur la base des données du PMSI, les patients codés sans précision de l’espèce avaient été inclus dans l’analyse des cas d’EK 14. Dans la présente étude, ils étaient plus similaires aux patients EK qu’aux patients EA sur la base de leur distribution géographique ainsi que certaines caractéristiques de leurs séjours hospitaliers.
Une part non négligeable de patients présentaient à la fois des codages EA et EK, parfois même lors d’un même séjour. La coprésence de formes alvéolaires et kystiques chez un même patient est extrêmement rare 15 et n’a jamais été documentée en France. L’analyse des patients EAEK avec les patients EA peut être justifiée par une plus grande similarité avec les patients EA qu’avec les patients EK, sans pouvoir exclure qu’il s’agisse d’un mélange de patients EA et de patients EK.
Une seconde limite à cette étude résidait dans la méthode d’identification des nouveaux cas hospitalisés. Les données disponibles du PMSI ne couvrent que 2005-2022 et seuls les patients dont la première prise en charge était identifiée en 2005 ont été exclus. Ceci induit un risque de surestimation des nouveaux patients identifiés, qui est plus élevé en début de période d’analyse car il y a moins d’années de recul. En conséquence, les diminutions de l’incidence pourraient être surestimées. Il est difficile d’évaluer cette possible surestimation : seuls 31% des patients avaient plus d’un séjour dans le PMSI même si parmi eux, 84% avaient eu au moins un séjour par an en moyenne.
Enfin, le sous-recours aux soins pendant la pandémie de Covid-19 pourrait avoir contribué à la diminution de l’incidence des hospitalisations en 2020-2022. Il sera opportun de vérifier les tendances en incluant les données hospitalières des années suivantes.
Étant donné l’évolution de la prise en charge de l’échinococcose et les limites du PMSI, ce dernier ne semble pas permettre une estimation valide de l’incidence des cas et une analyse fiable de l’évolution de l’épidémiologie de l’EA en France. Le PMSI reste toutefois utile pour estimer l’ampleur des cas d’EK pris en charge en hospitalisation en France. L’analyse approfondie du registre FrancEchino et de l’observatoire Ofrekys apparaît donc essentielle à la compréhension de l’épidémiologie de ces maladies en France hexagonale et à l’identification de signaux anormaux (par exemple augmentation du nombre de cas autochtones ou apparition de formes cliniques inhabituelles).
Liens d’intérêt
Les auteurs déclarent ne pas avoir de liens d’intérêt au regard du contenu de l’article.